
- •Таврійський державний агротехнологічний університет
- •Змістовий модуль I. Неорганічна хімія
- •Тема 5. Гідроген. Хімія лужних металів. Хімія лужно - земельних елементів.
- •Змістовий модуль іі. Фізична та колоїдна хімія
- •Тема 14. Дисперсні системи та їх класифікація.
- •Тема 15. Мікрогетерогенні системи.
- •Тема 16. Напівколоїди та розчини високомолекулярних сполук.
- •Розподіл балів, що присвоюються студентам
- •Техніка безпеки та правила роботи в хімічній лабораторії Вимоги безпеки перед початком роботи
- •Вимоги безпеки під час роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в аварійних ситуаціях
- •Розділ і. Неорганічна хімія Лабораторна робота №1. Класи неорганічних сполук
- •Вимоги до знань та умінь
- •Теоретична частина
- •Оксиди.
- •Кислоти.
- •Основи.
- •Амфоліти.
- •Паспорт роботи
- •Експериментальна частина Техніка безпеки.
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •ТермоХімія. Мета роботи – навчитися експериментально визначати ентальпію хімічних реакцій і робити розрахунки, використовуючи термохімічні рівняння.
- •Фактори, що визначають напрямок хімічних реакцій.
- •Паспорт роботи.
- •Експериментальна частина
- •Хід роботи.
- •Результати. Оформлення роботи.
- •Контрольні питання.
- •Рекомендована література
- •Лабораторна робота №5. Кінетика та швидкість хімічних реакцій
- •Вимоги до знань та умінь
- •Теоретична частина
- •Хімічна рівновага
- •Паспорт роботи
- •Експеріментальна частина
- •Контрольні питання
- •Рекомендована література
- •Лабораторна робота №6. Періодична система та періодичний закон д.І. Менделєєва
- •Вимоги до знань та умінь
- •Теоретична частина
- •Періодична система і будова атома.
- •Контрольні питання
- •Лабораторна робота №7. Властивості гідрогену та його сполук
- •Теоретична частина
- •Проста речовина
- •Практична частина Одержання та властивості Гідрогену. Окисно-відновні властивості Гідрогену.
- •Контрольні питання
- •Лабораторна робота №8. Властивості лужних металів.
- •Теоретична частина
- •Практична частина Властивості лужних металів та їх сполук.
- •Контрольні питання
- •Лабораторна робота №9. Властивості лужноземельних металів.
- •Теоретична частина
- •Практична частина Властивості лужноземельних металів та їх сполук
- •Контрольні питання
- •Елементи іv – а групи
- •Властивості Алюмінію, Карбону, Силіцію, Стануму, Плюмбуму та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 8 Властивості Нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Галогени
- •Практична частина Властивості р-елементів та її сполук.
- •Контрольні питання
- •Лабораторна робота №13. Загальна характеристика d-елементів
- •Теоретична частина
- •Практична частина
- •Контрольні питання
- •Лабораторна робота №14. Тема: комплексні сполуки
- •Експериментальна робота Комплексні сполуки та їх властивості.
- •Контрольні питання
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 16. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 17. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 18. Розчини електролітів
- •Гідроліз солей
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 19. Поверхневі явища та адсорбційні рівноваги
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 20. Дисперсні систем та їх класифікація
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Контрольні питання:
-
Який газ називають ідеальним? Виведіть рівняння стану ідеального газу.
-
Сформулюйте закон Дальтона. Який зв’язок між парціальним тиском компоненту та загальним тиском суміші?
-
Що таке критична температура, критичний тиск, критичний об’єм? Як визначаються ці величини?
-
З головного рівняння кінетичної теорії газів виведіть газові закони?
-
Дайте загальну характеристику рідкого стану. Яка структура рідини? Які сили діють у рідинах?
-
Які види твердих сполук відомі? Надайте характеристику властивостей твердої речовини. Яка найбільш загальна ознака присуща кришталевим речовинам?
-
У чому полягає схожість та різність між рідкими та твердими речовинами?
Задачі:
-
За методом В. Майера визначалась молекулярна маса етилового ефіру. При випарюванні 0,0856 г ефіру його пари витиснули у евдіометричну трубку 29,2 мл повітря; висота водяного стовпу у евдіометричній трубці 22,5 см, температура повітря 170С, атмосферний тиск 754 мм рт ст. Тиск насиченого пару води при 170С дорівнює 14,53 мм рт ст. Визначити молекулярну масу ефіру та знайти відносну помилку досліду у відсотках.
-
Змішано 3 л водню під тиском 2*105 Па з 2 л кисню під тиском в 1*105 Па. Загальний об’єм суміші дорівнює 4л. Визначити парціальний тиск газів та загальний тиск суміші.
-
Суміш з двох молей азоту, трьох молей кисню та деякої кількості аміаку при 200С та тиску 4*105 Па займає об’єм 40 дм3. Визначити число молей аміаку у суміші та парціальний тиск кожного з газів.
-
Водень (0,5 моль) та 0,25 моль азоту знаходяться у газометрі ємністю 5 л при 100С. Визначити парціальний тиск кожного з газів та склад суміші у об’ємних відсотках.
-
Визначити тиск кисню при 00С, якщо у 10 л знаходиться 0,25 моль його. Середня квадратична швидкість молекул кисню при цій температурі дорівнює 461 м/сек.
-
При якій температурі середня квадратична швидкість молекул хлору буде дорівнювати 500 м/сек?
Лабораторна робота № 16. Розчини неелектролітів
Мета роботи – ознайомитися із впливом концентрації розчинів неелектролітів на зниження температури їх замерзання та підвищення їх температури кипіння.
ТЕОРЕТИЧНА ЧАСТИНА
Способи вираження складу розчину
Розчином називають однорідну систему, яка складається з двох або декількох компонентів.
Стан розчину визначається температурою, тиском та складом. Кількісний склад розчину може мати вираз різними способами та в різних одиницях. Розглянемо деякі з них.
-
Масова доля ω – відношення маси компонента до загальної маси розчину:
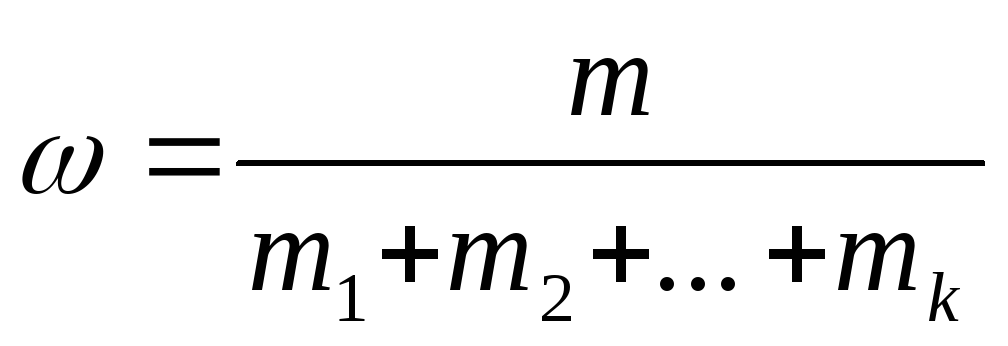 (1) де m1,
m2…mk
– маса компонентів розчину.
(1) де m1,
m2…mk
– маса компонентів розчину. -
Молярна доля Х – відношення кількості речовини (n) компонента до загальної кількості речовини:
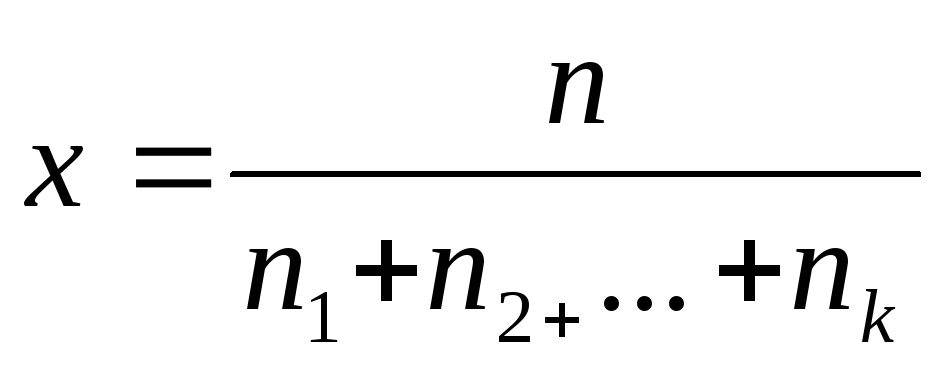 (2) Сума молярних долей усіх компонентів
дорівнює одиниці:
(2) Сума молярних долей усіх компонентів
дорівнює одиниці:

-
Об’ємна доля φ – компонента – відношення об’єму компонента, який міститься у розчині, до загального об’єму розчину:
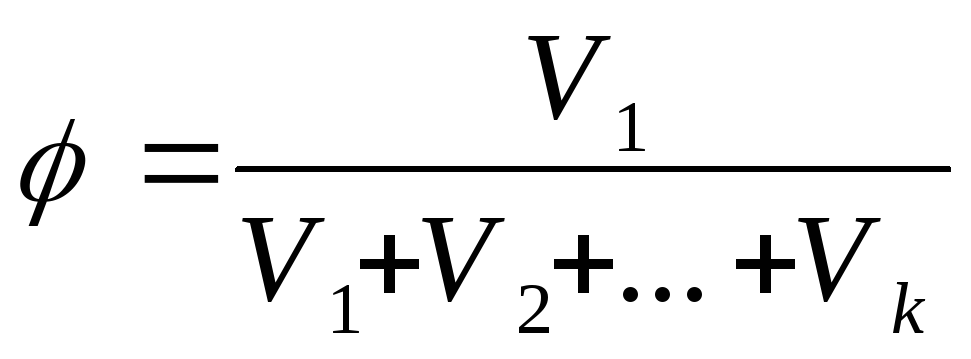 ,
(3) де V1,
V2…Vk
– об’єми компонентів. Для ідеальних
газів склад, який має вираз у об’ємній
долі, співпадає з молярною долею.
Масова, молярна та об’ємні долі
компонентів речовин – відносні
показники, тому їх одиниці є долі одиниці
або відсотки.
,
(3) де V1,
V2…Vk
– об’єми компонентів. Для ідеальних
газів склад, який має вираз у об’ємній
долі, співпадає з молярною долею.
Масова, молярна та об’ємні долі
компонентів речовин – відносні
показники, тому їх одиниці є долі одиниці
або відсотки.
-
Молярна концентрація (концентрація кількості речовини) с(Х) частин Х – відношення кількості речовини n (X), яка міститься у розчині до об’єму V розчину:
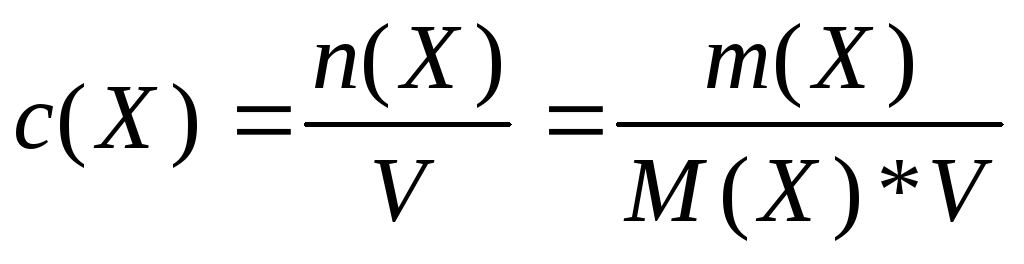 (4) Одиницею молярної концентрації
є моль/м3.
Частіше застосовують моль/л або
моль/дм3.
(4) Одиницею молярної концентрації
є моль/м3.
Частіше застосовують моль/л або
моль/дм3.
-
Молярна концентрація еквіваленту *
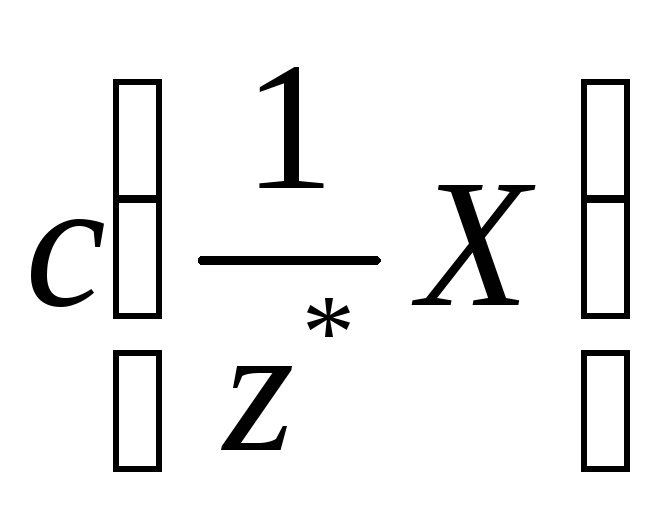 - відношення кількості речовини
- відношення кількості речовини
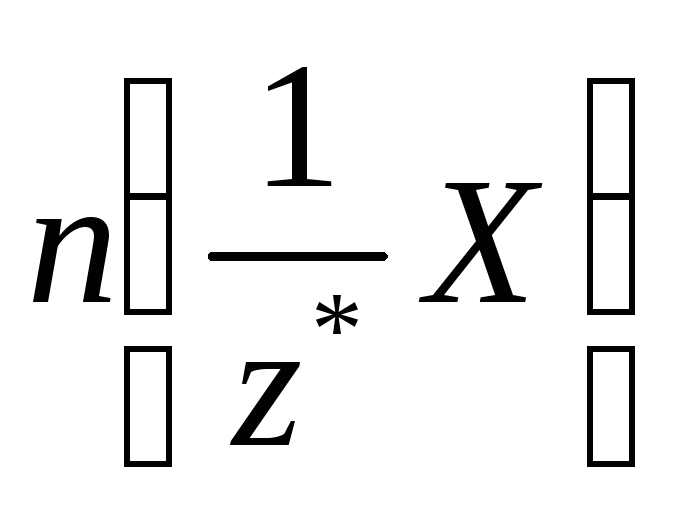 еквіваленту до загального об’єму V
розчину:
еквіваленту до загального об’єму V
розчину:
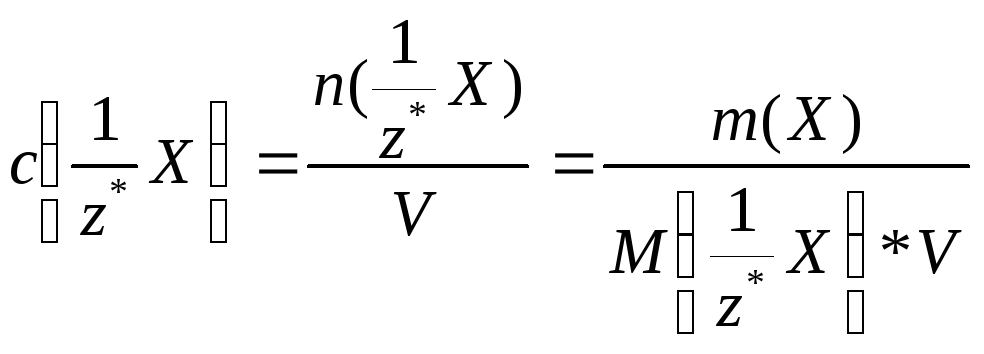 (4а) або
(4а) або
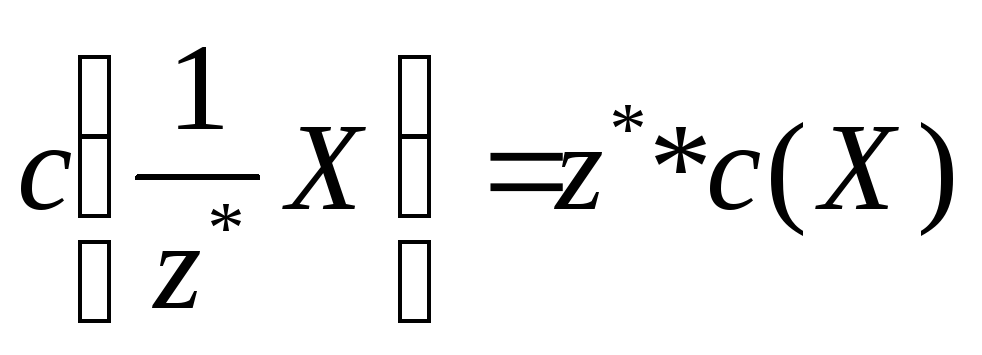 (4б)
Одиницею молярної концентрації
еквіваленту є моль/м3.
Частіше застосовують моль/л або моль/дм3.
(4б)
Одиницею молярної концентрації
еквіваленту є моль/м3.
Частіше застосовують моль/л або моль/дм3.
-
Моляльність b(X) розчину – відношення кількості речовини n (X) розчинених часток Х до маси m розчинника:
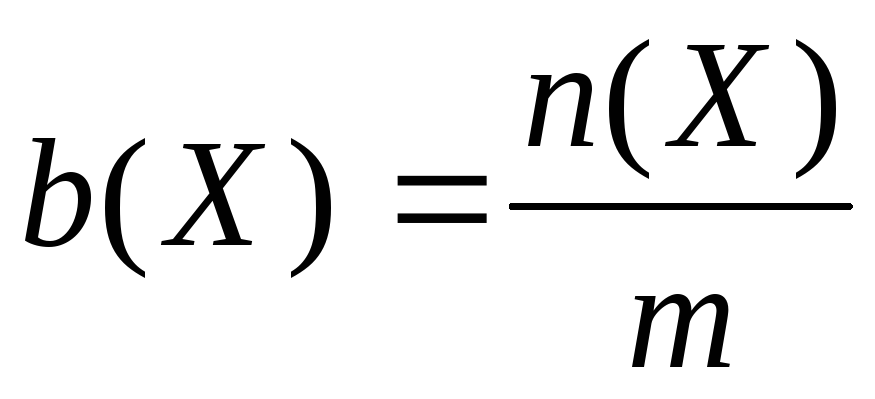 (5) Одиницею моляльності є моль/кг.
(5) Одиницею моляльності є моль/кг.
Для переходу від одного способу вираження складу розчину до іншого необхідно знати молярні маси розчинників (М1) та розчинної речовини (М2) та у ряді випадків густина розчину (ρ). Нижче наведені формули для такого переходу, де усі величини повинні бути виражені тільки в одиницях СІ: молярні маси у кг/моль, густина у кг/м3, молярна концентрація у моль/м3 , моляльність у моль/кг, а масова та молярна долі у долях від одиниці:
![]() (6)
(6)
![]() (7)
(7)
![]() (8)
(8)
![]() (9)
(9)
Для переходу від молярної концентрації до молярної концентрації еквіваленту використовують рівняння (4б). Число еквівалентності Z для даної речовини визначається як добуток ступеню окислення металу (кислотного залишку) на число атомів металу (число кислотних залишків) у молекулі.
