
- •Таврійський державний агротехнологічний університет
- •Змістовий модуль I. Неорганічна хімія
- •Тема 5. Гідроген. Хімія лужних металів. Хімія лужно - земельних елементів.
- •Змістовий модуль іі. Фізична та колоїдна хімія
- •Тема 14. Дисперсні системи та їх класифікація.
- •Тема 15. Мікрогетерогенні системи.
- •Тема 16. Напівколоїди та розчини високомолекулярних сполук.
- •Розподіл балів, що присвоюються студентам
- •Техніка безпеки та правила роботи в хімічній лабораторії Вимоги безпеки перед початком роботи
- •Вимоги безпеки під час роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в аварійних ситуаціях
- •Розділ і. Неорганічна хімія Лабораторна робота №1. Класи неорганічних сполук
- •Вимоги до знань та умінь
- •Теоретична частина
- •Оксиди.
- •Кислоти.
- •Основи.
- •Амфоліти.
- •Паспорт роботи
- •Експериментальна частина Техніка безпеки.
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •ТермоХімія. Мета роботи – навчитися експериментально визначати ентальпію хімічних реакцій і робити розрахунки, використовуючи термохімічні рівняння.
- •Фактори, що визначають напрямок хімічних реакцій.
- •Паспорт роботи.
- •Експериментальна частина
- •Хід роботи.
- •Результати. Оформлення роботи.
- •Контрольні питання.
- •Рекомендована література
- •Лабораторна робота №5. Кінетика та швидкість хімічних реакцій
- •Вимоги до знань та умінь
- •Теоретична частина
- •Хімічна рівновага
- •Паспорт роботи
- •Експеріментальна частина
- •Контрольні питання
- •Рекомендована література
- •Лабораторна робота №6. Періодична система та періодичний закон д.І. Менделєєва
- •Вимоги до знань та умінь
- •Теоретична частина
- •Періодична система і будова атома.
- •Контрольні питання
- •Лабораторна робота №7. Властивості гідрогену та його сполук
- •Теоретична частина
- •Проста речовина
- •Практична частина Одержання та властивості Гідрогену. Окисно-відновні властивості Гідрогену.
- •Контрольні питання
- •Лабораторна робота №8. Властивості лужних металів.
- •Теоретична частина
- •Практична частина Властивості лужних металів та їх сполук.
- •Контрольні питання
- •Лабораторна робота №9. Властивості лужноземельних металів.
- •Теоретична частина
- •Практична частина Властивості лужноземельних металів та їх сполук
- •Контрольні питання
- •Елементи іv – а групи
- •Властивості Алюмінію, Карбону, Силіцію, Стануму, Плюмбуму та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 8 Властивості Нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Галогени
- •Практична частина Властивості р-елементів та її сполук.
- •Контрольні питання
- •Лабораторна робота №13. Загальна характеристика d-елементів
- •Теоретична частина
- •Практична частина
- •Контрольні питання
- •Лабораторна робота №14. Тема: комплексні сполуки
- •Експериментальна робота Комплексні сполуки та їх властивості.
- •Контрольні питання
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 16. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 17. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 18. Розчини електролітів
- •Гідроліз солей
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 19. Поверхневі явища та адсорбційні рівноваги
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 20. Дисперсні систем та їх класифікація
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Температура кипіння розведених розчинів
Рідина кипить при температурі, при який тиск насиченого пару рідини дорівнює атмосферному тиску. Так як тиск насиченого пару розчинів нелетучих або малолетучих речовин менший за тиск насиченого пару розчинника, то ці розчини киплять при більш високій температурі, ніж розчинник. Для розведених розчинів таких речовин Рауль установив, що збільшення температури кипіння розчину пропорційне його моляльності.
Закони зниження температури замерзання розведених розчинів та підвищення температури їх кипіння подібні, тому й формули для підвищення температури кипіння (18-20) будуть аналогічні формулам (15-17):
∆tкіп=Kе*b (18)
![]() (19)
(19)
![]() (20)
(20)
де Δt – підвищення температури кипіння розчинів, яке дорівнює різності температур кипіння розчину (t) та розчинника (t0); ∆t= t -t0; Ке –ебуліоскопічна константа. Ебуліоскопічна константа показує на скільки градусів вище кипить одномоляльний розчин неелектроліту порівняно з чистим розчинником; вона залежить тільки від природи розчинника: для води Ке = 0,52 ; для бензолу Ке = 5,5; для оцтової кислоти Ке = 16,65.
Осмотичний тиск
Вант – Гофф встановив, що осмотичний тиск розведених розчинів підлягає законам, подібним законам ідеальних газів.
Осмотичний тиск розведених розчинів чисельно дорівнює тому тиску, який би виготовляв дану кількість розчиненої речовини, якщо б воно знаходилось у газоподібному стані при заданій температурі та займало об’єм розчину (закон Вант - Гофф).
Рівняння (1,5,6,7,8,9 лабораторної роботи 1) застосовуються до розчинених розчинів, якщо в них тиск газу замінити осмотичним тиском. Наприклад, рівняння 1 має вигляд:
Pосм*V=nRT
(21) де Росм
– осмотичний тиск, V
– об’єм розчину, n
– кількість розчиненої речовини, моль,
T
- абсолютна температура, R
- молярна газова постійна. Вставляючи
у цей вираз молярну концентрацію С=![]() , отримуємо
, отримуємо
Pосм=cRT (22)
Рівняння 21 показує, що при постійній температурі та об’ємі осмотичний тиск залежить тільки від числа розчинених частин та не залежить від природи розчиненої речовини. Якщо осмотичний тиск визначається на досліді та знаємо температуру та концентрацію розчину, то можна розрахувати відносну молекулярну масу розчиненої речовини.
Для дуже розведених розчинів у тих випадках, коли молярну концентрацію розчину (моль/л) можно дорівняти до моляльності, з рівняння (22) та (15) отримуємо співвідношення
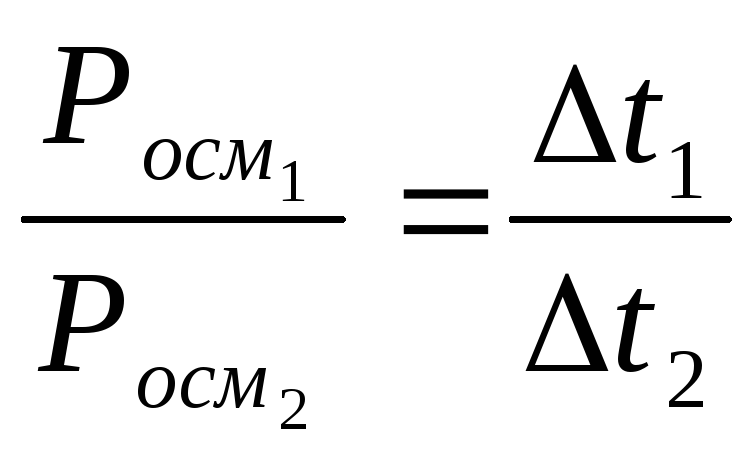 (23)
де Росм 1 та
Росм 2
– осмотичний тиск відповідно першого
та другого розчинів, ∆t1
та ∆t2
зниження температури їх замерзання.
(23)
де Росм 1 та
Росм 2
– осмотичний тиск відповідно першого
та другого розчинів, ∆t1
та ∆t2
зниження температури їх замерзання.
