
- •Таврійський державний агротехнологічний університет
- •Змістовий модуль I. Неорганічна хімія
- •Тема 5. Гідроген. Хімія лужних металів. Хімія лужно - земельних елементів.
- •Змістовий модуль іі. Фізична та колоїдна хімія
- •Тема 14. Дисперсні системи та їх класифікація.
- •Тема 15. Мікрогетерогенні системи.
- •Тема 16. Напівколоїди та розчини високомолекулярних сполук.
- •Розподіл балів, що присвоюються студентам
- •Техніка безпеки та правила роботи в хімічній лабораторії Вимоги безпеки перед початком роботи
- •Вимоги безпеки під час роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в аварійних ситуаціях
- •Розділ і. Неорганічна хімія Лабораторна робота №1. Класи неорганічних сполук
- •Вимоги до знань та умінь
- •Теоретична частина
- •Оксиди.
- •Кислоти.
- •Основи.
- •Амфоліти.
- •Паспорт роботи
- •Експериментальна частина Техніка безпеки.
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •ТермоХімія. Мета роботи – навчитися експериментально визначати ентальпію хімічних реакцій і робити розрахунки, використовуючи термохімічні рівняння.
- •Фактори, що визначають напрямок хімічних реакцій.
- •Паспорт роботи.
- •Експериментальна частина
- •Хід роботи.
- •Результати. Оформлення роботи.
- •Контрольні питання.
- •Рекомендована література
- •Лабораторна робота №5. Кінетика та швидкість хімічних реакцій
- •Вимоги до знань та умінь
- •Теоретична частина
- •Хімічна рівновага
- •Паспорт роботи
- •Експеріментальна частина
- •Контрольні питання
- •Рекомендована література
- •Лабораторна робота №6. Періодична система та періодичний закон д.І. Менделєєва
- •Вимоги до знань та умінь
- •Теоретична частина
- •Періодична система і будова атома.
- •Контрольні питання
- •Лабораторна робота №7. Властивості гідрогену та його сполук
- •Теоретична частина
- •Проста речовина
- •Практична частина Одержання та властивості Гідрогену. Окисно-відновні властивості Гідрогену.
- •Контрольні питання
- •Лабораторна робота №8. Властивості лужних металів.
- •Теоретична частина
- •Практична частина Властивості лужних металів та їх сполук.
- •Контрольні питання
- •Лабораторна робота №9. Властивості лужноземельних металів.
- •Теоретична частина
- •Практична частина Властивості лужноземельних металів та їх сполук
- •Контрольні питання
- •Елементи іv – а групи
- •Властивості Алюмінію, Карбону, Силіцію, Стануму, Плюмбуму та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 8 Властивості Нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Галогени
- •Практична частина Властивості р-елементів та її сполук.
- •Контрольні питання
- •Лабораторна робота №13. Загальна характеристика d-елементів
- •Теоретична частина
- •Практична частина
- •Контрольні питання
- •Лабораторна робота №14. Тема: комплексні сполуки
- •Експериментальна робота Комплексні сполуки та їх властивості.
- •Контрольні питання
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 16. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 17. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 18. Розчини електролітів
- •Гідроліз солей
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 19. Поверхневі явища та адсорбційні рівноваги
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 20. Дисперсні систем та їх класифікація
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Контрольні питання:
-
Дисоціація води. Що називають іонним добутком води?
-
Поняття про водневий (рН) та гідроксильний (рОН) показники.
-
Поняття про буферні розчини.
-
Буферна ємність.
-
Гідроліз солей.
Задачі:
-
Розрахуйте рН розчину, що містить 0,001 моль/л гідроксиду барію.
-
Концентрація іонів водню у розчині дорівнює 4*10-3 моль/л. Обчислити рН розчину.
-
Обчислити концентрацію іонів водню у розчині, рН якого дорівнює 4,60.
-
Обчислити концентрацію НСО3 - та СО3 2- у 0,01М розчині вугільної кислоти, якщо рН цього розчину дорівнює 4,18.
-
Обчислити ступінь гідролізу ацетату калію у 0,1М розчині та рН розчину.
Лабораторна робота № 19. Поверхневі явища та адсорбційні рівноваги
Мета роботи – ознайомлення студентів з класифікацією сорбційних процесів, теорією адсорбції та характеристикою поверхневих явищ.
ТЕОРЕТИЧНА ЧАСТИНА
Явище поглинання твердими або рідкими тілами речовин з навколишньої середи має назву сорбції. Сорбція, яка проходить тільки на поверхні тіла, має назву адсорбції. Якщо поглинання проходить по всій товщині, то таке явище має назву абсорбції.
Адсорбцію виражають в молях на квадратний метр. Але площу поверхні поглинувача знайти важчі, ніж його масу, тому частіше адсорбцію виражають у моль/ кг, а адсорбцію газів – у кубічних метрах на кілограм.
Величина адсорбції залежить від природи адсорбенту та адсортбату, від температури, від тиску газу або концентрації розчиненої речовини. Залежність адсорбції від тиску газоподібної речовини виражається емпіричним рівнянням Фрейндлиха:
![]() (1)
де х – кількість адсорбату в молях або
об’єм в метрах кубічних, m
– маса поглинача, кг, р – тиск, Па, а або
n
– константи, які характерні для даного
процесу адсорбції (n>1).
(1)
де х – кількість адсорбату в молях або
об’єм в метрах кубічних, m
– маса поглинача, кг, р – тиск, Па, а або
n
– константи, які характерні для даного
процесу адсорбції (n>1).
Так як це рівняння справедливе тільки при постійній температурі, то його називають ізотермою адсорбції.
Константи
а та
![]() в рівнянні Фрейндлиха можуть бути
визначені графічним способом. З цією
метою логарифмують рівняння (1):
в рівнянні Фрейндлиха можуть бути
визначені графічним способом. З цією
метою логарифмують рівняння (1):
![]() (2)
Д
(2)
Д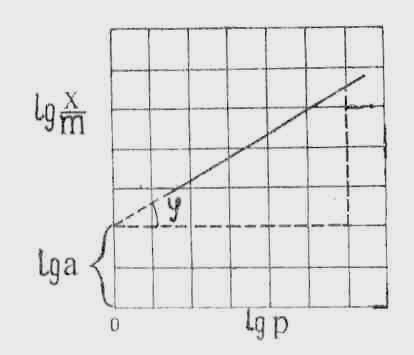 алі
в логарифмічних координатах строять
графік ізотерми адсорбції: по осі абсцис
відкладають логарифми рівноважних
тисків lg
p,
а по осі ординат – логарифми адсорбції
алі
в логарифмічних координатах строять
графік ізотерми адсорбції: по осі абсцис
відкладають логарифми рівноважних
тисків lg
p,
а по осі ординат – логарифми адсорбції
![]() .
Крива на графіку буде представляти
собою пряму лінію. Якщо цю лінію продовжити
до перехрестя її з осію ординат, то вона
на ній відділить відрізок, який буде
дорівнювати lg
a.
Це слідує з рівняння (2). Якщо lg
p
= 0, то
.
Крива на графіку буде представляти
собою пряму лінію. Якщо цю лінію продовжити
до перехрестя її з осію ординат, то вона
на ній відділить відрізок, який буде
дорівнювати lg
a.
Це слідує з рівняння (2). Якщо lg
p
= 0, то
![]() .
Тангенс кута нахилу цієї прямої до осі
абсцис є значення
.
Тангенс кута нахилу цієї прямої до осі
абсцис є значення
![]() .
.
Але рівняння Фрейндлиха не можливо застосовувати в області малих та великих тисків адсорбіруємої речовини. Порівняльно задовільну кількісну характеристику адсорбції як при низьких, так і при високих тисках адсорбуємої речовини дає рівняння ізотерми адсорбції Лєнгмюра, яке було виведено на основі молекулярно – кінетичної теорії:
![]() (3)
де Г – кількість адсорбуємої речовини
(моль) одиницею поверхні поглинувача,
Г∞ - кількість адсорбуємої речовини в
молях при повному насичені одиниці
поверхні, р – тиск, b
– константа адсорбуємої рівноваги.
(3)
де Г – кількість адсорбуємої речовини
(моль) одиницею поверхні поглинувача,
Г∞ - кількість адсорбуємої речовини в
молях при повному насичені одиниці
поверхні, р – тиск, b
– константа адсорбуємої рівноваги.
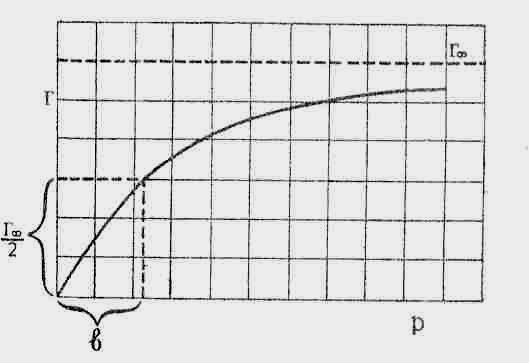
Для визначення фізичного смислу константи у рівнянні Лєнгмюра необхідно прийняти деяке часткове значення для Г, наприклад Г= Г∞/2. тоді, підставляючи це в рівняння (3), отримаємо:
![]() ;
2p
= p+b;
b=p
;
2p
= p+b;
b=p
Звідси маємо, що константа чисельно дорівнює тому тиску адсорбтива, при якому адсорбція дорівнює половині граничної. Таким чином, усі величини, які входять до рівняння Лєнгмюра, мають певний фізичний смисл та теоретично обґрунтовані.
Для визначення Г∞ та b графічним методом необхідно рівняння Лєнгмюра привести до лінійного вигляду. З цією метою одиницю ділять на обидві частини рівняння:
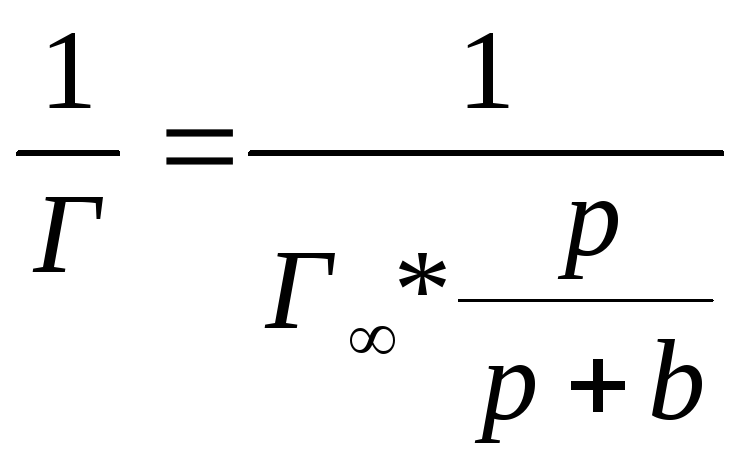 ;
;
![]() (4)
(4)
Якщо
на осі абсцис відкласти величину
![]() ,
а на осі ординат
,
а на осі ординат
![]() ,
то на графіку отримаємо пряму лінію. З
рівняння (4) слідує, що якщо
,
то на графіку отримаємо пряму лінію. З
рівняння (4) слідує, що якщо
![]() =0,
то
=0,
то
![]() =
=![]() .
Звідси, якщо пряму лінію графіку
продовжити до перехрестя з осію ординат,
то відрізок ОА на осі ординат буде
дорівнювати
.
Звідси, якщо пряму лінію графіку
продовжити до перехрестя з осію ординат,
то відрізок ОА на осі ординат буде
дорівнювати
![]() .
.
Тангенс кута нахилу цієї прямої до осі абсцис є значення
![]() .
Визначивши графічним методом константу
Г∞, константу b
тепер можна також розрахувати з рівняння
(3).
.
Визначивши графічним методом константу
Г∞, константу b
тепер можна також розрахувати з рівняння
(3).
Якщо речовина адсорбується твердим тілом з розчину, то в рівняннях Фрейндлиха та Лєнгмюра тиск р замінюють величиною рівноважної молярної концентрації С:
![]() (5)
(5)
![]() (6)
(6)
Якщо ж адсорбція якоїсь речовини проходить на поверхні розчину, то це призводить до змін поверхневого натягнення. Кількісне співвідношення між величиною адсорбції та змінами поверхневого натягнення з концентрацією розчину визначається рівнянням Гібса (1878р.):
![]() (7)
де Г – адсорбція – надлишок розчиненої
речовини, моль/м2,
с – молярна концентрація розчину,
моль/л, R
– газова постійна, Дж/(моль*К), Т –
температура, К, σ – поверхневе натягнення,
Н/м.
(7)
де Г – адсорбція – надлишок розчиненої
речовини, моль/м2,
с – молярна концентрація розчину,
моль/л, R
– газова постійна, Дж/(моль*К), Т –
температура, К, σ – поверхневе натягнення,
Н/м.
Для
приблизних розрахунків
![]() можна замінити на
можна замінити на
![]() ,
тоді
,
тоді
![]() (8)
(8)
З рівняння маємо, що якщо з збільшенням концентрації розчиненої речовини поверхневе натягнення зменшується, то адсорбція позитивна. Якщо ж розчинена речовина поверхневе натягнення збільшує, то адсорбція негативна.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Мета роботи – ознайомлення студентів з сорбційними процесами, та характеристикою поверхневих явищ.
Прилади та реактиви: штатив з набором пробірок, скляні стакани. Розчини: фуксин, спиртовий розчин фуксину, сульфат міді, дихромат калію, перманганат калію, крохмаль, йод. Активоване вугілля. Скляні палички. Центрифуга.
Дослід 1. Адсорбція фарбників.
В дві сухі конічні пробірки внесіть по 30-35мг активованого вугілля. В першу пробірку внесіть 5-7 крапель розчину головного фарбника – фуксину. До другої пробірки – 5-7 крапель спиртового розчину фуксину.
Суміші у пробірках перемішайте скляною паличкою та відцентрифугуйте. Що спостерігаємо?
Дослід 2. Адсорбція зафарбованих іонів вугіллям.
В окремі конічні пробірки внесіть по 10-15 крапель розведених 0,02М розчинів сульфату міді, дихромату калію та перманганату калію. Додайте до кожної пробірки по 30-35мг активованого вугілля, багато раз перемішайте та відцентрифугуйте. Що спостерігаємо?
Дослід 3. Вплив температури на адсорбцію.
Внесіть у пробірку 1мл розчину крохмалю, додайте 1 краплю розчину йоду. Суміш перемішайте, проводити нагрівання до повного знебарвлення розчину. Чому розчин знебарвився? Дайте розчину охолодитися. Спостерігайте появу синього кольору. Як впливає збільшення температури на адсорбцію?
