
- •Таврійський державний агротехнологічний університет
- •Змістовий модуль I. Неорганічна хімія
- •Тема 5. Гідроген. Хімія лужних металів. Хімія лужно - земельних елементів.
- •Змістовий модуль іі. Фізична та колоїдна хімія
- •Тема 14. Дисперсні системи та їх класифікація.
- •Тема 15. Мікрогетерогенні системи.
- •Тема 16. Напівколоїди та розчини високомолекулярних сполук.
- •Розподіл балів, що присвоюються студентам
- •Техніка безпеки та правила роботи в хімічній лабораторії Вимоги безпеки перед початком роботи
- •Вимоги безпеки під час роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в аварійних ситуаціях
- •Розділ і. Неорганічна хімія Лабораторна робота №1. Класи неорганічних сполук
- •Вимоги до знань та умінь
- •Теоретична частина
- •Оксиди.
- •Кислоти.
- •Основи.
- •Амфоліти.
- •Паспорт роботи
- •Експериментальна частина Техніка безпеки.
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •ТермоХімія. Мета роботи – навчитися експериментально визначати ентальпію хімічних реакцій і робити розрахунки, використовуючи термохімічні рівняння.
- •Фактори, що визначають напрямок хімічних реакцій.
- •Паспорт роботи.
- •Експериментальна частина
- •Хід роботи.
- •Результати. Оформлення роботи.
- •Контрольні питання.
- •Рекомендована література
- •Лабораторна робота №5. Кінетика та швидкість хімічних реакцій
- •Вимоги до знань та умінь
- •Теоретична частина
- •Хімічна рівновага
- •Паспорт роботи
- •Експеріментальна частина
- •Контрольні питання
- •Рекомендована література
- •Лабораторна робота №6. Періодична система та періодичний закон д.І. Менделєєва
- •Вимоги до знань та умінь
- •Теоретична частина
- •Періодична система і будова атома.
- •Контрольні питання
- •Лабораторна робота №7. Властивості гідрогену та його сполук
- •Теоретична частина
- •Проста речовина
- •Практична частина Одержання та властивості Гідрогену. Окисно-відновні властивості Гідрогену.
- •Контрольні питання
- •Лабораторна робота №8. Властивості лужних металів.
- •Теоретична частина
- •Практична частина Властивості лужних металів та їх сполук.
- •Контрольні питання
- •Лабораторна робота №9. Властивості лужноземельних металів.
- •Теоретична частина
- •Практична частина Властивості лужноземельних металів та їх сполук
- •Контрольні питання
- •Елементи іv – а групи
- •Властивості Алюмінію, Карбону, Силіцію, Стануму, Плюмбуму та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 8 Властивості Нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Галогени
- •Практична частина Властивості р-елементів та її сполук.
- •Контрольні питання
- •Лабораторна робота №13. Загальна характеристика d-елементів
- •Теоретична частина
- •Практична частина
- •Контрольні питання
- •Лабораторна робота №14. Тема: комплексні сполуки
- •Експериментальна робота Комплексні сполуки та їх властивості.
- •Контрольні питання
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 16. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 17. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 18. Розчини електролітів
- •Гідроліз солей
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 19. Поверхневі явища та адсорбційні рівноваги
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 20. Дисперсні систем та їх класифікація
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Контрольні питання:
-
Надайте визначення поняттям: сорбція, адсорбція, абсорбція, десорбція. Наведіть приклади.
-
Обґрунтуйте причини та механізм адсорбції.
-
Що таке капілярна конденсація? Покажіть на прикладі.
-
Що таке обмінна адсорбція? Яке її практичне значення?
-
У чому різниця між фізичною адсорбцією та хемосорбцією?
-
Що таке поверхневе натягнення та як воно виникає?
-
Які існують методи вимірювання поверхневого натягнення?
Задачі:
-
Розрахувати величину адсорбції аргону на вугіллі при -78,30С в м3/кг (наведених до нормальних умов), якщо тиск аргону дорівнює 1,01*105Па, а=4,83*10-5 м3/кг,
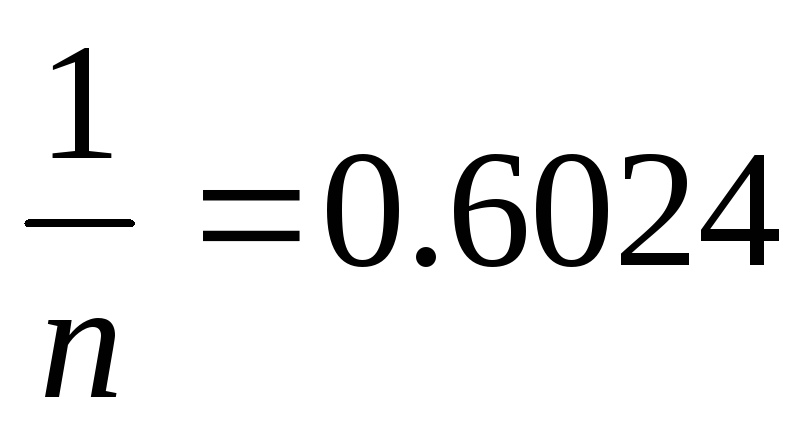 .
.
-
Розрахувати величину адсорбції азоту слюдою при температурі 90К в м3/кг (наведених до температури 200С та тиску 1,013*105 Па), якщо тиск азоту дорівнює 3173Па, Г∞= 0,0385 м3/кг, b=847.
-
Виходячи з слідуючи даних адсорбції азоту на слюді при 90К (наведених до температури 200С та тиску 1,013*105 Па), графічним методом визначити константи а та
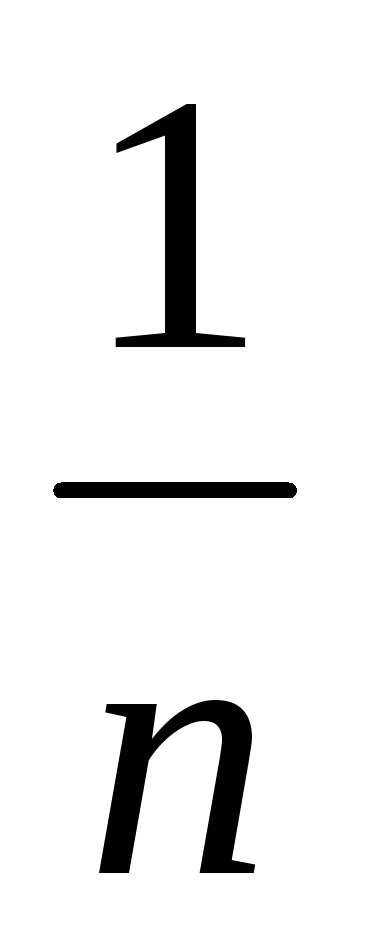 в рівнянні Фрейндліха: р, Па
530 990 1730 2370
4530
в рівнянні Фрейндліха: р, Па
530 990 1730 2370
4530
 ,
м3/кг
0,0149 0,0191 0,0242 0,0273
0,0368
,
м3/кг
0,0149 0,0191 0,0242 0,0273
0,0368
-
На підставі досліджених даних графічним методом розрахувати константи Г∞ та b в рівняннях Лєнгмюра для адсорбції мурашиної кислоти з водного розчину вугіллям: Г, моль/кг 0,124 0,186 0,238 0,267 Рівноважна молярна концентрація, моль/л 0,002 0,005 0,014 0,055
-
Визначити адсорбцію при 150С на поверхні розчину ізовалеріанової кислоти молярною концентрацією 0,25 моль/л, якщо поверхневе натягнення розчину дорівнює 35,0*10-3 Н/м, а поверхневе натягнення води при 150С дорівнює 73,49*10-3 Н/м.
Лабораторна робота № 20. Дисперсні систем та їх класифікація
Мета роботи – ознайомлення студентів з методами добування, властивостями суспензій, емульсій, аерозолів; методами визначення молекулярної маси ВМС; гелями.
ТЕОРЕТИЧНА ЧАСТИНА
Колоїдна хімія – це наука про властивості гетерогенних високодисперсних систем та процеси, які в них проходять.
Усяка колоїдна система є дисперсією одного тіла (дисперсна фаза) в іншій (дисперсійна середа).
Мікрогетерогенні системи з твердою дисперсною фазою та рідинною дисперсною середою у колоїдній хімії називають суспензіями, або взвісями, а предільно- високодисперсні – колоїдними розчинами, або золями, частіше ліозолями, щоб підкреслити, що дисперсною середою є рідина. Якщо дисперсною середою є вода, то такі золі мають назву гідрозолі, а якщо органічна рідина – органозолі.
Дисперсні системи з газоподібною дисперсною середою називають аерозолями.
Тумани є аерозолі з рідинною дисперсною фазою (Г-Р), а пил та дим – це аерозолі з твердою дисперсною фазою (Г-Т), пил утворюється при диспергіруванні речовин, а дим – при конденсації летких речовин.
Піни – це дисперсія газів у рідинах (Р-Г), при цьому у пінах рідина вироджується до тонких плівок, які поділяють окремі бульбашки газів. Емульсіями називають дисперсні системи, в яких одна рідина розчинена в іншій, нерозчинній її рідині (Р-Р).
Дисперсні системи можуть бути вільнодисперсними та зв’язнодисперсними в залежності від відсутності чи наявності взаємодії між частинками дисперсної фази. До вільнодисперсних систем відносяться аерозолі, ліозолі, розчинені суспензії та емульсії. Вони текучі. У цих системах частинки дисперсної фази не мають контактів, беруть участь у хаотичному тепловому руху, вільно переходять під дією сили ваги. Зв’язнодисперсні системи – твердообразні, вони утворюються при контакті частинок дисперсної фази, який призводить до утворення структури у вигляді каркасу або сітки. Така структура відокремлює текучість дисперсної системи та надає їй здатність зберігати форму. Подібні структурірованні колоїдні системи називають гелями. Перехід золів до гелів, який проходить у результаті зниження стійкості золів, називають гелеутворенням (або желетаніруванням).
До високомолекулярних сполук (ВМС) відносяться речовини, які складаються з великих молекул (макромолекул) з молекулярними масами не менше 10000-15000. Розмір макромолекул більший за розмір звичайних молекул. Наприклад, якщо довжина молекули етану дорівнює усього декілька ангстремам, тоді довжина лінійної молекули каучуку та целюлози дорівнює 4000-8000А. Моделлю подібних молекул могуть служити нитки довжиною від 800 до 1600мм та діаметром 1мм.
ВМС внаслідок їх великої молекулярної ваги нелетучі та не здатні переганятися. По тій же причині високомолекулярні сполуки чутки до впливу різноманітних зовнішніх факторів. Макромолекули легко розпадаються під дією самих незначних кількостях кисню та інших деструктируючих агентів. Властивості ВМС залежать не тільки від розміру, але й від форми молекули.
