
-
Химические свойства
Химические свойства стирола обусловлены высокой реакционной способностью боковой винильной группы. Фенильное ядро затрагивается в процессе термической полимеризации на стадии инициирования. При окислении стирола на воздухе происходит образование полимера, формальдегида и бензальдегида.
Полистирол относится к группе весьма инертных пластмасс. Он стоек к действию щелочей и галогеноводородных кислот. Нестоек к действию концентрированной азотной кислоты и ледяной уксусной кислоты.
Термическая деструкция полистирола с заметной скоростью протекает при температурах выше 200 °С. Основным продуктом разложения является мономерный стирол. Полистирол горюч. Для того чтобы понизить опасность возгорания, в него добавляют фосфорсодержащие соединения. Широкое использование полистирола в быту, строительстве, пищевой индустрии диктует необходимость максимального снижения содержания в нем остаточного мономера. По действующим нормам пищевой полистирол должен содержать менее 0,3% мономера.
|
Тип реакции |
Уравнение химической реакции |
|
1) Присоединение а) с галогеноводородами
|
C6H5CH=CH2 + НCl → C6H5СCl -СН3 |
|
б) обесцвечивает бромную воду |
Галогенирование, например, в реакции с бромом, в отличие от анилина идет не по бензольному кольцу, а по виниловой группе с образованием 1,2-дибромэтил- бензола. C6H5CH=CH2 + Br2 → C6H5CHBr-CH2Br
|
|
2) Полимеризация с образованием твердой стекловидной массы —полистирола
|
n C6H5CH=CH2 → (-CН2-СН(С6Н5)-)n |
|
3) Легко окисляется, обесцвечивает раствор KMnO4
|
|
1.3. Физико – химические свойства
|
Физико-химические свойства и константы стирола |
Значение и размерность |
|
Молекулярный вес |
104,15 |
|
Плотность при 20 оС |
906,0 кг/м3 |
|
Теплоемкость при 20 оС |
43,64 кал/моль*оС |
|
Теплота испарения при 145,2 оС |
8,9 ккал/моль |
|
Теплота плавления |
25,9 ккал/кг |
|
Удельная теплоемкость при 20 °C, кДж/(кг×К) |
1,735 |
|
Поверхностное натяжение, Н/м |
0,0322 (20 °C) |
|
Диэлектрическая проницаемость |
2,431 |
|
Термический коэффициент объемного расширения при 25 °C, 1/°C |
9,719×10-4 |
-
Сырье
Получение стирола в большинстве случаев, а именно 90 %, осуществляется дегидрированием этилбензола. Этилбензол может быть получен:
1) алкилированием бензола этиленом;
2) извлечением из фракций «сырого бензола», полученной разделением прямого коксового газа, или из ксилольной фракции риформинга нефтепродуктов.
Основная масса этилбензола, используемого для производства стирола, получается алкилированием бензола этиленом (реакция Фриделя—Крафтса).
Алкилирование бензола представляет гетерогенно-каталитическую экзотермическую реакцию, описываемую суммарным уравнением:
![]()
Реакция катализируется хлоридом алюминия и представляет собой электрофильное замещение в ароматическом ядре, протекающее через стадию образования промежуточного комплекса:
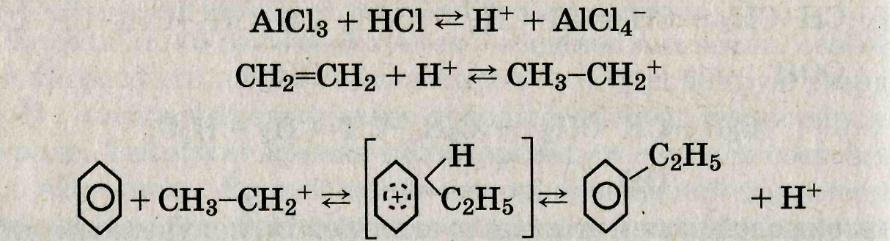
Так как хлорид алюминия в твердом виде нерастворим в углеводородах и слабо катализирует реакцию алкилирования, на практике применяется предварительно приготовленный жидкий катализаторный комплекс хлорида алюминия с диэтилбензолом (ДЭБ) и хлоридом водорода (комплекс Густавсона).
Комплекс Густавсона — это соль карбкатиона ДЭБ (ст-комплекс), окруженная сольватной оболочкой из нескольких (1—6) молекул ДЭБ, и получается пропусканием хлорида водорода при нагревании через суспензию хлорида алюминия в диэтилбензоле.
1)![]()
Весьма эффективны также катализаторы на основе ионообменных сорбентов, например, кислотный катионит КУ-2 с активными сульфогруппами, получаемый сополимеризацией стирола с дивинилом с последующим сульфированием сополимера и омылением сульфопродукта щелочью или водой.
Алкилирование в присутствии хлорида алюминия по реакции (а) сопровождается необратимыми побочными реакциями последовательного введения этильных групп в ядро с образованием смеси продуктов различной степени алкилирования, важнейшей из которых является образование диэтилбензола:
2)![]()
А также реакции деструкции, окисления и смолообразования. Одновременно с реакциями алкилирования протекают обратимые реакции переалкилирования полиэтилбензолов, например:
![]()
Для подавления реакции 1 и смещения вправо равновесия реакции 2 алкилирование проводят в избытке бензола, а часть

Рисунок 2. Принципиальная схема производства этилбензола:
ЭБ-этилбензол, ДЭБ-диэтилбензол образующегося ДЭБ возвращают в цикл. На рис. 2. представлена принципиальная схема производства этилбензола алкилированием бензола этиленом. Технологическая схема и параметры процесса алкилирования бензола рассматриваются ниже на примере производства изопропилбензола. Процесс алкилирования может проводиться в жидкой или в паровой фазе, при температуре от 95°С до 450°С и мольном отношении бензол/этилен от 21:1 до 6:1. Полученный алкилат содержит 12—35% массовых этилбензола, 55—85% массовых бензола и 2,5—8% массовых диэтилбензола. Современные установки по производству этилбензола достигают мощности 740 тыс. т продукта в год. Выход этилбензола в расчете на бензол составляет 95%, при расходных коэффициентах на 1 т продукта: бензол 0,77 т, этилен 0,3 т, хлорид алюминия 0,03 т.
Физико-химические свойства этилбензола:
Бесцветная жидкость; tкип=136,2°С, tпл = 94,97°С; плотность 0,867 г/см3 (20°С); почти нерастворим в воде, растворяется в спирте, бензоле, эфире, четыреххлористом углероде.

