
Диаграммы плавкости и кипения. Вариант 8
.docxВариант 8
Диаграмма плавкости
А ≡ CsCl
B ≡ SrCl2
|
T1, К |
а |
б |
в |
г |
д |
T2, К |
|
1173 |
35 |
90 |
10 |
50 |
75 |
1093 |
-
На графике.
-
Состав химических соединений:
А ≡ CsCl
B ≡ SrCl2
С ≡ CsCl∙ SrCl2
-
Точки эвтектики = точки V на графике.
E1: Качественный состав: твердые В и С, их расплав.
Количественный состав: CsCl – 20%, SrCl2 – 80%
E2: Качественный состав: твердые А и С, их расплав.
Количественный состав: CsCl – 85%, SrCl2 – 15%
-
На графике.
-
На графике.
-
-
При 10% CsCl плав начнет отвердевать при Т = 1173 К плав находится в жидком состоянии. При понижении температуры до Т = 1093 К начинается процесс кристаллизации. В твердую фазу переходит то вещество, которого в системе больше, т.е. SrCl2.
-
При 50% CsCl плав находится в процессе кристаллизации при Т = 1173 К. При понижении температуры до Т = 1093 К плав продолжит кристаллизоваться. В состав входит вещество С и его кристаллы.
-
При 75% CsCl плав находится в жидком состоянии при Т = 1173 К. При понижении температуры до Т = 1093 К ничего не меняется.
Число фаз и степеней свободы при:
а) Т = 1054 К (Е1) и 5% CsCl:
Число фаз φ = 3 (твердое B + твердое С + расплав L)
Число компонентов k = 2 (вещества С и В)
Число внешних факторов n = 1 (т.к. р = const)
Число термодинамических степеней свободы V=k+n-φ=2+1-3=0
б) Т = 1054 К (Е1) и 95% CsCl:
Число фаз φ = 1 (расплав L)
Число компонентов k = 2 (вещества А и В)
Число внешних факторов n = 1 (т.к. р = const)
Число термодинамических степеней свободы V=k+n-φ=2+1-1=2
c) Т = 855 К (Е1) и 5% CsCl:
Число фаз φ = 2 (твердое B + твердое С)
Число компонентов k = 2 (вещества С и В)
Число внешних факторов n = 1 (т.к. р = const)
Число термодинамических степеней свободы V=k+n-φ=2+1-2=1
d) Т = 855 К (Е1) и 95% CsCl:
Число фаз φ = 2 (твердое А + расплав L)
Число компонентов k = 2 (вещества А и В)
Число внешних факторов n = 1 (т.к. р = const)
Число термодинамических степеней свободы V=k+n-φ=2+1-2=1
-
При 35% CsCl плав начнет отвердевать при Т = 1152 К. При Т = 1054 К плав отвердеет полностью. В процессе кристаллизации в твердую фазу переходит то вещество, которого в системе больше, т.е. SrCl2.
-
При 90% CsCl плав начнет плавиться при Т = 860 К. Полностью он расплавиться при Т = 867,5 К. Расплав первых капель будет содержать SrCl2.
Диаграмма кипения
|
T1 |
а |
б |
в |
|
317 |
25 |
30,4 |
69.6 |
А ≡ CS2
B ≡ CH3COCH3
p = 10,133*10-4 Н/м3
-
На графике.
-
На графике.
-
Система, содержащая 25% CS2 начнет кипеть при Т = 315,25 К, состав первого пузырька пара: 32% CH3COCH3 и 68% CS2. Согласно закону Коновалова, последняя капля жидкости исчезнет в азеотропной системе, т.е. ее температура и состав определяются точкой касания диаграмм для жидкости и пара: Т = 322,2 К, ее состав: 66% CH3OH и 34% CH3COCH3.
-
Состав пара, находящегося в равновесии с жидкой бинарной системой, кипящей при Т1 = 317 К, зависит от состава исходного раствора. Рассмотрим два возможных случая:
-
Состав раствора: 19% CS2 и 81% CH3COCH3, тогда состав равновесного пара 44% CS2 и 56% CH3COCH3
-
Состав раствора: 97% CS2 и 3% CH3COCH3, тогда состав равновесного пара 91% CS2 и 9% CH3COCH3.
-
Для того, чтобы определить состав жидкой фазы бинарной системы, можно провести ректификацию до получения чистого компонента А или В. В зависимости от того, какой компонент выделится, по диаграмме кипения можно определить с какой стороны от азеотропной точки имеет место состав раствора при Т1 = 317 К.
-
Система содержит 30,4 кг CS2 (М=76,14 г/моль) и 69,6 кг CH3COCH3 (60,05 г/моль) . Отсюда:
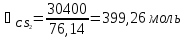

Мольная
доля компонента А:
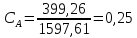
Следовательно, состав раствора лежит левее точки касания диаграмм. Раствор такого состава можно разделить на чистый ацетон (компонент В) и азеотропный раствор данных веществ. Азеотроп состоит из 66% дисульфид углерода и 34% ацетона, т.е. количество вещества В, остающегося в составе азеотропа:
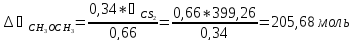
Или:

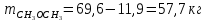
-
Азеотропный раствор содержит 66% дисульфид углерода, следовательно:

В исходном растворе присутствует 473,93 моль CS2, поэтому необходимо добавить:

Или

-
2 кг смеси, содержащей 25% CS2, нагревают до 317 К.
4СА=СВ, следовательно,
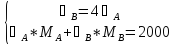
Откуда,
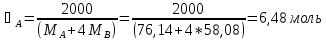
При температуре 317 К смесь, содержащая 25% CH3OH, имеет состав: 0,19 CS2 и 0,81 CH3OCH3 (жидкость) и 0,44 CS2 и 0,56 CH3OCH3 (пар). Отсюда:

Решая данную систему, получаем:
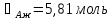

Умножаем все на МА:
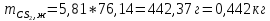
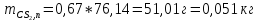
Таким образом, при температуре 317 К в жидкости будет находиться 0,442 кг метанола, а в паре – 0,051 кг.
