
PDF-лекции с картинками / 2 стромально-сосудистые дистрофии
.pdf18
СТРОМАЛЬНО–СОСУДИСТЫЕ ДИСТРОФИИ
Составила доцент М.Е.Матвеенко
Диспротеинозы.
К диспротеинозам относят: мукоидное набухание, фибриноидное набухание (фибриноид), гиалиноз, амилоидоз. Перечисленные диспротеинозы приводят к прогрессирующей деструкции соединительной ткани, которая имеет в своем составе клетки и межклеточное вещество, состоящее, в свою очередь, из волокон (коллагеновых, эластических и ретикулярных) и основного вещества. Основное вещество цементирует волокнистые структуры соединительной ткани и содержит большое количество гликозаминогликанов (ГАГ).
Мукоидное набухание.
Сущность мукоидного набухания состоит в том, что под влиянием патогенных факторов в основном веществе соединительной ткани происходит накопление и перераспределение ГАГ, которые обладают свойством притягивать воду, т.к. они гидрофильны. Это ведет к повышенной тканевой и сосудистой проницаемости. К ГАГ примешиваются белки плазмы крови (глобулины) и гликопротеиды. Развивается набухание основного вещества (хромотропный отек, описанный В.Т.Талалаевым при ревматизме).
Микроскопически: при окраске толуидиновым синим возникает феномен метахромазии, краситель меняет свой цвет и окрашивает основное вещество не в синий цвет, а в сиреневый или красный. Коллагеновые волокна сохранены, но набухшие, разволокнены.
Мукоидное набухание чаще всего встречается в стенках артерий, клапанах сердца, эндокарде, эпикарде. Внешний вид ткани не изменен. Причины: инфекционно-аллергические болезни, ревматизм, атеросклероз и др. Исходом может быть исцеление или переход в фибриноидное набухание.
Фибриноидное набухание (фибриноид).
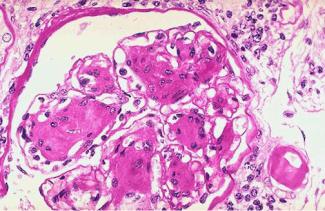
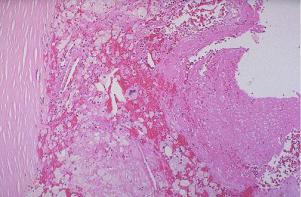
Этот вид белковой дистрофии следует за мукоидным набуханием. Вследствие нарастающей проницаемости стенки сосуда из плазмы выходят не только глобулины, но и другие более крупные белки, в том числе и фибриноген, который превращается в фибрин. Он накапливается в основном веществе и волокнах, разрушая их и превращая в гомогенную массу. Метахромазия соединительной ткани уже не выражена, т.к. произошло разрушение ГАГ основного вещества. Фибриноид – сложное вещество, состоящее из фибрина, полисахаридов, иммунных комплексов (при ревматизме), нуклеопротеидов (при системной красной волчанке). Фибриноидное набухание – необратимый процесс, который ведет к фибриноидному некрозу (Рис.1).

19
Рис.1. Фибриноидное набухание с исходом в фибриноидный некроз в почечной артериоле.
Внешний вид органов мало изменен, но функция нарушена. Причины: инфекционно-аллергические, аллергические, аутоиммунные заболевания (например, фибриноид сосудов при туберкулезе с гиперергическими реакциями). Фибриноидное набухание может быть местное (хроническая язва желудка) и распространенное (при гипертонической болезни фибриноид артериол). Исход: развивается некроз, склероз или гиалиноз.
Гиалиноз.
Гиалиноз или гиалиновая дистрофия также относится к стромальнососудистым (мезенхимальным) и ее не следует путать с гиалиновокапельной паренхиматозной дистрофией. Гиалиноз может быть исходом фибриноидного набухания, либо представлять самостоятельный вид. Гиалин – фибриллярный белок, состоящий из белков плазмы крови, преимущественно фибрина, компонентов иммунных комплексов и липидов. Механизм образования гиалина связан с деструкцией волокнистых структур (декомпозицией) и плазморрагией, связанной с повышением проницаемости стенки сосуда.
Гиалиноз может быть распространенным и местным. Наиболее важное, значение имеют гиалиноз сосудов и соединительной ткани.
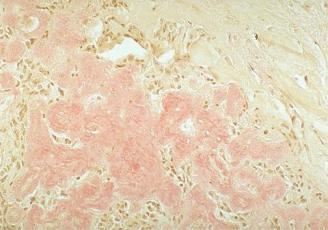
Гиалиноз сосудов поражает мелкие сосуды и артериолы. Начинается с повреждения эндотелия, внутренней эластической мембраны и гладкомышечных клеток. Это приводит к пропитыванию стенки сосуда плазмой крови с последующим образованием гиалина. В результате сосуд превращается в плотную стекловидную трубочку с резко суженым отверстием. Гиалиноз сосудов – системное заболевание, но наиболее выражен в почках, головном мозге, сетчатке глаза, поджелудочной железе, коже. Характерен для гипертонической болезни (гипертонический артериологиалиноз), диабетической микроангиопатии (диабетический артериологиалиноз) (Рис.2).
Местный гиалиноз встречается в селезенке у пожилых людей (глазурная селезенка).
20
Сосудистый гиалин по составу может быть трех видов: простой (инсудация плазмы), липогиалин (содержит липиды), сложный гиалин, в состав которого входят иммунные комплексы, фибрин и другие структуры.
Рис.2. Гиалиновый артериолосклероз. Внизу справа видны утолщенные артериолы, окрашенные ШИК-реактивом.
Гиалиноз собственно соединительной ткани развивается в исходе фибриноидного набухания. Волокнистые структуры и основное вещество соединительной ткани превращаются в однородную гомогенную плотную массу – гиалин (полная деструкция коллагеновых волокон и основного вещества соединительной ткани, к которым присоединяются преципитирующие белки плазмы крови). Подобный механизм встречается при заболеваниях, связанных с иммунными нарушениями, например, при ревматических заболеваниях.
Внешний вид тканей может быть не изменен, но чаще ткани бледные, полупрозрачные. Гиалиноз резко меняет функцию органа. Снижается эластичность артериол, ухудшается снабжение кровью, такие сосуды легко рвутся при повышенном давлении, вызывая кровоизлияния, в том числе смертельные, если разрыв сосуда произошел в головном мозге. Исход: местный гиалиноз в рубце может рассосаться, в клапане сердца – нет. В целом прогноз неблагоприятный.
Амилоидоз.
Амилоидоз – стромально-сосудистый диспротеиноз, сопровождающийся глубокими изменениями белкового обмена и появлением аномального фибриллярного белка – амилоида, который в норме у человека отсутствует. В 1884 году Рокитанский назвал амилоидоз сальной болезнью, т.к. органы, пораженные амилоидозом, имеют сальный вид, но оказалось, что амилоид вещество белковой природы.
Амилоид состоит из 2-х компонентов: F-компонента (фибриллярного) и Р-компонента (плазменного). F-компонент представлен фибриллярными белками, связанными с иммуноглобулином. Р-компонент
– это белки и полисахариды плазмы крови. Амилоид очень прочное вещество, на которое не действуют ферменты. Он выявляется при помощи окраски конго-красным или люголевским раствором с 10% раствором
21
серной кислоты, метахроматическим окрашиванием в красный цвет с метиловым фиолетовым и другими способами (Рис.3).
Рис.3. Окраска Конго-красным выявляет амилоид в соединительной ткани, окрашивая его в красный цвет.
Морфогенез. Различают 4 стадии образования амилоида:
I стадия – появление амилоидобластов (как предполагают из мезенхимальных клеточных элементов – соединительнотканных, плазмоцитов и других клеток);
II стадия – синтез фибриллярного белка;
III стадия – агрегация фибрилл, в это время появляется амилоидоклазия (резорбция инородного белка), но она скоро подавляется – появляется толерантность к амилоиду, и он быстро накапливается;
IV стадия – соединение компонента F с компонентом Р (гликопротеидами плазмы) и хондроинтинсульфатами ткани.
Образование амилоида тесно связано с волокнами соединительной ткани. Вокруг ретикулярных волокон амилоид выпадает в мембранах сосудов и желез, в ретикулярной строме паренхиматозных органов. Такой периретикулярный амилоидоз поражает селезенку, печень, почки, надпочечники, кишечник, интиму сосудов мелкого и среднего калибра (паренхиматозный амилоидоз). Вокруг коллагеновых волокон амилоид выпадает в адвенцитии сосудов среднего и крупного калибра, миокарде, поперечно-полосатых и гладких мышцах, нервах, коже (мезенхимальный амилоидоз). Встречается смешанный вариант выпадения амилоида. Амилоидоз может быть местным и распространенным.
Внешний вид органов при выраженном амилоидозе резко меняется: органы увеличиваются в размерах, становятся плотными и ломкими, а на разрезе имеют сальный вид.
В селезенке амилоид откладывается вначале в белой пульпе в лимфатических фолликулах – саговая селезенка, т.к. ее фолликулы напоминают полупрозрачные зерна саго. Затем амилоид накапливается и в красной пульпе – сальная селезенка (резко увеличена, плотная, коричневокрасная, на разрезе – сальный блеск). Это два последовательных процесса.
22
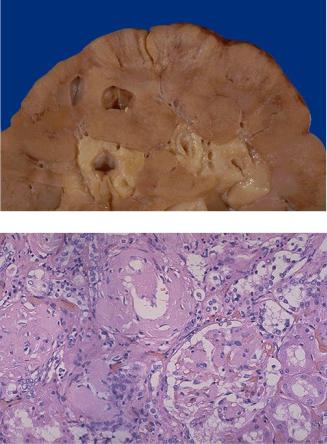
Амилоидоз почек имеет большое значение в клинике, т.к. часто приводит к хронической почечной недостаточности. В почках – амилоид откладывается в мелких сосудах, в мезангии клубочков, в базальной мембране канальцев и строме (Рис.4, 5).
Рис.4. Амилоидоз почек. Большая сальная почка. Амилоидоз наиболее выражен вверху в центре.
Рис.5.Амилоидоз почек. Аморфный розовый амилоид виден вокруг артерии, в интерстиции и гломеруле. (Окраска конго-красным).
Начавшись в пирамидах амилоидоз постепенно захватывает корковое вещество, гломерулы. Вначале почка увеличивается в размерах и выглядит сальной («большая сальная почка»). Возникает нефротический синдром – нефротическая стадия амилоидоза почки. Во многих капиллярных петлях клубочков, а также в стенках артериол и в базальной мембране канальцев, видны отложения амилоида. Канальцы расширены и заполнены цилиндрами.
Впечени амилоид откладывается между звездчатыми ретикулоэндотелиоцитами синусоидов, в ретикулярной строме долек, в стенках сосудов и в соединительной ткани портальных трактов. Печень увеличена, плотная, выглядит “сальной”.
Вкишечнике амилоид поражает ретикулярную строму слизистой оболочки и сосуды. Стенка кишки атрофируется.
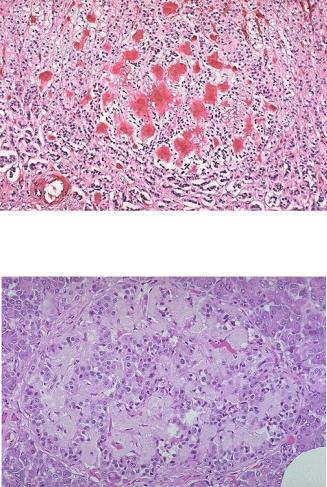
Амилоидоз надпочечников, как правило, двусторонний. Отложения накапливаются в корковом веществе, поражают сосуды. Выраженный амилоидоз ведет к недостаточности надпочечников (аддисонова болезнь) (Рис.6).
23
Рис.6. Амилоид может накапливаться в надпочечниках, также как и в других органах. Здесь видны отложения амилоида, окрашенные конго - красным в красный цвет.
В сердце амилоид обнаруживается под эндокардом, в строме и сосудах миокарда, а также в эпикарде по ходу вен (кардиопатический
вариант амилоидоза). Сердце становится плотным, имеет сальный вид. Амилоидоз поражает также скелетные мышцы, легкие, головной мозг, поджелудочную и щитовидную
железы (Рис.7).
Рис.7. В островках Лангерганса видны розовые гиалинизированные участки с красными включениями амилоида. Эти изменения характерны для больных с сахарным диабетом II типа.
Амилоидоз стромы часто встречается в опухолях эндокринных органов или APUD-системы (апудомах), медуллярном раке щитовидной железы, инсуломе, карциноме, феохромоцитоме, опухолях каротидных телец, хромофобной аденоме гипофиза, гипернефроидном раке. Показано, что эпителиальные опухолевые клетки образуют APUD-амилоид.
Классификация амилоидоза.
1.Приобретенный идиопатический (первичный) амилоидоз. Причина и механизм не известны. Может проявляться в виде генерализованного, нефропатического, гепатопатического, нейропатического, кардиопатического типов.
2.Наследственный (генетический, семейный) амилоидоз.
3.Приобретенный (вторичный) амилоидоз. Встречается наиболее часто и развивается на фоне какого-либо заболевания (хронические инфекции, болезни, связанные с деструктивными процессами). Среди них: туберкулез; хронические неспецифические заболевания легких; остеомиелит, в том числе туберкулезный; длительно незаживающие гнойные раны; злокачественные заболевания; ревматические болезни (в первую очередь, ревматоидный артрит); заболевания крови (миеломная болезнь, лимфогранулематоз и др.).
4.Приобретенный старческий амилоидоз. Поражает сердце, артерии головного мозга.
24
Патогенез амилоидоза.
Внастоящее время выделено несколько различных видов
специфического фибриллярного белка амилоида (AA-, AL-, FAP-, ASC1- формы). На основании биохимических и гистохимических исследований выделили четыре группы генерализованного амилоидоза. К ААамилоидозу относят вторичный амилоидоз, наследственный (периодическая болезнь) и синдром Мак-Уэльса. АL-амилоидоз включает неопластическую плазмоклеточную дискразию и первичный амилоидоз. FАР-амилоидоз представлен семейной амилоидной полинейропатией. К АSС1-амилоидозу относится старческий семейный амилоидоз.
Вкрови найдены белки, являющиеся предшественниками
фибриллярных белков амилоида (АА, АL, FАР, АSС1). Предшественником АА-белка является сывороточный амилоидный белок (SАА), который относится к белкам острой фазы. В нормальных условиях содержание SАА в сыворотке крови очень мало. Количество этого белка увеличивается
всотни раз при воспалении или повреждении ткани. Синтезируется SААбелок преимущественно гепатоцитами. Количество SАА в сыворотке крови регулируется активностью макрофагальной системы, с другой стороны SАА усиливает активность Т-киллеров и стимулирует синтез антител. При стихании острого процесса часть SАА деградирует в гепатоцитах. Другая часть этого белка фильтруется в почечных клубочках, причем часть SАА может реабсорбироваться. Иногда его обнаруживают в подоцитах и мезангии, т.е. в клетках обладающих фагоцитарными свойствами. Особенность фильтрации и реабсорбции белка SАА почками позволяет понять нефропатический тип АА-амилоидоза, в том числе вторичного.
Предшественником АL-белка фибрилл амилоида являются легкие цепи иммуноглобулинов и их фрагментов. Белок амилоидных фибрилл образуется двумя путями. В одном случае нарушение деградации моноклональных легких цепей ведет к появлению пептидов, которые путем агрегации и полимеризации превращаются в амилоидные фибриллы. Эти фибриллы относительно резистентны к протеиназам и накапливаются в соединительной ткани. Во втором случае в легких цепях возникают замены аминокислот и появляются неполноценные легкие цепи способные к образованию аномального белка.
При FAP-амилоидозе предшественником амилоидного фибриллярного белка является преальбумин плазмы, в котором встречаются различные аминокислотные замены. В отличие от других форм амилоидоза содержание преальбумина в сыворотке крови больных FАР-амилоидозом снижено в несколько раз, в то время как отмечается высокое содержание преальбумина в спиномозговой жидкости. Этот феномен связывают с усиленным синтезом альбумина хориоидальным эпителием, что вызывает симптомы полинейропатии. Снижение уровня
25
преальбумина в сыворотке крови происходит из-за усиленного расходования предшественника на построение амилоидного белка.
При старческом амилоидозе предшественником белка фибрилл АSС1 является сывороточный преальбумин. В старческом возрасте в связи с нарушениями в синтезе преальбумина, повышается способность последнего к образованию АSС1. При этом наблюдается снижение уровня сывороточного преальбумина в крови.
Патогенез АА-амилоидоза. Активированные макрофаги через интерлейкин 1 приводят к усиленному синтезу гепатоцитами сывороточного амилоидного белка, уровень которого резко увеличивается в крови. В ответ на это макрофаги начинают усиленное разрушение SАА, но быстро возникает ферментативная недостаточность, которая приводит к неполной деградации, в результате чего появляется фибриллярный белок АА или его фрагменты. В дальнейшем на поверхности макрофагов – амилоидобластов происходит агрегация фибрилл амилоида из белка АА или его фрагментов.
Патогенез АL-амилоидоза включает синтез легких амилоидогенных цепей иммуноглобулинов (с нарушенной деградацией или аминокислотными заменами) и последующий синтез из этих цепей амилоидобластами (плазматическими, миеломными клетками и макрофагами) амилоидных фибрилл.
Стромально-сосудистые жировые дистрофии (липидозы).
Возникают при нарушении обмена нейтральных жиров и холестерина. Нейтральные жиры лабильны. Они обеспечивают энергетические запасы организма. Жировая ткань сосредоточена в жировом депо (подкожная клетчатка, брыжейка, сальник, эпикард, костный мозг). Стромально-сосудистые (мезенхимальные) жировые дистрофии проявляются либо избыточным накоплением нейтрального жира в жировом депо, либо в патологическом уменьшении его количества, либо в появлении его в тканях, где в норме его нет.
Наибольшее значение имеет общее ожирение, при котором увеличивается масса нейтрального жира в организме. Причиной могут быть заболевания ЦНС, гипоталамуса, гипофиза и других эндокринных органов. Избыточное питание является причиной алиментарного ожирения.
Важное значение в патологии имеет ожирение сердца, при котором жир откладывается под эпикардом и между пучками мышечных клеток. Особенно это выражено в правой половине сердца. Сдавленные жиром мышечные клетки атрофируются и возможен разрыв стенки сердца.
Нарушение обмена холестерина заключается в очаговом накоплении его в интиме крупных сосудов из-за повышенной
26
проницаемости интимы, что лежит в основе атеросклероза (Рис.8).
Рис.8. Атеросклеротическая бляшка в коронарной артерии с наличием скоплений холестерина и других веществ.
Стромально-сосудистые углеводные дистрофии.
Связаны с нарушением обмена гликопротеидов и ГАГ и проявляются развитием на месте соединительной ткани, хрящей, жировой ткани слизеподобной массы. Гликопротеиды и ГАГ теряют белки и накапливаются в межуточном веществе. Типичным примером является слизистый отек – микседема при недостаточности щитовидной железы. Дистрофия может быть обратимой, но прогрессирование ведет к некрозу.
