
2
.docxМИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра микро- и наноэлектроники
отчет
по лабораторной работе №2
по дисциплине «ФХОТ изделий электроники и наноэлектроники»
Тема: Моделирование диаграмм состояния с ограниченной растворимостью компонентов(полупроводник-примесь)
Студенты гр. 4209
__________________ Хабибулин А.Р.
|
|
|
Перякин И.В. |
|
Преподаватель |
|
Максимов А.И. |
Санкт-Петербург
2016
Цель работы.
Изучение фазовых равновесий в бинарной системе полупроводник
(Si, Ge)-примесь методом компьютерного моделирования; расчет параметров межатомного взаимодействия; выбор моделей растворов, адекватно описывающих экспериментальные Т-х-диаграммы состояния; расчет спинодалей и определение областей устойчивого и метастабильного состояний твердых растворов в заданной системе.
Экспериментальные результаты и исходные данные:
Таблица 1. Координаты точек линий ликвидуса для системы Si-Al для построения Т-х проекции фазовой диаграммы состояния
|
T, К |
XlB, мол. доли |
|
1598 |
0,15 |
|
1473 |
0,35 |
|
1348 |
0,5 |
|
1223 |
0,62 |
|
1098 |
0,72 |
|
973 |
0,8 |
Температуры плавления:
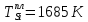
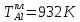
Энтальпии плавления:
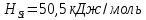
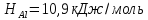
Точка эвтектики:
Tэвт = 850 К
Xbэвт = 0,88
Период решетки:
a = 0,5428 нм
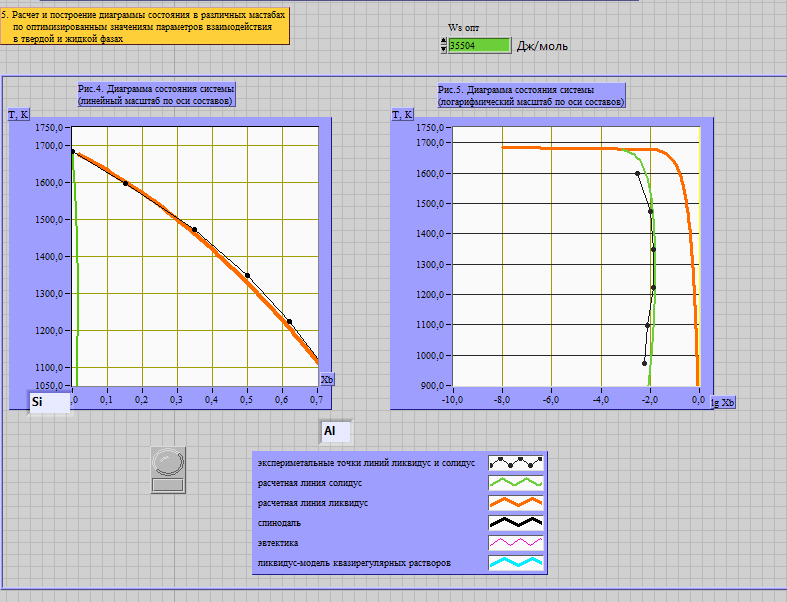
Рис. 1. Полученные диаграммы состояния и подобранные значения оптимальных параметров взаимодействия в твёрдом и жидком растворах.системы Si-Al
Wlопт = -12126 Дж/моль
Wsопт = 35504 Дж/моль
Обработка результатов эксперимента:
-
Приведены T-x-проекции (в обычном и полулогарифмическом масштабах) исследованной диаграммы состояния на рисунках 1, 2 соответственно. Указаны подобранные оптимальные параметры межатомного взаимодействия в твёрдом и жидком растворах.

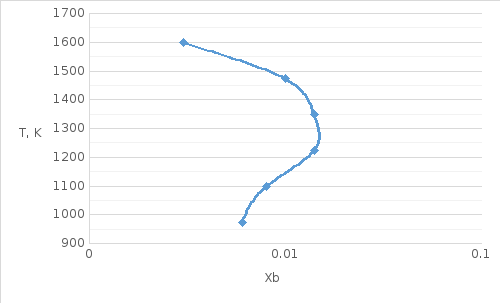 Рис.
2. Линия солидуса для системы Si-Al
в обычном масштабе
Рис.
2. Линия солидуса для системы Si-Al
в обычном масштабе
Wlопт = -12126 Дж/моль
Wsопт = 35504 Дж/моль
Рис. 3. Линия солидуса для системы Si-Al в логарифмическом масштабе
-
Сравнение линии ликвидуса, построенные в рамках моделей идеальных, регулярных и квазирегулярных растворов, с экспериментальной, приведенной на T-x-проекции.
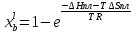
|
T, К |
1697 |
1603 |
1468 |
1338 |
1210 |
1095 |
985 |
850 |
|
Xbl, мол. |
0 |
0,168 |
0,413 |
0,608 |
0,757 |
0,857 |
0,923 |
0,971 |

Рис. 4. Диаграмма состояния для линий ликвидуса, полученных через различные модели.
Исходя из графика, видно, что для наиболее точного описания экспериментально полученной линии ликвидуса, подходят две модели растворов: регулярный и квазирегулярный. Идеальный отличается от экспериментальной линии ликвидуса, т.к. не учитывает межатомных взаимодействий в растворе.
-
Рассчитаем и построим концентрационные зависимости коэффициентов активностей компонентов в твердом растворе при Т=( Тпл(А) + Тэвт)/2 в пределах области растворимости, а также жидком растворе во всем диапозоне составов от х=0 до 1 при Т=Тпл(А). На тех же рисунках построены зависимости, соответствующие модели идеального раствора.
-
Коэффициенты активности компонентов в твердом растворе при
Т=(Тпл(А)+Тэвт)/2 в пределах области растворимости представлены в таблице1. Т=( Тпл(А) + Тэвт)/2=1267,5 K
Lnγi=W(1-xi)2/(RT), где Wsopt= 35504 Дж/моль
 На
рисунках 5 и 6 представлены концентрационные
зависмости коэффициентов активностей
компонентов в твердом растворе в
пределах области растворимости.
На
рисунках 5 и 6 представлены концентрационные
зависмости коэффициентов активностей
компонентов в твердом растворе в
пределах области растворимости.
Рис. 5. Концентрационные зависимости коэффициентов активностей компонентов в твердом растворе в пределах области растворимости.
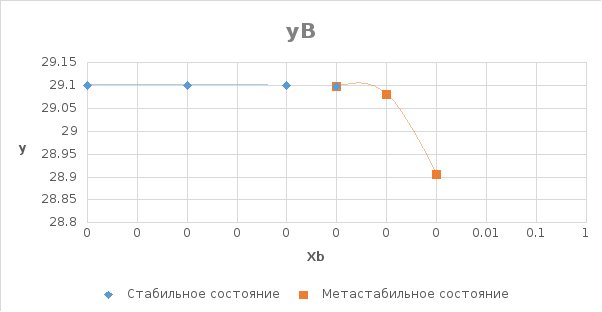 Рис.
6. Концентрационные зависимости
коэффициентов активностей компонентов
в твердом растворе в пределах области
растворимости.
Рис.
6. Концентрационные зависимости
коэффициентов активностей компонентов
в твердом растворе в пределах области
растворимости.
 На
рисунках 7, 8 представлены концентрационные
зависимости активностей компонентов
В и А в твердом растворе в пределах
области растворимости соответственно.
На
рисунках 7, 8 представлены концентрационные
зависимости активностей компонентов
В и А в твердом растворе в пределах
области растворимости соответственно.
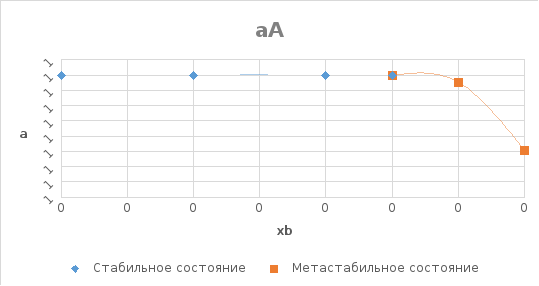
Рис. 7. Концентрационная зависимость активности компонента Si в твердом растворе в пределах области растворимости.
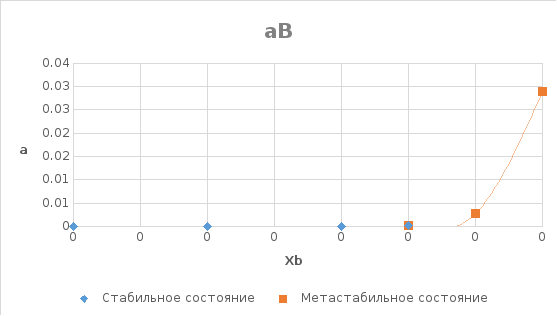 Рис.
8. Концентрационная зависимость активности
компонента Al
в твердом растворе в пределах области
растворимости.
Рис.
8. Концентрационная зависимость активности
компонента Al
в твердом растворе в пределах области
растворимости.
-
. Коэффициенты активностей компонентов в жидком растворе во всем диапозоне составов от х=0 до 1 при Т=Тпл(А)=1685 К
Lnγi=W(1-xi)2/(RT), где Wlopt=-12126 Дж/моль
Таблица 2
|
x |
yB |
aB |
|
0 |
0,347359 |
0 |
|
0,1 |
0,42465 |
0,042464984 |
|
0,2 |
0,508275 |
0,101654952 |
|
0,3 |
0,595637 |
0,178691112 |
|
0,4 |
0,683409 |
0,273363434 |
|
0,5 |
0,767706 |
0,383852831 |
|
0,6 |
0,844354 |
0,506612482 |
|
0,7 |
0,909222 |
0,636455652 |
|
0,8 |
0,958586 |
0,766868936 |
|
0,9 |
0,989482 |
0,890533578 |
|
1 |
1 |
1 |
Таблица 3
|
x |
yA |
aA |
|
0 |
1 |
1 |
|
0,1 |
0,989482 |
0,890534 |
|
0,2 |
0,958586 |
0,766869 |
|
0,3 |
0,909222 |
0,636456 |
|
0,4 |
0,844354 |
0,506612 |
|
0,5 |
0,767706 |
0,383853 |
|
0,6 |
0,683409 |
0,273363 |
|
0,7 |
0,595637 |
0,178691 |
|
0,8 |
0,508275 |
0,101655 |
|
0,9 |
0,42465 |
0,042465 |
|
1 |
0,347359 |
0 |
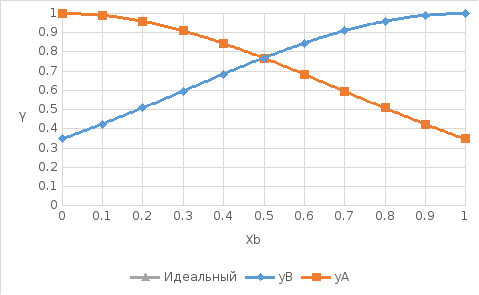
Рис. 9. Концентрационные зависимости коэффициентов активностей компонентов в жидком растворе во всем диапозоне составов от х=0 до 1
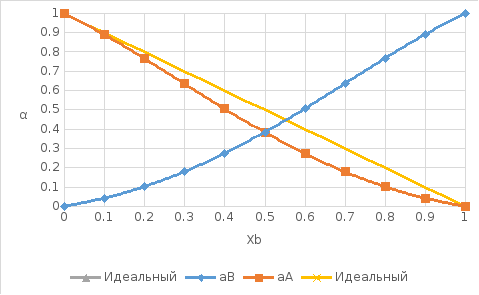
Рис. 10. Концентрационные зависимости активностей компонентов в жидком растворе во всем диапозоне составов от х=0 до 1
-
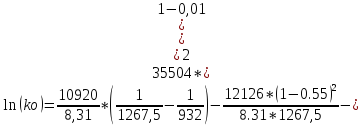
Расчёт равновесного коэффициента распределения компонента В (примесь) при Т=( Тпл(А) + Тэвт)/2:
Используя Т-х проекцию диаграммы состояния, при данной температуре определим состав:
Т=( Тпл(А) + Тэвт)/2=1267,5 K
Используя Т-х проекцию диаграммы состояния, при данной температуре определим состав:
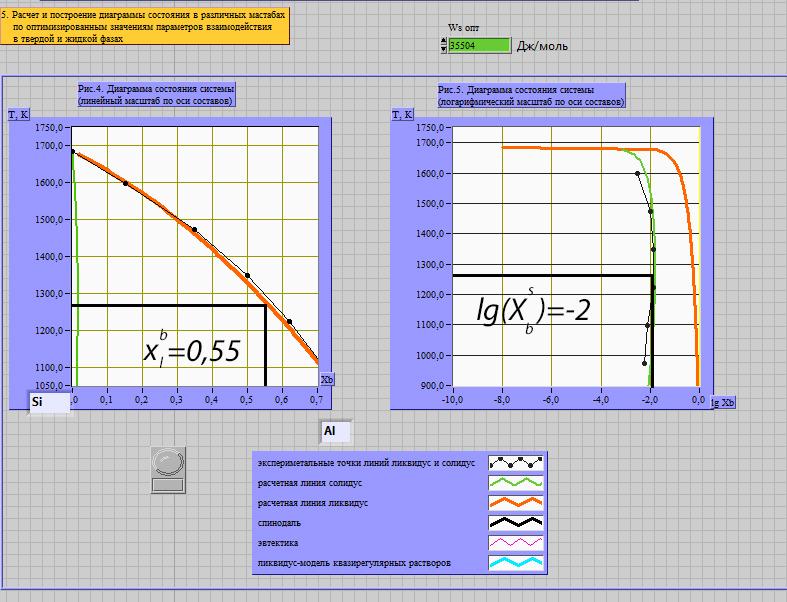
lg(Хbs )= -2
Хbl =0.55
Хbs =0.01
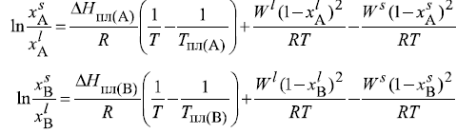
-
Построим спинодали при температурах от Ткомн до Тпл(А).
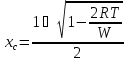
Таблица 3
|
T, K |
298 |
300 |
400 |
500 |
600 |
700 |
800 |
900 |
1000 |
1100 |
1200 |
1685 |
|
Xc1 |
1,09 |
1,09 |
1,12 |
1,15 |
1,17 |
1,20 |
1,22 |
1,25 |
1,27 |
1,29 |
1,31 |
1,41 |
|
Xc2 |
0,04 |
0,04 |
0,05 |
0,06 |
0,08 |
0,09 |
0,10 |
0,12 |
0,14 |
0,15 |
0,17 |
0,27 |
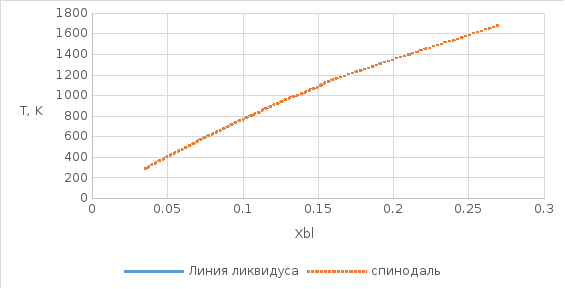 Рис.
11. Линии спинодалей в диапазоне темпертатур
от
Рис.
11. Линии спинодалей в диапазоне темпертатур
от
 до
до
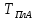 .
.

Рис.
11. Линии спинодалей в диапазоне темпертатур
от
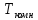 до
до
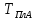 .
.
Вывод:
в
ходе работы были проанализированы
диаграммы состояния и подобранны
значения оптимальных параметров
взаимодействия в твёрдом и жидком
растворах, произведен расчет линии
ликвидуса для модели идеального раствора
и ее сравнения с экспериментальной.
Можно сделать вывод, что для описания
линии ликвидуса подходят модели
квазирегулярного и регулярного раствора.
Также расчёт и построение концентрационных
зависимостей активностей и коэффициентов
активностей
компонентов в твёрдом растворе при
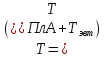 /2
в пределах области растворимости и в
жидком растворе во всём диапазоне
составов от х=0 до 1 при
/2
в пределах области растворимости и в
жидком растворе во всём диапазоне
составов от х=0 до 1 при
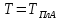 .
.
