
Лайм-бореллиоз / Масюкова 2016 Маркеры болезни Лайма
.pdf
ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
doi: 10.17116/klinderma201615147-52
Маркеры врожденного и адаптивного иммунитета в коже
и периферической крови у пациентов c мигрирующей эритемой как ранним проявлением болезни Лайма
Е.В. СОРОКИНА¹, Н.К. АХМАТОВА1, С.А. СХОДОВА1, С.А. МАСЮКОВА²
¹ФГБНУ «НИИ вакцин и сывороток им. И.И. Мечникова», Москва, Россия, 105064; 2Медицинский институт усовершенствования
врачей ФГБОУ ВПО «Московский государственный университет пищевых производств», Москва, Россия, 125080
Несмотря на хороший прогноз у пациентов с мигрирующей эритемой (МЭ), у некоторых пациентов болезни Лайма приобретает хроническое, торпидное течение, в том числе после проведения курса этиотропной антибиотикотерапии. На
клинический исход МЭ может влиять целая группа факторов: взаимодействие между Borrelia burgdorferi и иммунной
системой хозяина, генотип В. burgdorferi, резистентность к антибиотикам. В нашем исследовании мы изучили особенности
клинического течения, врожденного и адаптивного иммунного ответа у больных МЭ с целью определения прогноза и
выбора направленности патогенетической терапии. Цель исследования — изучение особенностей врожденного и адаптивного иммунитета у больных МЭ и определение их диагностической значимости. Материал и методы. Проведено
исследование в группе из 37 взрослых пациентов с МЭ: определены фагоцитарная активность нейтрофилов крови;
экспрессия TLRs на мононуклеарных лейкоцитах периферической крови (МЛПК) и клетках кожи в очагах мигрирующей
эритемы методом проточной цитометрии с применением мАТ к TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9 («Caltag
Laboratories», США) с использованием проточного цитометра FC-500 («Beckman Coulter», США); субпопуляционный состав лимфоцитов периферической крови; уровни про-, противовоспалительных и регуляторных цитокинов в сыворотке крови
методом твердофазного ИФА с использованием тест-систем фирмы «Biosource» (Австрия); основные классы
иммуноглобулинов (IgG, IgM, IgA) в сыворотке крови. Результаты. У больных мигрирующей эритемой выявлены высокие уровни экспрессии TLR2, TLR4, TLR7, TLR8 на клетках кожи в очагах, TLR2,4 на клетках крови; низкое содержание CD95+ и CD25+, высокие уровни в сыворотке IL-1b, IL-2 и IL-4, повышение уровня общего IgE. Заключение. Полученные данные позволяют указать на гиперэкспрессию TLR2, TLR4 на МЛПК и клетках кожи в очагах МЭ в качестве маркера активности
инфекционного процесса, вызванного Borrelia burgdorferi у больных МЭ; у больных МЭ уровни IL-4 и IL-5 коррелируют с
тяжестью течения ранней стадии болезни Лайма.
Ключевые слова: мигрирующая эритема, болезнь Лайма, Borrelia burgdorferi, врожденный и адаптивный иммунитет,
Toll-подобные рецепторы, иммунофенотип лимфоцитов, цитокины.
Markers of innate and adaptive immunity in the skin and peripheral blood of patients with erythema migrans as an early manifestation of Lyme disease
E.V. SOROKINA, N.K. AKHMATOVA, S.A. SKHODOVA, S.A. MASYUKOVA
I.I. Mechnikov Research Institute of Vaccines and Serums, Moscow, Russia, 105064; Department of skin and venereal diseases with cosmetology course of Medical Postgraduate Institute for Doctors of Moscow State University of Food Production, Moscow, Russia, 125080
Relevance. Despite the good prognosis in patients with erythema migrans (EM), chronic, torpid forms of Lyme disease develop in some patients, including the cases after the course of causal antibiotic therapy. Clinical outcome of EM can be affected by a number of factors, including interaction between Borrelia burgdorferi and the host immune system, genotype of B. burgdorferi, and antibiotic resistance. In this study, we investigated the characteristic features of clinical course, innate and adaptive immune response in EM patients to determine the prognosis and choose the direction of pathogenetic therapy. Objective. The objective of the investigation is to study the features of innate and adaptive immunity in patients with erythema migrans and determine their diagnostic significance. Material and methods. Examination of 37 adult EM patients included the study of phagocytic activity of blood neutrophils; expression of TLRs in the peripheral blood mononuclear leukocytes (PBML) and skin cells in the foci of erythema migrans by flow cytometry using mAb to TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9 («Catalog Laboratories»,
USA) using FC-500 flow cytometer («Beckman Coulter», USA); subpopulation composition of peripheral blood lymphocytes; the levels of proinflammatory, anti-inflammatory, and regulatory cytokines in the serum by ELISA using Biosource test systems
(Austria); major immunoglobulin classes (IgG, IgM, IgA) in the blood serum. Results. The patients with erythema migrans demonstrated high levels of TLR2, TLR4, TLR7, and TLR8 expression on the skin cells in the foci, TLR2,4 expression on blood cells; low levels of CD95 + and CD25+, high serum levels of IL-1b, IL-2, and IL-4, and high total IgE. Conclusion. These data indicate that the overexpression of TLR2 and TLR4 in PBML and skin cells in EM foci is a marker of active infection process caused by
Borrelia burgdorferi in EM patients. In EM patients, IL-4 and IL-5 levels correlate with the severity of the early stage of Lyme disease.
Keywords: erythema migrans, Lyme disease, Borrelia burgdorferi, innate and adaptive immunity, Toll-like receptors, immunophenotype of lymphocytes, cytokines.
|
¹e-mail: sorokina-cathrine@rambler.ru |
© Коллектив авторов, 2016 |
²e-mail: mguppmed@mail.ru |
КЛИНИЧЕСКАЯ ДЕРМАТОЛОГИЯ И ВЕНЕРОЛОГИЯ 1, 2016 |
47 |

ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Мигрирующая эритема (МЭ) — ранняя кожная манифестация болезни Лайма и патогномоничный признак Лайм-боррелиоза — в структуре группы фигурных эритем по частоте встречаемости занимает ведущее место. При наличии мигрирующей эритемы диагностика иксодового клещевого боррелиоза (ИКБ) не представляет трудностей. Однако у 20—40% больных не отмечается развития МЭ, в том числе на фоне отсутствия сведений о клещевой инокуляции, что затрудняет своевременное выявление заболевания и способствует позднему началу этиотропной терапии [10, 16, 19, 20]. ИКБ — инфекционное природно-очаговое трансмиссивное заболевание, вызываемое боррелиями и характеризующееся полисистемным поражением, склонностью к хроническому и рецидивирующему течению. Актуальность изучения ИКБ объясняется его широкой распространенностью на территории РФ и других регионов Европы и Америки, высокой восприимчивостью населения, полиморфизмом клинических проявлений, полисистемным поражением, высокой частотой формирования хронических форм, в том числе с последующей инвалидизацией [18, 22]. В 2011 г. частота заболеваемости ИКБ в РФ составила 7,02 на 100 тыс. населения [4]. Получение статистически достоверных данных об истинной заболеваемости болезнью Лайма (ЛБ) затрудняется недостаточностью пассивных обращений, а также ошибками диагностики. Формирование хронического течения инфекции, вызванной боррелиями, связано с количеством и биологическими свойствами возбудителя, уровнем резистентности и реактивности макроорганизма [6, 8, 13, 17, 21]. В процессе размножения боррелии активно подавляют механизмы защиты хозяина, вызывая иммуносупрессию и способствуя диссеминации возбудителя [9]. Развитие МЭ при ЛБ как стадии локальной инфекции, вызванной Borrelia burgdorferi, происходит на фоне недостаточности клеточных и/или гуморальных факторов неспецифической резистентности организма, что определяет направленность патогенетической терапии ранней стадии ЛБ [1, 3, 7, 12]. В последние десятилетия отмечается рост частоты тяжелых, хронических, торпидных форм ЛБ, склонных к рецидивированию [6, 7, 14, 26]. Несмотря на мощную антибиотикотерапию МЭ с длительным курсом и относительно большими разовыми дозами формирование хронических форм инфекции наступает у 3,5— 30% больных [5, 15, 25]. При лечении хронических форм ЛБ эффективность этиотропной терапии снижается и составляет 43,2—48,7% [2, 5].
Полагаясь на вышеизложенное, более глубокое и детальное изучение звеньев этиопатогенеза ЛБ (как острых, так и хронических ее форм) с выявлением и уточнением факторов, способствующих неблагоприятному исходу ИКБ, остаются актуальной проблемой. Нарушения функционирования иммун-
ной системы у больных как хронической, так и острой формой ЛБ указывают на целесообразность их коррекции с целью предотвращения развития тяжелых торпидных форм.
Материал и методы
Обследованы 37 больных МЭ в возрасте от 21 года до 65 лет. Группу контроля составили 15 здоровых доноров (8 мужчин и 7 женщин в возрасте от 14 до 65 лет). Исследование фагоцитарной активности нейтрофилов крови проводили в латекс-тесте, НСТтесте. Изучение экспрессии TLRs на мононуклеарных моноцитах периферической крови и клетках кожи проводили методом проточной цитометрии с применением моноклональных антител к TLR2, TLR3, TLR4, TLR7, TLR8, TLR9 («Caltag Labora tories», США) с использованием проточного цитометра FC-500 («Beckman Coulter», США). Субпопуляционный состав лимфоцитов периферической крови определяли методом проточной цитометрии (FACSCalibur, «Becton Dickinson», США) с использованием моноклональных антител к CD3, CD4, CD8, CD16, CD21, CD23, CD72, CD25, HLA-DR («Beckman Coulter»). Исследование классов иммуноглобулинов (IgG, IgM, IgA) в сыворотке крови проводили методом радиальной иммунодиффузии, уровня IgE в сыворотке крови методом твердофазного иммуноферментного анализа. Исследование концентрации свободных цитокинов в сыворотках крови проводили методом твердофазного иммуноферментного анализа с использованием тест-систем Biosource (Австрия) и при помощи цитометрической тест-системы FlowCytomix Human Th1/Th2 11 plex с использованием шариков, сенсибилизированных мАТ к цитокинам (GM-CSF, IFN-γ, IL-1β, IL-2, IL-4, IL-5, IL-6, IL-10, IL-17, TNF-α) фирмы «Bender Med Systems» (Австрия). Статистическую обработку результатов проводили методом параметрической и непараметрической базовой статистики с использованием W-критерия Шапиро—Вил- коксона, t-критерия Стьюдента, U-критерия Ман- на—Уитни, критерия Вилкоксона, критерия Pеаrson и Spearman, метода χ2, используя стандартный пакет статистических программ Windows 7 (StatSoft 7.0), Excel и WinMdi. Различия рассматривались как значимые при p≤0,05.
Результаты
Характеристика пациентов. В исследование были включены 37 больных МЭ в возрасте от 21 года до 65 лет. В ходе изучения полового и возрастного состава отмечено превалирование лиц мужского пола молодого и среднего возраста — таких было 23 (62,16%) больных, что может объясняться активным образом жизни с посещением эндемичных регио-
48 |
КЛИНИЧЕСКАЯ ДЕРМАТОЛОГИЯ И ВЕНЕРОЛОГИЯ 1, 2016 |

нов. Длительность существования МЭ варьировала |
вития болезни происходит на компонент флагелли- |
|||
от 14 до 72 дней (медиана 35,2 сут). Инкубационный |
на (p41) и внешнего поверхностного белка (OspA) и |
|||
период у 24 (64,86%) больных (т.е. у большинства) |
сопровождается |
появлением иммуноглобулинов |
||
составил 10—20 дней, у 8 (21,63%) пациентов — от |
IgМ и IgG. На ранних стадиях ЛБ часто регистриру- |
|||
20 до 30 дней, и только у 5 (13,51%) больных — более |
ются ложноотрицательные результаты. Уровень ан- |
|||
30 дней. Очаги эритемы локализовались преимуще- |
тител нарастает медленно, что является характерной |
|||
ственно на туловище у 18 (48,65%) больных, с оди- |
особенностью боррелиозной инфекции. Выявление |
|||
наковой частотой в области нижних, верхних конеч- |
IgМ, а также IgG к флагеллину (p41) и OspC указыва- |
|||
ностей и в области головы и шеи — у 7 (18,92%), |
ют на раннюю стадию ЛБ [6, 7]. |
|||
6 (16,22%) и 6 (16,22%) больных соответственно. |
Уровень экспрессии TLRs на МЛПК. В результате |
|||
У 30 (81,08%) больных (т.е. у большинства) наблю- |
проведенного изучения экспрессии TLRs на моно- |
|||
дались единичные очаги, однако у 7 (18,92%) чело- |
нуклеарных |
лейкоцитах |
периферической крови |
|
век отмечали развитие вторичных эритем, не свя- |
(МЛПК) у большинства больных с МЭ выявлены |
|||
занных с местом первичного аффекта, с преимуще- |
высокие уровни содержания клеток с экспрессией |
|||
ственной локализацией их в области головы и шеи, |
TLR2, превышающие нормальные значения в груп- |
|||
а также в области туловища. Эритемная форма ЛБ у |
пе здоровых лиц в 4 раза (25,1±4,6%). Количество |
|||
обследованных больных характеризовалась острым |
TLR4-экспрессирующих клеток у больных были |
|||
течением, легкой степенью тяжести с изолирован- |
также выше нормальных значений в 3,5 раза |
|||
ным поражением кожи в виде мигрирующей эрите- |
(13,8±4,5%). Число TLR3- и TLR9-позитивных кле- |
|||
мы. Очаги МЭ имели кольцевидные, дугообразные |
ток превышали нормальные значения, составляя |
|||
или полициклические очертания, дочерние вторич- |
59,9±5,8 и |
57,1±6,7% |
соответственно (рис. 1). |
|
ные эритемы наблюдали у 7 (18,91%) больных, МЭ |
В группе больных МЭ выявлена отрицательная кор- |
|||
была представлена в виде гомогенного очага у 3 |
реляционная связь между уровнями экспрессии |
|||
(8,11%) человек. Общее состояние не было наруше- |
TLR2, 4 на МЛПК и длительностью заболевания |
|||
но у 20 (54,05%) пациентов. Симптомы в виде повы- |
(r=–0,946 и r=–0,944 соответственно), что может |
|||
шения температуры, слабости, головной боли, ми- |
свидетельствовать об истощении и снижении акти- |
|||
алгий, артралгий наблюдались у 14 (37,84%), 11 |
вации врожденных механизмов при развитии воспа- |
|||
(29,73%), 7 (18,92%), 6 (16,22%) и 13 (35,14%) боль- |
лительного процесса. Установлено, что TLR2 играет |
|||
ных соответственно. Незначительный зуд в местах |
ключевую роль в реагировании на продукты грампо- |
|||
эритемы преимущественно в области вторичных |
ложительных бактерий, микобактерий и дрожжей |
|||
эритем беспокоил 8 (21,62%) пациентов. Увеличен- |
[23, 24]. TLR4 участвует в распознавании липополи- |
|||
ные регионарные лимфоузлы пальпировали у 20 |
сахаридов (ЛПС). Длительное присутствие PAMPs и |
|||
(54,05%) больных. В результате исследования сыво- |
DAMPs в организме, по всей вероятности, служит |
|||
ротки крови методом иммуноферментного анализа |
триггером для пролиферации клеток, несущих |
|||
(ИФА) IgМ-антитела к антигенам Borrelia burgdorferi |
TLRs, которые проводят сигналы с клеточной по- |
|||
(OspA, p41) были обнаружены у 24 (64,86%) боль- |
верхности с последующей активацией транскрип- |
|||
ных. Выявление антител к OspC у 14 (37,84%) паци- |
ционного фактора NF-κβ и синтезом провоспали- |
|||
ентов с МЭ свидетельствует о хорошей реактивно- |
тельных цитокинов (TNF-α, IL-6, IL-12, IFN-β) и |
|||
сти у этой группы больных. IgG к антигену VlsE Bor |
белков (например, индуцибельная NO-синтетаза) |
|||
relia burgdorferi обнаружены у 13 (35,13%) пациентов. |
приводящих |
к |
активации иммунокомпетентных |
|
Первичный иммунный ответ на ранних стадиях раз- |
клеток [8]. |
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 1. Экспрессия TLRs на МЛПК у больных хронической мигрирующей эритемой.
* — Достоверность различий между группами больных мигрирующей эритемой и здоровых лиц (p<0,05).
КЛИНИЧЕСКАЯ ДЕРМАТОЛОГИЯ И ВЕНЕРОЛОГИЯ 1, 2016 |
49 |

ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Уровень экспрессии TLRs на клетках кожи в очагах МЭ. При изучении экспрессии TLRs клетками кожи в очагах МЭ, проведенном у 13 больных, наблюдались достоверные различия в экспрессии TLR2, 7, 8. Уровень экспрессии TLR2 и TLR4 в очагах с длительностью существования до 30 дней (n=7; 19,4±4,3 и 13,6±3,8% соответственно) были достоверно выше, чем в более длительно существующих очагах (n=6; 5,8±1,6 и 6,8±2,5% соответственно) (табл. 1). Известно, что первый барьер при проникновении экзогенных патогенов в человеческой коже представляют кератиноциты, которые формируют резистентность к инфекции благодаря функционированию осуществляемых ими иммунных механизмов.
В обследуемой группе больных МЭ выявлена высокая обратная корреляционная связь между длительностью существования очагов эритемы и экспрессией на клетках кожи в очагах TLR2 и TLR4 (r=–0,946 и r=–0,944 соответственно; p<0,05). Как было отмечено выше, TLR2 и TLR4 необходимы для распознавания ЛПС, а TLR2, димеризуясь с TLR1, распознает триацилированные липопротеины, такие как Borrelia burgdorferi OspA. Поэтому в исследуемой группе больных выявленная гиперэкспрессия TLR2, 4 МЛПК и в коже указывает на распознавание ЛПС боррелий и является маркером активности инфекционного процесса, вызванного Borrelia burg dorferi. Снижение экспрессии TLR2 по мере развития заболевания в длительно существующих очагах может отражать дисфункции в системе TLR, частично объясняя хронизацию и рецидивирование инфекции в результате нарушения кооперации клеток врожденного и, как следствие, адаптивного иммунитета. У больных МЭ выявлена высокая прямая корреляционная связь между длительностью заболевания и экспрессией TLR7 и TLR8 (r=0,937 и r=0,956 соответственно; p<0,05). Таким образом, гиперэкспрессия рецепторов TLR7 и TLR8 может отражать развитие хронического воспаления в коже и быть прогностическим маркером развития хронической формы МЭ. Также выявлена прямая корреляционная связь между тяжестью течения эритем-
ной формы ЛБ и уровнями экспрессии TLR2 (r=0,587), TLR4 (r=0,571), TLR9 (0,680209) на клетках кожи (p<0,05).
Индукция сигналов через Toll-подобные рецепторы может обеспечивать не только защиту организма от различных инфекций. Нарушение функции проводимости данных сигналов приводит к развитию целого ряда патологических процессов в организме [11]. Например, чрезмерная продукция провоспалительных цитокинов эндогенными лигандами может стать причиной развития хронического воспаления, аутоиммунных заболеваний [27]. TLRs не только выполняют функцию сенсоров чужеродных PAMPs, но могут также инициировать иммунный ответ на эндогенные стимулы, такие как белки теплового шока, некротический дебрис, фибриноген, фрагменты фибронектина. Поэтому TLRs могут играть ключевую роль в развитии неинфекционных патологий. В частности, агонисты TLRs участвуют в индукции местного и системного воспаления, в патогенезе аутоиммунных, онкологических заболеваний и других патологических процессов, характеризующихся хроническим воспалением.
Содержание субпопуляций лимфоцитов в периферической крови. В результате оценки содержания субпопуляций лимфоцитов периферической крови выявили снижение содержания лимфоцитов с маркерами CD95+ (36,8±7,4%) и CD8+ (21,6±2,1%) на фоне повышения относительного содержания В-лимфоцитов CD72+ (16,9±2,8%). Относительные значения содержания CD25+ составляли 8,2±2,3% и приближались к нижней границе нормальных значений. Уровень лимфоцитов, экспрессирующих на своей мембране молекулы антигенного представления (HLA-DR+), находился на верхней границе нормальных значений, составляя 20,1± 2,8% (табл. 2).
Уровень цитокинов в сыворотке крови. При изучении цитокинового профиля у больных МЭ в сыворотке крови исходно наблюдалось значительное повышение уровня провоспалительных цитокинов IL1b, IL-2 и IL-4, их средние значения составили (19,6±1,9 и 37,2±2,7 пг/мл) на фоне повышения
Таблица 1. Уровень экспрессии TLRs в коже у больных МЭ до лечения в зависимости от длительности существования очагов
Группа |
|
TLR2 |
TLR4 |
TLR3 |
TLR9 |
TLR7 |
TLR8 |
n |
|
Количество клеток с экспрессией %, M±σ |
|
||||
|
|
|
|
(Me) (LQ-UQ) |
|
|
|
Группа в целом |
13 |
12,6±2,9# |
10,2±3,2 |
4,8±1,5 |
9,5±2,4 |
12,5±2,1 |
16,1±3,5 |
|
|
12,2 (12—12,8) |
10,5 (9,7—10,9) |
4,4 (4—4,7) |
9,1 (9—9,8) |
12,4 (12—12,7) |
16,1 (15,5—16,7) |
1-я подгруппа (очаги |
7 |
19,4±4,3* |
13,6±3,8 |
5,3±1,6 |
10,6±2,1 |
9,3±1,6* |
11,2±2,4* |
до 30 дней) |
|
19,2 (19—19,6) |
13,5 (13,2—13,8) |
5,2 (5; 5,3) |
11 (10,4; 11,3) |
9,2 (9; 10,2) |
11 (11; 11,7) |
2-я подгруппа (очаги |
6 |
5,8±1,6*# |
6,8±2,5 |
4,2±1,5 |
8,3±1,7 |
16,4±2,5* |
21±4,6* |
более 30 дней) |
|
5,4 (4,8—6,9) |
6,6 (6,2—7,3) |
3,9 (3,8—4,6) |
8,3 (8,1—8,7) |
16,4 (15,2—17,5) |
20,9 (18,6—23,8) |
Примечание. * — достоверность различий между показателями, полученными в 1-й и 2-й подгруппах (p<0,05); # — достоверность различий между группой больных МЭ в целом и 1-й и 2-й подгруппами по тесту Манна—Уитни (p<0,05); n — число образцов; М — средняя арифметическая; Ме — медиана; σ —стандартное отклонение; LQ—UQ — 25—75-й перцентили.
50 |
КЛИНИЧЕСКАЯ ДЕРМАТОЛОГИЯ И ВЕНЕРОЛОГИЯ 1, 2016 |
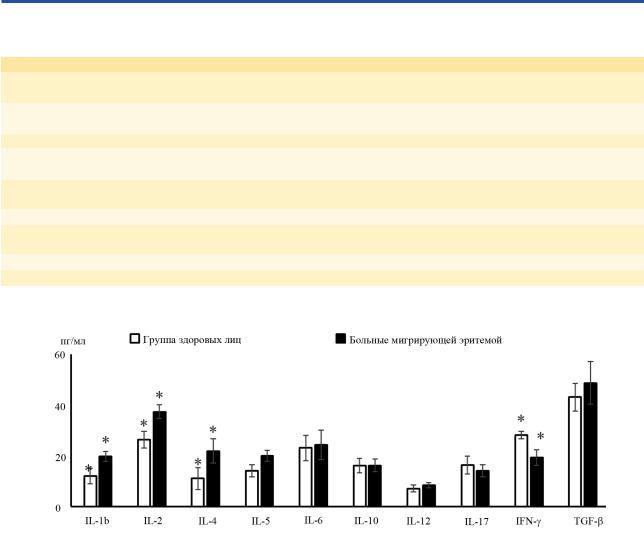
Таблица 2. Содержание субпопуляций лимфоцитов в периферической крови больных мигрирующей эритемой
Показатель |
Единица измерения |
Нормальное значение |
Больные МЭ, M±σ (n=37) |
|
CD45+/CD3+ |
|
% |
60—76 |
62,5±6,9 |
|
·106 кл/мкл |
1100—1700 |
1280,0±134,0 |
|
СD3+/CD4+ |
|
% |
38—46 |
40,4±6,1 |
|
·106 |
кл/мкл |
700—1100 |
980±54,6 |
CD25+ |
|
% |
8—12 |
8,2±2,3 |
CD3+/CD8+ |
|
% |
31—40 |
21,6±2,1 |
|
·106 |
кл/мкл |
500—1000 |
526,8±42,7 |
CD16+/CD32+ |
|
% |
10—19 |
11,4±2,6 |
|
·106 |
кл/мкл |
200—400 |
240,8±36,2 |
CD72+ |
|
% |
11—16 |
16,9±2,8 |
HLA-DR+ |
|
% |
5—20 |
20,1±2,8 |
|
·106 |
кл/мкл |
100—500 |
530±46,1 |
CD95+ |
|
% |
41—63 |
36,8±7,4 |
CD21+ |
|
% |
11—16 |
14,5±5,2 |
|
|
|
|
|
|
|
|
|
|
Рис. 2. Уровень цитокинов в сыворотке крови больных мигрирующей эритемой по сравнению с группой здоровых лиц.
* — Достоверность различий показателей в группе до лечения и группой здоровых лиц (p<0,05).
уровня IL-4 и IL-5 (до 21,8±4,7 и 19,9±2,1 пг/мл) и |
но; p<0,05), что указывает на прогностическую зна- |
снижения регуляторного цитокина IFN-γ (19,2±3,1 |
чимость определения данных цитокинов. Повыше- |
пг/мл) по сравнению с группой здоровых лиц. Ос- |
ние уровня общего IgE (187,8±28,4 кЕ/л) у больных |
новными мишенями IL-4, продуцируемого Th2- |
МЭ согласуется с повышенной экспрессией IL-4 |
клетками, являются В-лимфоциты. IL-4 служит ро- |
(рис. 2). |
стовым фактором для В-лимфоцитов, могут вызы- |
|
вать их пролиферацию без дополнительных стиму- |
Заключение |
лов. IL-4 служит функциональным антагонистом |
|
IFN-γ как при непосредственном действии на клет- |
Таким образом, в обследованной группе боль- |
ки (подавляет выработку IFN-γ и ослабляет некото- |
ных с МЭ преобладали лица мужского пола молодо- |
рые его эффекты), так и при индукции образования |
го и среднего возраста; заболевание характеризова- |
Th2-клеток. Анализ полученных данных позволяет |
лось легким течением, наличием эритематозных |
предполагать активацию Т-лимфоцитов по Th2 пути |
очагов кольцевидных, полициклических и дуго |
при МЭ, поскольку происходит увеличение экс- |
образных очертаний, развитием вторичных эритем у |
прессии IL-4 и соответственно снижение находяще- |
18,92% больных. Эритемная форма ЛБ сопровожда- |
гося в конкурентных отношениях с ним IFN-γ. В |
лась нарушениями функционирования врожденно- |
группе больных МЭ выявили высокую прямую кор- |
го и адаптивного иммунитета, что нашло отражение |
реляционную связь между тяжестью течения ЛБ и |
в гиперэкспрессии TLR2 и TLR4 на клетках крови и |
уровнями сывороточных противовоспалительных |
клетках кожи, TLR7 и TLR8 на клетках кожи в оча- |
цитокинов IL-4 и IL-5 (0,572 и 0,650 соответствен- |
гах; значительном увеличении в сыворотке уровней |
КЛИНИЧЕСКАЯ ДЕРМАТОЛОГИЯ И ВЕНЕРОЛОГИЯ 1, 2016

ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
IL-1b, IL-2 и IL-4 и наличии прямой корреляционной связи между тяжестью течения ЛБ и уровнями сывороточных противовоспалительных цитокинов IL-4 и IL-5; повышении уровня общего IgE.
Полученные в нашем исследовании данные о нарушениях иммунного ответа у больных эритемной формой ЛБ, согласуются с данными других исследователей. Формирование хронических и тор-
ЛИТЕРАТУРА/REFERENCES
1.Бараулина А.С., Кологривова Е.Н., Пронина Н.А. и др. Признаки иммунной недостаточности у больных иксодовым клещевым боррелиозом. РАЖ. 2008;1:30-31.
пидных форм, невысокая эффективность этиотропной терапии, а также нарушения функционирования врожденного и адаптивного иммунитета у больных как хронической, так и острой формой ЛБ, указывают на целесообразность коррекции этих нарушений с целью предотвращения развития тяжелых торпидных форм ЛБ.
14.Ferrandiz-Pulido C, Garcia-Patos V. A review of causes of Stevens-Johnson syndrome and toxic epidermal necrolysis in children. Arch Dis Child. 2013;98(12):998-1003.
2.Воробьева Н.Н. Клиника, лечение и профилактика иксодовых клещевых 15. Fingerle V, Wilske B. Stage-oriented treatment of Lyme borreliosis. MMW
боррелиозов. Методические рекомендации. Под ред. Воробьева Н.Н. Пермь. 1998.
3.Колчина А.С. Иммунопатогенетические основы хронизации иксодового клещевого боррелиоза: Дис. … канд. мед. наук. М. 2010.
4.Коренберг Э.И. Инфекции, передающиеся иксодовыми клещами в лесной зоне, и стратегии их профилактики: изменение приоритетов.
Эпидемиология и вакцинопрофилактика. 2013;5:7-17.
5.Лесняк О.М. Лайм-боррелиоз. Екатеринбург. 1999.
Fortschr Med. 2006 Jun 22;148(25):39-41.
16.Hofmann H. Early diagnosis of Lyme borreliosis. MMW Fortschr Med. 2006;148(25):32,34,36.
17.Iliopoulou BP, Huber BT. Infectious arthritis and immune dysregulation: lessons from Lyme disease. Curr Opin Rheumatol. 2010;22(4):451-455.
18.Ljøstad U, Mygland A. Lyme borreliosis in adults. Tidsskr Nor Laegeforen. 2008;128(10):1175-1178. [Lesnyak O.M. Lyme borreliosis]. Ekaterinburg. 1999.
6.Лобзин Ю.В., Усков А.Н., Козлов С.С. Лайм-боррелиоз (иксодовые 19. Mullegger RR. Dermatological manifestations of Lyme borreliosis. Eur J
клещевые боррелиозы). СПб. 2000.
7.Манзенюк И.Н., Манзенюк О.Ю. Клещевые боррелиозы (болезнь Лай ма). 2005.
8.Рябиченко Е.В., Веткова Л.Г., Бондаренко В.М. Молекулярные аспекты повреждающего действия бактериальных липополисахаридов. Журнал микробиологии. 2004;3:98-105.
9.Berndtson K. Review of evidence for immune evasion and persistent infection in Lyme disease. Int J Gen Med. 2013 Apr 23;6:291-306.
10.Cameron DJ, Johnson LB, Maloney EL. Evidence assessments and guideline recommendations in Lyme disease: the clinical management of known tick bites, erythema migrans rashes and persistent disease. Expert Rev Anti Infect Ther. 2014;12(9):1103-1135.
11.Carroll MC, Holers VM. Innate autoimmunity. Adv Immunol. 2005;86:137157.
12.Diterich I, Härter L, Hassler D, Wendel A, Hartung T. Modulation of cyto kine release in ex vivo-stimulated blood from borreliosis patients. Infect Im mun. 2001;69:687-694.
13.Elsner RA, Hastey CJ, Olsen KJ, Baumgarth N. Suppression of LongLived Humoral Immunity Following Borrelia burgdorferi Infection. PLoS Pathog. 2015;11(7):e1004976.
Dermatol. 2004;14(5):296-309.
20.Müllegger RR, Glatz M. Skin manifestations of lyme borreliosis: diagnosis and management. Am J Clin Dermatol. 2008;9(6):355-368.
21.Petnicki-Ocwieja T, Kern A. Mechanisms of Borrelia burgdorferi internalization and intracellular innate immune signaling. Front Cell Infect Micro biol. 2014 Dec 15;4:175.
22.Speelman P, Jongh BM, Wolfs TF, Wittenberg J., Kwaliteitsinstituut voor de Gezondheidszorg (CBO). Guideline Lyme borreliosis. Ned Tijdschr Ge neeskd. 2004;148(14):659-663.
23.Takeuchi O, Akira S. Recognition of viruses by innate immunity. Immunol. Rev. 2007;220(1):214-224.
24.Takeuchi O, Hoshino K. TLR2 and MyD88. J. Immunol. 2000;165:53925396.
25.Vanousová D, Hercogová J. Dermatol Ther. 2008;21(2):101-109.
26.Wei CY, Ko TM, Shen CY, Chen YT. A recent update of pharmacogenomics in drug-induced severe skin reactions. Drug Metab Pharmacokinet. 2012;27(1):132-141.
27.Wen L, Peng J, Li Z. The effect of innate immunity on autoimmune diabetes and the expression of Toll-like receptors on pancreatic islets. J Immunology. 2004;172:3173-3180.
52 |
КЛИНИЧЕСКАЯ ДЕРМАТОЛОГИЯ И ВЕНЕРОЛОГИЯ 1, 2016 |

