
лабы 2 семестр / азот / Для студентов азот
.docx-
Газообразные хлороводород и аммиак реагируют друг с другом с образованием «дыма» хлорида аммония:
NH3 + HCl NH4Cl.
-
При нагревании дигидрофосфат аммония разлагается по уравнению:
NH4H2PO4
 NH3
+ H3PO4.
NH3
+ H3PO4.
Анион соли не проявляет окислительных свойств, поэтому при разложении выделяется аммиак. Об этом свидетельствует появление малиновой окраски у бумажки, смоченной раствором фенолфталеина:
NH3 + H2O ⇄ NH3H2O ⇄NH4+ + OH–.
-
Дихромат-ион является окислителем, поэтому при разложении дихромата аммония выделяется азот, а не аммиак:
(NH4)2Cr2O7
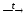 Cr2O3
+ N2 +
4H2O.
Cr2O3
+ N2 +
4H2O.
-
Карбонат аммония разлагается уже при температуре 60С
(NH4)2CO3
 2NH3
+ CO2
+ H2O.
2NH3
+ CO2
+ H2O.
Сульфат аммония термически более устойчив, его разложение начинается при температуре 150 С:
(NH4)2SO4
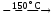 NH4HSO4
+ NH3.
NH4HSO4
+ NH3.
В обоих случаях наблюдается выделение аммиака. В случае карбоната аммония при разложении соли не остается твердого остатка. До полного разложения сульфата аммония (без твердого остатка) нужна гораздо более высокая температура:
NH4HSO4
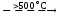 NH3 +
SO3 +
H2O.
NH3 +
SO3 +
H2O.
-
При действии избытка водного раствора аммиака на растворы сульфата меди и хлорида никеля происходит образование аммиакатов. Сначала происходит осаждение гидроксидов этих металлов, которые затем растворяются в избытке водного раствора NH3:
CuSO4 + 2NH3H2O Cu(OH)2 + (NH4)2SO4
Cu(OH)2 + 4NH3H2Oизб [Cu(NH3)4]SO4 + 4H2O
NiCl2 + 2NH3H2O Ni(OH)2 + 2NH4Cl
Ni(OH)2 + 6NH3H2O [Ni(NH3)6]SO4 + 6H2O.
-
Разложение нитрата аммония при температурах 190220 С происходит по уравнению:
NH4NO3
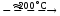 N2O
+ 2H2O.
N2O
+ 2H2O.
Перегревать смесь нельзя, так как при этом происходит взрыв (образуются газообразные N2, O2 H2O).
Оксид азота(I) проявляет окислительные свойства, он поддерживает горение, в нем вспыхивает тлеющая лучина:
C + 2N2O CO2 + 2N2.
-
При взаимодействии меди с 30%-ной азотной кислотой в качестве основного продукта восстановления нитрат-иона выделяется оксид азота(II):
3Cu + 8HNO3разб 3Cu(NO3)2 + 2NO + 4H2O.
Оксид азота(II) бесцветен, но при соприкосновении с кислородом воздуха окисляется до оксида азота(IV), что сопровождается появлением бурой окраски:
2NO + O2 2NO2.
-
Оксид азота(II) способен образовывать нитрозильные комплексы. В частности, с растворами солей Fe(II) образуется бурое кольцо нитрозильного комплекса:
[Fe(H2O)6]SO4 + NO [Fe(H2O)5NO]SO4 + H2O.
-
Оксид азота(IV) (бурый газ) выделяется в результате реакции:
Cu + 4HNO3конц Cu(NO3)2 + 2NO2 + 2H2O.
При пропускании NO2 через воду происходит реакция
NO2 + H2O ⇄ HNO3 + HNO2.
В результате протекания реакции создается кислая среда, о чем свидетельствует изменение окраски метилового оранжевого до красной.
-
Оксид азота(IV) реагирует с раствором щелочи по уравнению:
2NO2 + 2NaOH NaNO3 + NaNO2 + H2O.
О присутствии нитрит-ионов в образовавшемся растворе свидетельствует обесцвечивание окраски подкисленного раствора перманганата калия:
5NaNO2 + 2KMnO4 + 3H2SO4 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
-
В реакциях металлов с азотной кислотой всегда образуется смесь продуктов восстановления нитрат-ионов. Преобладающий продукт восстановления зависит от активности металла и концентрации раствора кислоты. Медь – относительно малоактивный металл, поэтому в реакции Cu с концентрированной азотной кислотой преимущественно образуется NO2:
Cu + 4HNO3конц Cu(NO3)2 + 2NO2 + 2H2O.
Активность магния существенно выше активности меди, поэтому происходит более глубокое восстановление нитрат-ионов:
4Mg + 10HNO3 4Mg(NO3)2 + N2O + 5H2O.
-
Азотная кислота окисляет многие неметаллы, например, серу:
S + 6HNO3конц
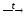 H2SO4
+ 6NO2
+ 2H2O.
H2SO4
+ 6NO2
+ 2H2O.
Сульфат-ионы, образовавшиеся в результате окисления серы, могут быть обнаружены в реакции с BaCl2:
H2SO4 + BaCl2 BaSO4 + 2HCl.
-
Нитрат-ионы в щелочной среде могут быть восстановлены активными амфотерными металлами (алюминием, цинком), входящими в состав сплава Деварда, например:
8Al + 3NaNO3 + 5NaOH + 18H2O 8Na[Al(OH)4] + 3NH3.
Выделение аммиака может быть обнаружено с реактивом Несслера:
NH3 + 2K2[HgI4] + 3KOH [Hg2N]IH2O +7KI + 2H2O.
-
Нитрат-ионы, лишь в редких случаях проявляющие окислительные свойства в растворах, являются сильными окислителями в твердофазных реакциях, протекающих при повышенных температурах:
MnSO4 + 2KNO3
+ 4KOH
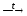 K2MnO4
+ 2KNO2 + K2SO4
+ 2H2O.
K2MnO4
+ 2KNO2 + K2SO4
+ 2H2O.
-
Восстановление нитрит-ионов в водных растворах происходит легче по сравнению с нитрат-ионами: сказываются кинетические причины. В нейтральных растворах ни NaNO3, ни NaNO2 йодидом калия не восстанавливаются. В кислой среде происходит восстановление нитрита, но не нитрата:
2NaNO2 + 2KI + 2H2SO4 2NO + I2 + Na2SO4 + K2SO4 + 2H2O

NaNO3 + KI + H2SO4
