
электролиз воды
.docxМИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное
учреждение высшего образования
Нижегородский государственный технический университет им. Р.Е. Алексеева
(НГТУ)
Институт физико-химических технологий и материаловедения (ИФХТиМ)
Кафедра «Технология электрохимических производств
и химии органических веществ (ТЭПиХОВ)»
Дисциплина «Электрохимические технологии»
ДОКЛАД
по теме
«Электролиз воды»
|
Выполнила: Студентка гр. ____________ |
|
|
|
Принял: |
|
_________________________________________ |
Электролиз
воды
–физико-химический процесс, при котором
под действием постоянного электрического
тока вода разлагается на кислород и
водород. Постоянное напряжение для
ячейки получается, как правило,
выпрямлением трехфазного переменного
тока. В электролитической ячейке
дистиллированная вода подвергается
электролизу, при этом химическая реакция
идет по следующей известной схеме: 
Для раздельного получения газов используют электролизеры с диафрагмами или мембранами, разделяющими катодное и анодное пространство. Использование специальных электродов позволяет производить из воды озон и перекись водорода.
На аноде производится озон: 3H2O → O3 + 6e− + 6H+ (вода подкисляется).
На катоде – перекись водорода: O2 + 2H2O + 2e− → H2O2 + 2OH− (вода подщелачивается). Удельная проводимость очищенной воды незначительна: при 18°С она составляет 4,41·10-6 Ом-1·м-1. Поэтому электролитическое разложение воды проводят в присутствии фонового электролита. Ввиду существенных коррозионных проблем, возникающих при электролизе кислот, в настоящее время почти все электролизеры используют водные растворы на основе гидроксидов калия и натрия с концентрацией 350-400 г./л. Растворы КОН имеют преимущества перед NaOH в силу больше проводимости иона К+ против иона Na+. Концентрация КОН соответствует оптимальным значениям плотностей тока. Небольшие примеси к КОН не являются препятствием к его использованию. Для предотвращения или уменьшения коррозии деталей электролизеров при приготовлении электролита применяют только чистые КОН и NaOH.
Раствор электролита, используемый в установках для электролиза воды, содержит 16-20% NaOH или 25-30% КОН.
Побочные реакции: Естественная пресная (не дистиллированная) вода всегда содержит минеральные соли – сульфаты, карбонаты, хлориды. В целях получения хлора для пролонгированного эффекта обеззараживания воды интересны только хлориды. В воде они представлены в основном хлоридом натрия (NaCl), хлоридом кальция (CaCl) и хлоридом калия (KCl).
На примере с хлоридом натрия реакция образования хлора электролизом будет следующей.
Соль, растворенная в воде: 2NaCl + H2O → 2Na+ +2Cl– + 2H2O
Во время электролиза на аноде формируется хлор: 2Cl– → Cl2+2e– (вода подкисляется).
А у катода образуется гидроокись натрия: Na+ + OH– → NaOH (вода подщелачивается).
Эта реакция является недолгой, поскольку любой хлор, произведенный у анода, быстро потребляется для формирования гипохлорита натрия: Cl2 + 2NaOH → H2 + 2NaOCl.
Подобные реакции электролиза происходят и с хлоридами кальция и калия.
Материал электродов:
Для
электролиза воды применяют нержавеющую
сталь, часто покрытую никелем, с целью
уменьшения перенапряжения водорода.
![]()
Конструкции электролизеров
Промышленные электролизеры для производства водорода бывают двух типов:
- монополярные - электроды питаются параллельно в одной и той же емкости;
- биполярные
- электроды питаются последовательно
(электрод с одной стороны поверхности
является анодом, а с другой - катодом) и
образуют укладку ячейки.
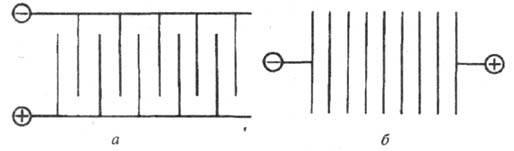
При монополярном включении электродов все электроды одного знака присоединены к шине, идущей от соответствующего полюса источника постоянного тока. При биполярном включении электродов ток подводится только к крайним электродам 1 и 2, которые являются монополярными электродами. Все остальные электроды подвода тока не имеют и работают биполярно.
Соотношение между током и напряжением в электролизерах
Чем ниже напряжение на ячейке электролизера, тем меньшую он потребляет мощность. С ростом температуры электролита напряжение электролизера снижается поэтому энергетически выгодно было бы эксплуатировать электролизеры при повышенных температурах (при работе под давлением - с температурой 100°С и даже выше). Однако с ростом температуры электролита усиливаются коррозионные процессы и значительно ускоряется старение прокладочного материала паронита. Поэтому для небольших электролизных установок на электростанциях основное значение имеет надежность оборудования и длительность работы между ремонтами, температуру электролита следует поддерживать 60-75°С, а в тех случаях, когда не требуется работа электролизера с полной нагрузкой, желательно поддерживать 40-50°С. При этом для сохранения нужной производительности электролизера следует повышать напряжение.
Для того чтобы ток проходил через электролизер с биполярным включением электродов, напряжение на электролизере (U) должно быть равно:
U= U1·n, (22)
где, U1 - напряжение на одной ячейке;
n - количество ячеек.
Напряжение на монополярном электролизере равно напряжению между парой электродов (на одной ячейке U= U1).
Ток (I), подводимый к монополярному электролизеру, разветвляется на все электроды в соответствии с законами параллельного соединения. Поэтому ток, идущий через пару электродов I1=I/n.
В биполярном электролизере ток, идущий через каждую пару электродов, равен току через весь электролизер (I1=I) - закон последовательного соединения.
Таким образом, при одинаковой токовой нагрузке на монополярный и биполярный электролизеры количество полученного вещества в биполярном электролизере в n раз больше. Поэтому для биполярного электролизера существуют понятия линейной и эквивалентной силы тока. Эквивалентная сила тока равняется линейной силе тока, проходящего через электролизер, умноженной на количество ячеек:
Iэкв=I·n.
Монополярные электролизеры не создаются на токовые нагрузки выше 200 - 300 кА, биполярные электролизеры работают при эквивалентной токовой нагрузке до 2000 кА. Следовательно, биполярные электролизеры более мощные и более производительные.
Другим достоинством биполярных электролизеров является снижение падения напряжения в ошиновке электролизера и в контактах за счет уменьшения их количества
Кроме того, уровень автоматизации биполярных электролизеров выше, чем монополярных, что уменьшает затраты рабочей силы на их обслуживание.
Все
современные конструкции электролизеров
для электролиза воды относятся к
фильтр-прессному типу с биполярным
включением электродов.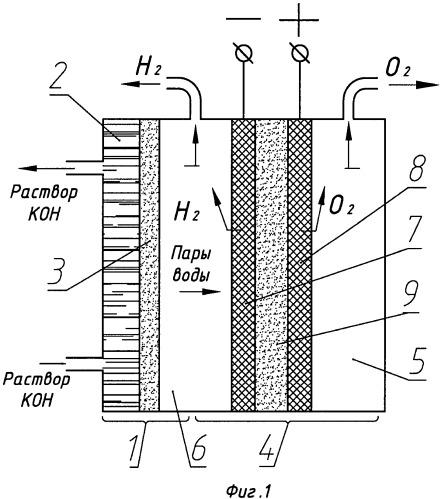
Схема фильтр-прессного электролизера
Увлажняющий элемент (1) сборочного узла содержит электролитную полость (2) и пористую мембрану (3), пропускающую через себя пары воды и не пропускающую жидкость. Пористая мембрана (3) отделяет увлажняющий элемент (1) от электролизной ячейки (4), которая включает в себя кислородную (5) и паро-водородную (6) полости, пористый катод (7), пористый анод (8) и пористую электролитосодержащую матрицу (9).
Схема биполярного фильтр-прессного электролизера
Как
видно из фиг.1, электролизер состоит из
блока дистанцированных друг от друга
электродов 2 и охватывающего блок
диэлектрического стакана 3, погруженных
в электролит 4 в корпусе 5. Ток к концевым
электродам блока 2 подведен изолированными
снаружи проводниками 6, пропущенными в
электролит 4 через гермовводы 7. Через
патрубок 8 из корпуса 5 выходит
водородно-кислородная смесь, а через
патрубок 1 корпус пополняют электролитом.
Список литературы:
-
Якименко Л.Н. Получение водорода, кислорода, хлора и щелочей. - М.: Химия, 1981;
-
Фиошин М.Я., Павлов В. Н., Электролиз в неорганической химии, М., 1976;
-
Мазанко А.Ф., Камарьян Г.М., Помашин О.П., Промышленный мембранный электролиз, М., 1989;
-
А.И. Левин, Теоретические основы электрохимии, Гос. Научно-техн. Издат., Москва, 1963;
-
Л.М. Якименко и др., Электролиз воды, изд. «химия», Москва, 1970.
