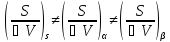- •Гетерогенность и дисперсность
- •Классификация по размерам частиц дисперсной фазы
- •Поверхностное натяжение
- •Метод избыточных величин Гиббса. Вывод уравнения для свободной энергии системы.
- •Уравнение Гиббса для плоского поверхностного слоя
- •Понятие об адсорбции. Причины адсорбции. Количественные характеристики адсорбции.
- •Вывод адсорбционного уравнения Гиббса для разбавленных растворов и его анализ.
- •Поверхностная активность по Ребиндеру. Графическое определение поверхностной активности.
- •Влияние пав на адсорбцию. Правило Траубе, аналитическое выражение и физическое обоснование
- •Диаграммы состояния поверхностных пленок.
- •Уравнение состояния двумерного газа. Уравнение Фрумкина для реального газа.
- •Классификация пав по химическому строению
- •Мицеллообразование. Строение мицелл.
- •Ккм. Определение ккм. Влияние различных факторов на ккм.
- •Влияние температуры на растворимость ионогенных пав. Диаграмма состояния системы. Точка крафта.
- •Влияние температуры на растворимость неионогенных пав. Диаграмма состояния системы. Точка помутнения и точка высаливания.
- •Теория мономолекулярной адсорбции Ленгмюра. Анализ уравнения Ленгмюра
- •Линейная форма уравнения Ленгмюра. Нахождение константы уравнения графическим методом. Определение удельной поверхности адсорбента.
- •Адсорбция как обратимый экзотермический процесс. Интегральная и дифференциальная теплота адсорбции. Изобара адсорбции.
- •Сравнительная характеристика физической адсорбции и хемосорбции.
- •Природа адсорбционных сил. Уравнение Леннард-Джонса.
- •Смачивание. Краевой угол и теплота смачивания. Уравнение Юнга. Влияние пав на смачивание.
- •Когезия и адгезия. Характер разрушения адгезионного соединения. Условие разрушения адгезионного соединения. Уравнение Дюпре для работы адгезии.
- •Методы диспергирования. Уравнение Ребиндера для работы измельчения
- •Эффект Ребиндера и его роль в диспергировании.
- •Конденсационное образование лиофобных дисперсных систем. Уравнение для радиуса и работы образования критического зародыша
- •Химические и физические методы создания метастабильности в системе. Зависимость размера частиц от различных факторов
- •Гетерогенная конденсация
- •Принцип построения мицелл ионостабилизированных золей. Пример
- •Пептизация
- •Получение лиофильных коллоидных систем
-
Гетерогенность и дисперсность
Гетерогенность указывает на качественную сторону объектов коллоидной химии - наличие межфазной поверхности и качество этой поверхности. Существование межфазной поверхности предполагает наличие поверхностного натяжения . Величина поверхностного натяжения определяет степень различия между соприкасающимися фазами. Чем сильнее выражена гетерогенность, т. е. чем более резко отличаются фазы по своей природе, тем больше величина поверхностного натяжения. При отсутствии гетерогенности поверхностное натяжение равно 0.
Отличие молекул на поверхности:
-
Обладают избыточной свободной энергией. Молекулы в этом слое находятся в несимметричном силовом поле. Молекулярные силы в поверхностном слое некомпенсированы, и поэтому молекулы на поверхности обладают избытком свободной энергии Fs . Мерой этого избытка является поверхностное натяжение , т.е. свободная поверхностная энергия, приходящаяся на 1см2 величины поверхности s. Fs =sмол. Избыток свободной энергии на поверхности делает систему термодинамически неравновесной. Поэтому все поверхностные процессы протекают самопроизвольно в сторону уменьшения F s , что достигается уменьшением sмол или
-
Находящиеся в объеме и на поверхности, по-разному ориентируются.
-
в кристаллических телах молекулы и атомы, находящиеся на поверхности, имеют иную электронную структуру по сравнению с молекулами и атомами, расположенными в объеме.
-
в случае многокомпонентных систем состав поверхностного слоя и объема различен вследствие адсорбции.
Дисперсность или раздробленность является количественным признаком объектов коллоидной химии. Применяются следующие количественные параметры раздробленности: размер частиц α, дисперсность Д, удельная поверхность sуд.
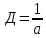
Для
пористых:
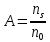
Диспергирование можно производить уменьшением одного, двух или трех измерений. В зависимости от этого образуются различные дисперсии: пленки, нити или частицы. Раздробленность определяется наименьшим базовым размером a.
Поверхностные явления возникают на любых поверхностях, независимо от их протяженности. Увеличение дисперсности приводит к увеличению роли поверхностных явлений в системе. Дисперсность или удельная поверхность является термодинамическим параметром состояния, изменение которого вызывает изменение других равновесных свойств.
Дисперсность характеризует количество поверхности, она является количественной характеристикой, указывающей на степень раздробленности, величину межфазной поверхности.
Удельная поверхность sуд - это отношение поверхности к объему или массе.
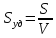
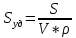

-
Классификация по размерам частиц дисперсной фазы
|
Система |
а, м |
|
Коллоидная (наноразмерная, ультрамикрогетерогенная), частицы видимы в электронный микроскоп и в атомный силовой микроскоп |
10-9-10-7 |
|
Микрогетерогенная, частицы видны в обычный микроскоп |
10-7-10-5 |
|
Грубодисперсная, частицы видны невооруженным глазом |
>10-5 |
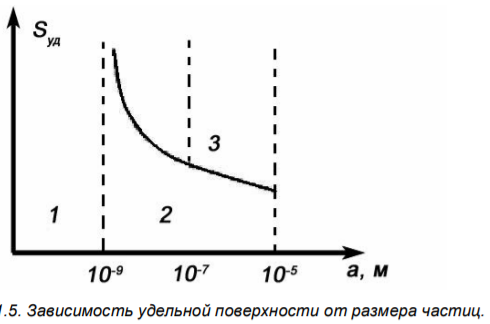
Аналитически эта зависимость выражается формулой гиперболы. На этом графике существуют три области: 1 - истинные растворы молекулярной степени дисперсности, 2 – высокодисперсные системы, за которыми укрепилось название «золи», 3 - микрогетерогенные и грубодисперсные системы. Эти системы представляют собой взвеси, которые со временем оседают и образуют структуры в осадке. Частицы видны в обычный микроскоп или даже невооруженным глазом. Крупные частицы отражают свет, системы обладают сильной мутностью.
-
Классификация по агрегатному состоянию
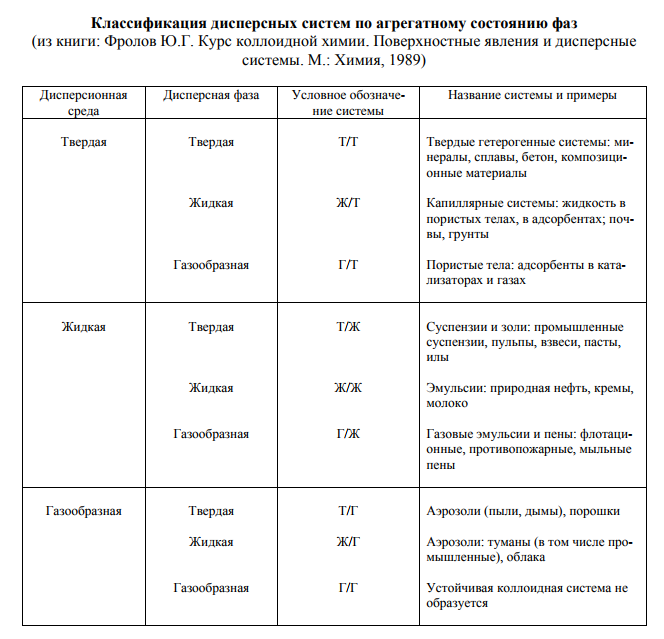
-
Классификация по взаимодействию

Межфазное натяжение σкр> σмф
-
Классификация по размерам частиц по взаимодействию дф

-
Причины отличия состояния поверхностного слоя
-
Первое отличие межфазного слоя от объемных фаз состоит в том, что удельная внутренняя энергия слоя отличается от внутренней энергии объемных фаз, т. к. в каждой фазе взаимодействуют молекулы одного сорта, а в поверхностном слое взаимодействуют разные молекулы.
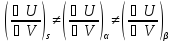
-
Взаимодействие молекул в поверхностном слое происходит в несимметричном силовом поле. Равнодействующая межмолекулярных сил, действующая на молекулу, находящуюся в поверхностном слое, не равна нулю. Поэтому молекулы стремятся уйти с поверхности в объем, и наоборот, при увеличении поверхности происходит вывод молекул из объема на поверхность, при этом затрачивается работа против межмолекулярных сил
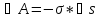 .
Эта работа равна увеличению свободной
поверхностной энергии Fs.
Таким образом, в поверхностном слое
происходит сгущение, увеличение
свободной поверхностной энергии
.
Эта работа равна увеличению свободной
поверхностной энергии Fs.
Таким образом, в поверхностном слое
происходит сгущение, увеличение
свободной поверхностной энергии
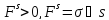 .
.
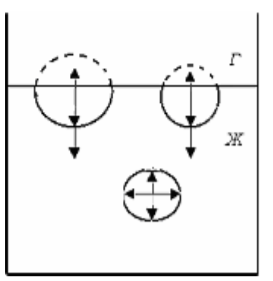
-
Состав поверхностного слоя отличается от состава объемных фаз. В поверхностном слое концентрируется компонент, уменьшающий избыток свободной поверхностной энергии.
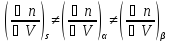
-
Значения удельной энтропии поверхностного слоя и объемных фаз различны