
экзамены 1 курс экологи / Вопросы к экзамену
.docxОбщая и неорганическая химия
1.
Химияw — это наука о веществах, их свойствах, строении и превращениях, происходящих в результате химических реакцийw, а также о законах, которым эти превращения подчиняются.




-
Вещество - форма материи определённого состава, состоящая из молекул, атомов, ионов.
-
Молекула - самая маленькая частица конкретного вещества, сохраняющая его химические свойства.
-
Атом - самая маленькая частица, которую невозможно химически разделить.
-
Ион - электрически заряженный атом (группа атомов).
-
химические реакции - это их способность при определенных условиях взаимодействовать с другими веществами, в результате чего могут появляться новые вещества.
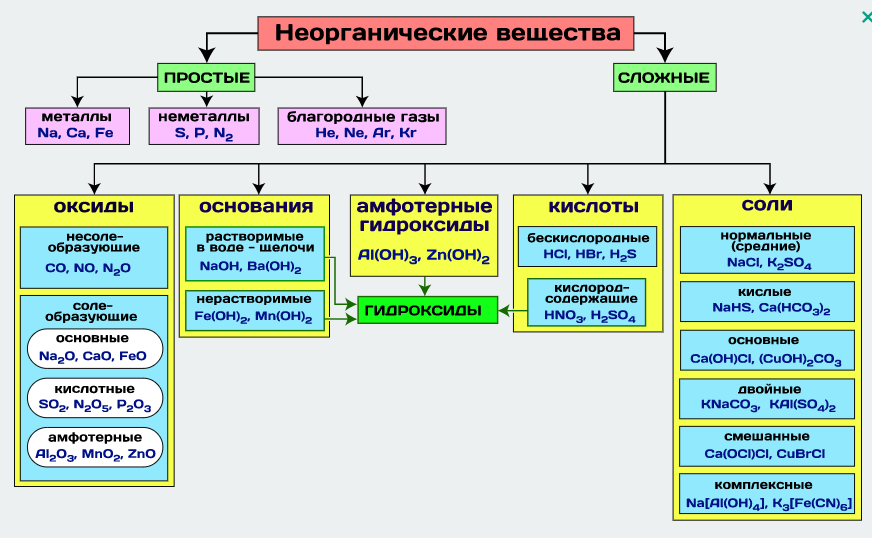
Просты́е вещества́ — химические вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул), в отличие от сложных веществ. ... Примерыпростых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Сложные вещества, состоящие из атомов разных элементов (H2O, NH3, OF2, H2SO4, MgCl2, K2SO4).
В настоящее время известно 115 химических элементов, которые образуют около 500 простых веществ.
Оксиды – сложные вещества, молекулы которых состоят из атомов кислорода и атомов какого – либо элемента (металла или неметалла). Примеры оксидов: SO3, CuO, H2O, Fe2O3, CO2.
Основания – сложные вещества, молекулы которых состоят из атомов металла и одной или нескольких гидроксильных групп (-ОН). Примеры оснований: КОН, Ca(OH)2, Al(OH)3, Fe(OH)2
Кислоты– сложные вещества, молекулы которых содержат атомы водорода, способные замещаться атомами металла с образованием соли. Молекулы всех кислот построены однотипно: они состоят из атомов водорода и кислотных остатков. Кислотные остатки – это атомы или группы атомов, которые остаются после полного или частичного замещения водорода в молекуле кислоты.
Соли – сложные вещества, молекулы которых всегда содержат атомы металла и атомы кислотного остатка. Соли можно рассматривать как продукт полного или частичного замещения атомов водорода в молекулах кислот атомами металлов, или гидроксильных групп в молекулах оснований на кислотные остатки. Примеры солей: Ca(HCO3)2, Mg3(PO4)2, FeCl2, K2CO3, CuOHCl.
Стехиометрические законы.
Стехиометрия – раздел химии, рассматривающий количественные соотношения между реагирующими веществами, вывод химических формул и составление уравнений химических реакций.
Закон постоянства состава. Молекулярное соединение имеет постоянный состав независимо от способа его получения. Пример: получение СО2.
Закон кратных отношений. Если два элемента образуют друг с другом несколько химических соединений, то количество одного элемента, приходящегося на одно и тоже количество другого элемента, относятся между собой, как небольшие целые числа. Например, в оксидах азота N2О, NО, N2О3, NО2, N2О5 количество кислорода.
Закон эквивалентов. Вещества взаимодействуют с друг другом в количествах, пропорциональных их эквивалентам.
Газовые законы.
Закон Авогадро: в равных объемах любых газов при одинаковых условиях (температуре и давлении) содержится равное число молекул. Следствия из него:
1. При одинаковых условиях 1 моль любого вещества занимает одинаковый объем.
2. При нормальных условиях (н.у.), т.е. давлении 101325 Па и температуре 273,15 К, 1 моль различных газов занимает объем 22,4 л (точнее 22,414 л). Такой объем называется молярным объемом (л/моль). По аналогии – эквивалентный объем (занимаемый 1 эквивалентом).
Закон
Гей-Люссака: при
постоянном давлении изменение объема
газа прямо пропорционально температуре ![]() .
.
Объединенный
газовый закон: ![]() ,
,
где P0, V0, T0 соответственно давление, объем и температура при нормальных условиях, а P, V, T – при других условиях.
Если
в выражение этого закона подставить
значения давления, объема и температуры
при н.у. (соответствующие 1 молю газа при
н.у., т.е. 22,4 л), то ![]() становится
постоянным для всех газов. Это соотношение
обозначается R называется
универсальной газовой постоянной. С
учетом R объединенный
газовый закон принимает вид
становится
постоянным для всех газов. Это соотношение
обозначается R называется
универсальной газовой постоянной. С
учетом R объединенный
газовый закон принимает вид ![]() .
Это – уравнение состояния идеального
газа или уравнение Клапейрона-Менделеева
(для 1 моля). Для любого количества газа
.
Это – уравнение состояния идеального
газа или уравнение Клапейрона-Менделеева
(для 1 моля). Для любого количества газа ![]() ,
где
,
где ![]() –
число молей.
–
число молей.
Закон парциальных давлений: общее давление смеси газов, химически не взаимодействующих один с другим, равно сумме парциальных давлений газов, составляющих смесь:
![]() ,
,
где P –
общее давление, а ![]() – парциальные
давление газов 1,2,3 …
– парциальные
давление газов 1,2,3 …
Парциальное давление газа в смеси – давление, которое производило бы это же количество газа, если бы он занимал при этой же температуре весь объем, занимаемый смесью газов.
Постоянная Авогадро – величина, характеризующая число частиц любого вещества в количестве 1 моль: Na = 6, 02 1023 1/моль - отношение числа частиц вещества (N) и количеству вещества (n) : Na = N/ n . Моль – основная единица количества вещества в химии. 1моль содержит 6. 02 1023 молекул, атомов, ионов, электронов.
2.
3.
4.
5.
6.
7.
8.
Аналитическая химия
