
- •По классам аминоацил-тРнк-синтетаз Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- •Стереохимия аминокислот
- •Конфигурации пептидной связи
- •8. Белки. Классификация белков. Функции белков.
- •9. Методы выделения и очистки белков: диализ, ультрафильтрация, центрифугирование, гель-хроматография, электрофорез, ионная, аффинная и гидрофобная хроматографии.
- •10. Получение генноинженерных белков.
- •11. Первичная структура белка. Этапы установления первичной структуры белка. Аминокислотный состав. Определение n- и с-концевых аминокислот.
1.Аминокисло́ты (АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
|
Глицин |
Gly |
G |
Glycine |
|
Аланин |
Ala |
A |
Alanine |
|
Валин |
Val |
V |
Valine |
|
Изолейцин |
Ile |
I |
Isoleucine |
|
Лейцин |
Leu |
L |
Leucine |
|
Пролин |
Pro |
P |
Proline |
|
Серин |
Ser |
S |
Serine |
|
Треонин |
Thr |
T |
Threonine |
|
Цистеин |
Cys |
C |
Cysteine |
|
Метионин |
Met |
M |
Methionine |
|
Аспарагиновая кислота |
Asp |
D |
asparDic acid |
|
Аспарагин |
Asn |
N |
asparagiNe |
|
Глутаминовая кислота |
Glu |
E |
gluEtamic acid |
|
Глутамин |
Gln |
Q |
Q-tamine |
|
Лизин |
Lys |
K |
before L |
|
Аргинин |
Arg |
R |
aRginine |
|
Гистидин |
His |
H |
Histidine |
|
Фенилаланин |
Phe |
F |
Fenylalanine |
|
Тирозин |
Tyr |
Y |
tYrosine |
|
Триптофан |
Trp |
W |
tWo rings |
Классификация
По радикалу:
-
Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
-
Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
-
Ароматические: фенилаланин, триптофан, тирозин
-
Полярные заряженные отрицательно при pH=7: аспартат, глутамат
-
Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[5]
По функциональным группам
-
Алифатические
-
Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
-
Оксимоноаминокарбоновые: серин, треонин
-
Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
-
Амиды моноаминодикарбоновых: аспарагин, глутамин
-
Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
-
Серосодержащие: цистеин, метионин
-
-
Ароматические: фенилаланин, тирозин, триптофан,
-
Гетероциклические: триптофан, гистидин, пролин
-
Иминокислоты: пролин
По классам аминоацил-тРнк-синтетаз Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Стереохимия аминокислот


Большинство аминокислот содержит асимметрический атом углерода (у α-аминокислот это α-углеродный атом) и может существовать в виде оптических изомеров:

При установлений конфигурации аминокислот их принято сравнивать с L- и D-молочными кислотами, конфигурации которых установлены по L- и D-глицериновым альдегидам.
В природе встречаются только оптически активные аминокислоты, причем подавляющее большинство их относится к L-ряду. D-Формы аминокислот сравнительно редки (они входят в состав некоторых антибиотиков).
Интересно отметить физиологическое отличие аминокислот D- и L-рядов. При реакциях, происходящих в организме под действием ферментов, превращениям, как правило, подвергаются L-аминокислоты и их производные (гидролиз ацилированных аминокислот, эфиров, пептидов). Обратные примеры встречаются значительно реже (одним из примеров может служить избирательное окисление D-аминокислот в кетокислоты под влиянием фермента, содержащегося в почках млекопитающих).
2. Рацемизация аминокислот, механизмы рацемизации (под действием оснований, кислот и по оксазолоновому механизму). Методы разделения рацематов аминокислот (механическое разделение, химические, ферментативные и хроматографические методы).


|
|
Разделение рацематов аминокислот
В настоящее время разделение рацематов аминокислот осуществляют в промышленном масштабе. При этом особое значение имеют хроматографическое разделение на носителях с хиральными группами, методы селективной кристаллизации и ферментативные разделения с помощью фиксированных на носителях ферментов. Для того чтобы рацемат полностью перевести в L-ИЛИD-форму,второй антипод, полученный при разделении рацемата,рацемизацией снова переводится вDL-аминокислоту,которая опять подвергается разделению на оптические антиподы, Рацемизацию проводят ферментативно с помощью специфических рацемаз или действием уксусного ангидрида, а в случае свободных аминокислот и их солей — нагреванием до 200 — 250 °С водных растворов под давлением.
Кристаллографический. В 1848 году Л.Пастер обнаружил, что из водных растворов натриево - аммониевой соли виноградной кислоты (рацемат (+)- и (-) -винных кислот) при определенных условиях выпадают кристаллы двух типов, отличающиеся друг от друга как предмет и его зеркальное отображение. Пастер разделил эти кристаллы механическим путем и получил в чистом виде соли (+) винной кислоты и (-) винной кислоты. Этот метод получил название метода Пастера. Однако этот метод удается применить не всегда. В настоящее время известно около 300 пар энантиомеров, способных к такой кристаллизации
2.Биохимический метод. Этот метод основан на высокой избирательности работы фермента. Ферменты, имеющиеся в живых организмах, способны катализировать превращения стереоизомера лишь с одной, вполне определенной конфигурацией хирального центра (обычно того, который встречается в природе). Рассмотрим использование этого метода для разделения рацемата аминокислоты. В начале на рацемат действуют ацилирующим агентом ( например, вводят ацетильную группу). При этом получают рацемат, состоящий из N -ацетильных производных (+) - и (-)- аминокислоты. Затем ацетильные производные подвергают ферментативному гидролизу в присутствии фермента ацилазы. Производные природной кислоты гидролизуются под действием фермента. В результате получают смесь природной аминокислоты и N-ацетильное производное другого энантиомера. Эту смесь легко разделить. Так, свободная аминокислота растворяется в разбавленных кислотах, в то
время как N-ацетильное производное - не растворяется.

1. ацетилирование
2. гидролиз в присутствии фермента ацилизы.
L(-)-метионин N-ацетил (+)-метионин
3.Химический способ. Сущность метода заключается в получении из пары энантиомеров диастереомеров, разделение которых основано на различии их свойств.Но и этот метод требует использования природного оптически активного вещества.


3. Физико-химические свойства аминокислот. Кислотно-основные свойства, изоэлектрическая точка. Химические свойства: реакции аминокислот по аминогруппе, по карбоксильной группе, с одновременным участием амино- и карбоксильной групп.
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.



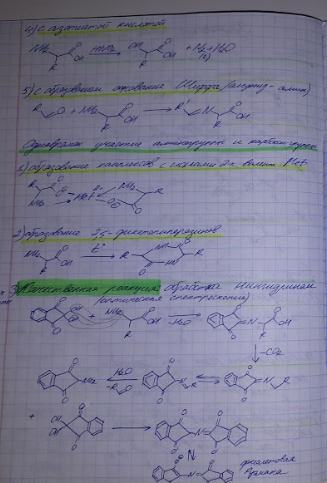
4. Методы получения аминокислот: химический синтез, ферментативные методы, микробиологические методы, выделение из белковых гидролизатов.



5. Пептиды. Строение, номенклатура, классификация. Конфигурация пептидной связи.
Пепти́ды — семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—. Обычно подразумеваются пептиды, состоящие из α-аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.

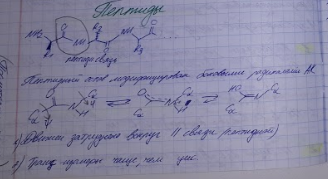

Строение пептидной связи

Пептидная (амидная) связь — это вид химической связи, которая возникает вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты. Амидная связь очень прочная, и в нормальных клеточных условиях (37 °C, нейтральный pH) самопроизвольно не разрывается. Пептидная связь разрушается при действии на неё специальных протеолитических ферментов (протеаз, пептидгидролаз).
. И в соответствии с их количеством различают:
-
олигопептиды — молекулы, содержащие до десяти аминокислотных остатков; иногда в их названии упоминается количество входящих в их состав аминокислот, например, дипептид, трипептид, пентапептид и др.;
-
полипептиды — молекулы, в состав которых входит более десяти аминокислот...
Соединения, содержащие более ста аминокислотных остатков, обычно называются белками. Однако это деление условно, некоторые молекулы, например, гормон глюкагон, содержащий лишь двадцать девять аминокислот, называют белковым гормоном. По качественному составу различают:
-
гомомерные пептиды — соединения, состоящие только из аминокислотных остатков;
-
гетеромерные пептиды — вещества, в состав которых входят также небелковые компоненты.
Пептиды также делятся по способу связи аминокислот между собой:
-
гомодетные — пептиды, аминокислотные остатки которых соединены только пептидными связями;
-
гетеродетные пептиды — те соединения, в которых помимо пептидных связей встречаются ещё и дисульфидные, эфирные и тиоэфирные связи.
Цепочка повторяющихся атомов называется пептидным остовом: (—NH—CH—OC—). Участок (—CH—) с аминокислотным радикалом образует соединение (—NH—C(R1)H—OC—), называемое аминокислотным остатком. N-концевой аминокислотный остаток имеет свободную α-аминогруппу (—NH), в то время как у C-концевого аминокислотного остатка свободной является α-карбоксильная группа (OC—). Пептиды различаются не только по аминокислотному составу, но и по количеству, а также расположению и соединению аминокислотных остатков в полипептидную цепочку. Пример: Про-Сер-Про-Ала-Гис и Гис-Ала-Про-Сер-Про Несмотря на одинаковый количественный и качественный состав, эти пептиды имеют совершенно разные свойства.
