ОХТ шпора 2019
.docx|
Химическая технология – это естеств прикладная наука о способах и процессах производства продуктов, осущ-мых с участием хим превращений, технически, экономически и социально целесообразным путём. Объект исследования – хим производство (ХП) (способы и процессы переработки исх в-в в полезн продукты). Цель исследования – созд-е целесообразных способов пр-ва необх продуктов. Методы исследования: экспер-ный, моделирование и системн анализ. Определение, состав и иерархическая структура ХП. ХП – это совокупность пр-сов переработки сырья в нужн прод-ты с исп-ем хим превращ-й, осущ-мых в предназнач-ых для этого машинах и аппаратах. ХТ пр-с – послед-ть хим и фх пр-сов целенапр-ой переработки исх в-в в продукт.
Компоненты ХП: Переменные (постоянно потребл-ся или об-ся в производстве): сырьё, вспомогат материалы, продукты (основной и доп), отходы, энергия. Постоянные: аппаратура, строит конструкции (здания, сооруж-я), устр-ва контроля и управления, обслуживающий персонал. Показатели
химического производства. Технические
(опр-ют
кач-во ХТП). Производительность:
|
Хим реактор – устр-во для провед-я хим р-й. Классификация: 1. По гидродин Обстановке (РИС и РИВ; .); 2. По усл-ям теплообмена (протек-ие в р-рах р-и сопров-ся тепл эф-ми (выдел-е или погл-е теплоты)разность темп-р м/у р-ром и окр средой. Разность темп-р – дв сила теплообмена. Нет теплообмена с окр средой адиабатическ р-р, т е вся теплота расход-ся на «внутр» теплообмен и на нагрев или охл-е реакц смеси. Изотерм р-ры: для сохранения T=const необходимо подводить или отводить тепло в соотв-и с тепл эф-том р-и. Редко исп-ся в крупномасштабн пр-вах; высок стоимость оборуд-я или неэкономично. Политропические. Автотермические: поддерж-е необх Т пр-са - за счет теплоты хим пр-са без исп-я внешних источников энергии.); 3. По способу организации пр-са (по способу подвода реагентов и отвода продуктов) (Периодические: все отдельн стадии протек последовательно, в разное время, м/у реакц циклами – вспомогат операции: загрузка реагентов и выгрузка пр-тов. Непрерывнод-ий: все отд стадии пр-са (подача реаг в-в, р-я, вывод пр-та) одновременно. Полунепрерывный (полупериодический): один из реагентов поступает непрерывно, а другой - периодически.) 4. По хар-ру изм-я параметров пр-са во вр. (Стац и нестац режимы. Стац р-м - если протек-е хим р-и в произвольно выбр точке хар-ся одинак знач-ми конц-й реагентов или продуктов, Т, скорости и других параметров пр-са в любой момент вр, т.е пар-ры потока на выходе из р-ра не зав от вр. Обычно это постоянство вых параметров обеспечивается постоянством во времени параметров на входе в реактор. Если есть изм-я во вр по какому-то з-ну нестац (это все периодич пр-сы).
Общ
вид мат модели:
Основн матем модели:
РИВ
и РИС (см.
выше).
Мат опис-е изотерм и неизотерм пр-сов
в реакторах.
Сравнение РИВ и РИС при осуществлении в них прост и сложн р-й в изо- и неизотерм режиме.
|
Каскад РИС. Аналитический и графический методы расчета К-ИС. Каскад – это совокупность р-ров, соед-ых м/у собой разл связями.
Термодин законом-ти. Конст равновесия и равновесн степень превр-я. Способы управл-я равновесием хим р-й (Т, Р, избыток реагента и т.д.), примеры. Хим
равновесие, при ктр ск-ти прям и обр
р-и =, опр-ся вып-ем усл-я:
В
равн-и достиг-ся равновесн ст-нь
превр-я:
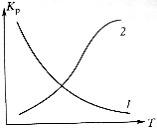
Влияние изменения внешних условий на положение равновесия - принцип смещения равновесия, или принцип Ле – Шателье: если на систему, находящуюся в устойчивом равновесии, оказать внешнее воздействие, то система отреагирует на это воздействие так чтобы уменьшить его. Влияние давления. Характер влияния давления на равновесие химических реакций определяется знаком разности числа молей газообразных участников реакции или знаком изменения объема. Для газовых реакций, в которых число молей продуктов превышает число молей реагентов, т. е. , увеличение давления неблагоприятно. Смещению равновесия реакции вправо способствует снижение давления. Если же реакция протекает с уменьшением числа молей (), повышение давления целесообразно — оно смещает равновесие реакции в сторону образования продуктов.Влияние инертного газа. Введение инертного газа в систему при р =const подобно эффекту уменьшения общего давления. Если реакция протекает с уменьшением числа молей , разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов; при увеличении числа молейравновесие смещается вправо. Поэтому в технологических процессах, сопровождаемых химическими реакциями, для которых, стремятся к уменьшению накопления инертных газов в системе.Влияние концентрации. В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево. Увеличивая концентрацию одного из реагентов (создавая его избыток), можно повысить степень превращения другого. Этим широко пользуются в химической технологии, добиваясь полного превращения дорогостоящего компонента сырья. Во многих случаях смещение равновесия процесса вправо можно осуществить и выводом продуктов из реакционной зоны — уменьшением концентрации продукта.Влияние температуры. Направление смещения равновесия при изменении температуры зависит от знака теплового эффекта реакции. Повышение температуры всегда благоприятствует накоплению веществ, образующихся в данной реакции с поглощением теплоты, т. е усиливает эндотермическое направление процесса. Понижение температуры действует в противоположную сторону, т. е. усиливает экзотермическое направление.Следует отметить, что при изменении температуры равновесие смещается тем сильнее, чем большим тепловым эффектом сопровождается та или иная химическая реакция.
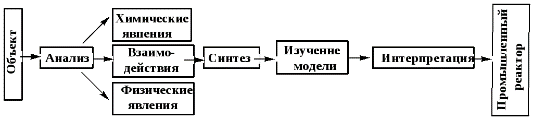
Кинетич закономерности. Понятия ск-ти р-и и ск-ти превр-я в-ва для простой и сложной р-и. Кинетич ур-е, порядок р-и. Схема превр-я и её отличие от базисной системы линейно независимых уравнений химических реакций. Скорость
превр-я в-ва
Схема превр-я показывает реальные взаимод-я м/у компонентами – пути превр-я – в реаг-щей системе. Схема превр-я состоит из частных р-й, илиэтапов. В отличие от стехиом, кинетические ур-я не м.б. записаны произвольно, и ихчисло должно соотв реальным путям превр-я комп-тов. Схема превр-я необходима в предсказании и объяснении динамич изм-я содерж-я в-в в реагирующей системе по мере протекания в ней хим превр-й. |
|||||||
|
Стехиом соотн-я. Назнач-е. Стехиом ур-я, расчёт кол-в реаг-щих в-в. Прост и сложн р-я. Базисн система линейно независ ур-й хим р-й, назнач-е, примеры. Расчет показ-лей: ст-нь превращ-я, селективность, выход продукта. Стехим
ур-я показ-ют, в каких соотн-ях в-ва
вступ в хим взаимод-е. Исп-ся для расчёта
состава рег смеси после хим превращ-я,
т.е для расчёта
мат баланса реакционных пр-сов.
Пр р-я опис-ся 1 стех ур-ем (e.g. SO2+0,5O2=SO3) Сл р-я – несколькими (2CH3OH+O2=2CH2O+2H2O; 2CH3OH+3O2=2CO2+4H2O – ок-е MeOH).Это по кол-ву напр-й, но если по мех-му, то ок-е SO2 – сложн р-я (многостад). Число ур-й д.б. = числу неизвестных. У= В–(Э-1) (для обменных р-й); У = В–Э (для ОВ р-й), где У – кол-во ур-й, необх для опр-я состава прореагировавшей смеси, В – исх и конечн в-ва, Э – хим элем-ты, из ктр сост в-ва или устойчивые в
Пример:
Далее сделаем сделаем 1-ые эл-ты всех строк, кроме 1-ой, нулевыми: вычитаем из нужн строки 1-ую строку(в). Повторим то же самое, с частью матрицы (в), выдел-ой пунктиром: сделаем 1-ые эл-ты единичными(г), затем 2-ой эл-т 3-ей строки нулевым(д). 3-я строка стала нулевой3-е ур-е стехиом зависимое.
Степень превр-я – отн-е кол-ва превратившегося в-ва к его первонач кол-ву:
|


 ,
где G
– кол-во получ-мого прод-та или
перерабат-ого сырья. Расходн.
коэф-т:
кол-во затрач-ого сырья, материалов
или энергии на пр-во ед-цы пр-та. Выход
продукта:
отношение реально получ кол-ва пр-та
из исп-ого сырья к max
теор кол-ву. Интенсивность
пр-са:
кол-во сырья или пр-та в ед-це объёма
аппарата в ед-цу вр. Удельн
капитальн затраты:
затраты на оборуд-е к ед-це его П. Кач-во
пр-та.
Экономические
(опр-ют экономич эф-ть пр-ва).
Себестоимость
пр-та:
,
где G
– кол-во получ-мого прод-та или
перерабат-ого сырья. Расходн.
коэф-т:
кол-во затрач-ого сырья, материалов
или энергии на пр-во ед-цы пр-та. Выход
продукта:
отношение реально получ кол-ва пр-та
из исп-ого сырья к max
теор кол-ву. Интенсивность
пр-са:
кол-во сырья или пр-та в ед-це объёма
аппарата в ед-цу вр. Удельн
капитальн затраты:
затраты на оборуд-е к ед-це его П. Кач-во
пр-та.
Экономические
(опр-ют экономич эф-ть пр-ва).
Себестоимость
пр-та:
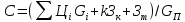 ,
где
,
где
 – цена и кол-во израсх сырья, эн-и,
материалов на пр-во пр-та в кол-ве
– цена и кол-во израсх сырья, эн-и,
материалов на пр-во пр-та в кол-ве
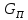 ,
,
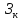 – капитальн затраты,
– капитальн затраты,
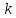 – коэф-т окупаемости кап затрат.
Прозв-ть
труда:
кол-во прод-ции, произв-ой в ед-цу вр
на 1 рабочего.
Эксплуатац (опр-ют
влияние отклонений от регламент.
усл-й, возник-их при работе пр-ва, на
показатели пр-са, возм-ть упр-я им).
Надёжность.
Безопасность функц-я. Чувствительность
к
наруш-ям режима и изм-ю усл-й эксплуатации.
Управляемость
и регулируемость.
Соц
(опр-ют
комфортность работы на дан пр-ве и
влияние на окр среду).
Безвредность
обслуж-я. Степень автоматизации и
механизации. Экологич. безопасность.
– коэф-т окупаемости кап затрат.
Прозв-ть
труда:
кол-во прод-ции, произв-ой в ед-цу вр
на 1 рабочего.
Эксплуатац (опр-ют
влияние отклонений от регламент.
усл-й, возник-их при работе пр-ва, на
показатели пр-са, возм-ть упр-я им).
Надёжность.
Безопасность функц-я. Чувствительность
к
наруш-ям режима и изм-ю усл-й эксплуатации.
Управляемость
и регулируемость.
Соц
(опр-ют
комфортность работы на дан пр-ве и
влияние на окр среду).
Безвредность
обслуж-я. Степень автоматизации и
механизации. Экологич. безопасность.
 ;
;
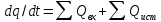 ,
где
,
где
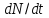 ,
,
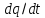 – накопл-е в-ва и теплоты в выделенном
элементарн объёме,
– накопл-е в-ва и теплоты в выделенном
элементарн объёме,
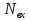 ,
,
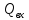 – матер и тепл потоки, вх-щие в этот
объём,
– матер и тепл потоки, вх-щие в этот
объём,
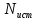 ,
,
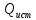 – источники в-ва и теплоты внутри
этого объёма.
– источники в-ва и теплоты внутри
этого объёма.
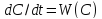 ,
(W
– ск-ть превр-я)
,
(W
– ск-ть превр-я)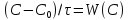 ,
,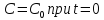
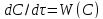
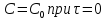







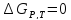 .
.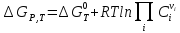 – эн-я
Гиббса зависит от состава реакц смеси.
При хим равн-и:
– эн-я
Гиббса зависит от состава реакц смеси.
При хим равн-и:
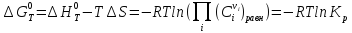 .
.
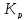 зависит только
от температуры.
зависит только
от температуры.
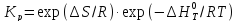 (для идеал смесей);
(для идеал смесей);
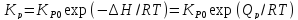 (для
реальн смесей). (
(для
реальн смесей). ( ).
).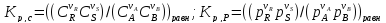 .
В случае, когда надо учесть взаимодействия
молекул, вместо конц-й исп активности,
а вместо парц давл-й – летучести. В
сл-е гетероген
.
В случае, когда надо учесть взаимодействия
молекул, вместо конц-й исп активности,
а вместо парц давл-й – летучести. В
сл-е гетероген
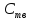 +H2O.
+H2O.
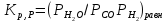 .
.
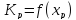 .
Определив
.
Определив
 ,
находят равнов конц-и.
,
находят равнов конц-и.
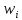 опр-ся кол-вом в-ва, превратившегося
в ед-цу вр в ед-це реакц пространства
(обычно объём). Ск-ть р-и:
опр-ся кол-вом в-ва, превратившегося
в ед-цу вр в ед-це реакц пространства
(обычно объём). Ск-ть р-и:
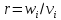 ,
,
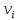 – стех коэф-т. Если р-я сложн и в-во
уч-ет в неск частных р-ях:
– стех коэф-т. Если р-я сложн и в-во
уч-ет в неск частных р-ях:
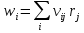 ,
,
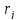 – ск-ть j-ой
р-и.
– ск-ть j-ой
р-и.




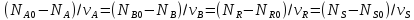 ,
где
,
где
 – исх кол-во, N
– кол-во после превращ-я.
– исх кол-во, N
– кол-во после превращ-я.
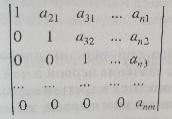
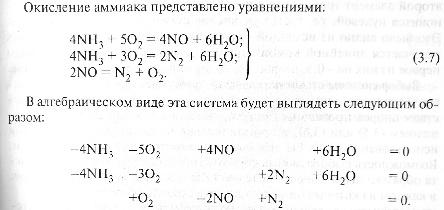

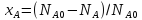 .
Селективность
показ, какая доля превратившегося исх
в-ва расход-ся на обр-е продукта:
.
Селективность
показ, какая доля превратившегося исх
в-ва расход-ся на обр-е продукта:
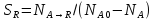 .
Выход
продукта
показ долю всего в-ва, приходящуюся
на обр-е продукта:
.
Выход
продукта
показ долю всего в-ва, приходящуюся
на обр-е продукта:
 .
.