
1. Лекции Термодинамика (УЭИ)
.pdf
0
Краткий курс лекций по теплотехнике
Часть I
ТЕХНИЧЕСКАЯ
ТЕРМОДИНАМИКА
Академия Платона. Мозаика из Помпей. Начало I в. до н. э.
Уфа
2016
1
Министерство образования и науки Российской Федерации
Федеральное государственное образовательное учреждение высшего образования
«УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
И.В.НОВОСЕЛОВ, Р.А.МОЛЧАНОВА, Г.Д. ТЕЛЯШЕВА
Краткий курс лекций по теплотехнике
Часть I. ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Уфа
2016
2
УДК 621.43.16 ББК 31.31
Н 76
Утверждено Редакционно-издательским советом УГНТУ в качестве учебного пособия
Рецензент:
Главный энергетик ОАО «Уралтранснефтепродукт» А.В. Зайниев
И.В. Новоселов, Р.А. Молчанова, Г.Д. Теляшева
Н76 Краткий курс лекций по теплотехнике. Ч.I. Техническая термодинамика.- И.В. Новоселов, Р.А. Молчанова, Г.Д. Теляшева. – Уфа: РИЦ УГНТУ,
2016.– 154 с. ISBN978-5-7831-1143-3(Ч.I) ISBN978-5-7831-1190-7
Составлен в соответствии с утвержденной программой дисциплины «Термодинамика и теплопередача» по направлению «Нефтегазовое дело». Изложена теория технической термодинамики, приведен перечень рекомендуемой литературы по каждому разделу, даны вопросы для самопроверки.
Предназначен для студентов неэнергетических специальностей УГНТУ очного и заочного отделения для выполнения курсовой работы, расчетнографических работ, решения практических задач, изучения вопросов, вынесенных на самостоятельную проработку.
|
УДК 621.43.016 |
|
ББК 31.31 |
ISBN978-5-7831-1143-3(Ч.I) |
© Уфимский государственный |
ISBN978-5-7831-1190-7 |
нефтяной технический |
|
университет, 2016 |
|
© Новоселов И.В, Молчанова Р. А., |
|
Теляшева Г. Д. 2016 |
|
|
3 |
|
|
|
СОДЕРЖАНИЕ |
|
|
|
|
с |
1 |
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ………………………….. |
6 |
|
|
1.1 |
Основные определения ……………………………………………… |
6 |
|
1.2 |
Основные термодинамические параметры состояния……………… |
7 |
2 |
ИДЕАЛЬНЫЕ ГАЗЫ……………………………………………………… |
11 |
|
|
2.1 |
Законы идеальных газов……………………………………………… |
11 |
2.2Уравнение состояния идеального газа………………………………. 12
2.3Смеси идеальных газов………………………………………………. 14
2.3.1 Закон Дальтона……………………………………………………… |
14 |
2.3.2 Способы задания газовых смесей…………………………………. |
15 |
2.3.3 Основные расчетные формулы для смесей газов………………… |
16 |
3 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ………………………………… |
20 |
3.1Понятия теплоты и работы……………………………………………. 20
3.2Работа газа……………………………………………………………… 21 3.2.1 Работа расширения………………………………………………….. 22
3.2.2 Работа потока………………………………………………………… 24
3.3Внутренняя энергия. Энтальпия……………………………………… 25
3.3.1 Внутренняя энергия………………………………………………….. 25 3.3.2 Энтальпия……………………………………………………………. 27
3.4Формулировки первого закона термодинамики…………………….. 28
3.5Аналитическое выражение первого закона термодинамики……….. 28
3.6 Теплоемкость газов…………………………………………………… 30
3.6.1Виды теплоемкостей………………………………………………… 30
3.6.2Теплоемкости при 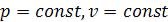 …………………………… 29
…………………………… 29
3.6.3Элементы молекулярно-кинетической теории теплоемкости……. 31
4ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ…………………………………. 38
4.1Формулировки второго начала термодинамики…………………….. 38
4.2Энтропия……………………………………………………………….. 43
4.3Цикл Карно……………………………………………………………. 47
4.3.1 Прямой цикл Карно………………………………………………… |
47 |
4.3.2 Обратный цикл Карно……………………………………………… |
49 |
4.4Обратимые и необратимые процессы……………………………….. 51
4.5Аналитическое выражение второго закона термодинамики………. 51 4.5.1 Аналитическое выражение в интегральной форме……………….. 51
4.5.2 Аналитическое выражение в дифференциальной форме………… |
54 |
|
4.6 |
Эксергия……………………………………………………………….. |
56 |
4.6.1 Расчетные формулы………………………………………………… |
56 |
|
4.6.2 Эксергетический анализ……………………………………………. |
58 |
|
5 ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ С ИДЕАЛЬНЫМИ ГАЗАМИ |
61 |
|
5.1 |
Исследования термодинамических процессов……………………… |
61 |
5.2 |
Частные термодинамические процессы……………………………… |
63 |
5.2.1 Изохорный процесс………………………………………………… |
63 |
|
4 |
|
5.2.2 Изобарный процесс………………………………………………… |
65 |
5.2.3 Изотермический процесс…………………………………………… |
67 |
5.2.4 Адиабатный процесс………………………………………………… |
70 |
5.3 Политропные процессы………………………………………………. |
75 |
6РЕАЛЬНЫЕ ГАЗЫ……………………………………………………….. 84
6.1Свойства реальных газов…………………………………………….. 84
6.2Коэффициент сжимаемости…………………………………………. 84
6.3Уравнение Ван-дер-Ваальса…………………………………………. 86
6.4 Водяной пар…………………………………………………………… 93
6.4.1Изобарный процесс получения водяного пара……………………. 93
6.4.2Определение параметров воды и водяного пара………………….. 97
6.4.3 Основные термодинамические процессы водяного пара………… |
10 |
6.5 Влажный воздух……………………………………………………….. |
103 |
6.5.1Основные характеристики влажного воздуха…………………….. 103
6.5.2Диаграмма состояний влажного воздуха………………………….. 106 7 ТЕРМОДИНАМИКА ПОТОКА ГАЗОВ И ПАРОВ……………………. 112 7.1 Уравнение первого закона термодинамики для потока……………. 112
7.2 Истечение газов и паров……………………………………………… |
116 |
7.2.1 Адиабатное истечение идеального газа через сопло……………... |
118 |
7.2.2 Форма каналов сопл и диффузоров………………………………… |
122 |
7.2.3 Комбинированное сопло Лаваля…………………………………… |
125 |
7.2.4 Истечение газов с учетом трения…………………………………… |
8 |
7.2.5 Истечение водяного пара…………………………………………… |
129 |
7.3 Дросселирование газов и паров……………………………………… |
130 |
8СЖАТИЕ ГАЗОВ И ПАРОВ…………………………………………….. 137
8.1Классификация и типы компрессоров………………………………. 137
8.2Термодинамический анализ работы компрессора…………………... 143
8.3Многоступенчатое сжатие…………………………………………….. 148
8.4Работа действительного компрессора……………………………….. 150
8.4.1 Изотермический и адиабатный КПД компрессора……………… |
150 |
8.4.2 Индикаторная диаграмма поршневого компрессора……………… |
151 |
8.5 Сжатие реальных газов и паров……………………………………… |
153 |
5
ВВЕДЕНИЕ
Термодинамика – наука о закономерностях превращения энергии. Основы термодинамики были заложены в XIX в., когда в связи с развити-
ем тепловых двигателей возникла необходимость изучения закономерностей превращения теплоты в работу.
Принцип построения термодинамики прост. В основу термодинамики заложены два основных закона (или «начала»), установленные опытным путем. Первый закон термодинамики характеризует количественную сторону процессов превращения энергии, а второй закон устанавливает качественную сторону (направленность) процессов, происходящих в физических системах. Используя только эти два закона, методом строгой дедукции можно получить все основные выводы термодинамики.
Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к термодинамическим процессам.
Второй закон установлен опытным путем, при наблюдении превращений энергии в макросистемах.
Для термодинамики характерен феноменологический подход, т.е. рассматривается явление (феномен) в целом без уточнения структуры вещества на микроуровне. Это означает, что в термодинамике рассматриваются большие системы.
Эти системы описываются переменными двух типов:
•интенсивными, не зависящими от величины системы, такими как давление или температура,
•экстенсивными, пропорциональными числу частиц, такими как внутренняя и полная энергия.
Всоставе общеобразовательной дисциплины «Теплотехника» изучается техническая термодинамика, в которой излагается небольшая часть вопросов, касающихся термодинамики равновесных процессов.
Техническая термодинамика рассматривает закономерности взаимного превращения теплоты в работу. Она устанавливает взаимосвязь между тепловыми, механическими и химическими процессами, которые совершаются в тепловых и холодильных машинах, изучает процессы, происходящие в газах и парах, а также свойства этих тел при различных физических условиях.
Вместе с теорией теплообмена техническая термодинамика является теоретическим фундаментом теплотехники. На ее основе осуществляют расчет и проектирование всех тепловых двигателей, а также всевозможного технологического оборудования.
6
1 ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
1.1 Основные определения
Термодинамической системой называется совокупность материальных тел, находящихся в энергетическом взаимодействии.
Тела, не входящие в состав термодинамической системы называются окружающей (внешней) средой. Систему отделяют от окружающей среды
контрольной поверхностью (оболочкой).
Энергетическое взаимодействие термодинамической системы с окружающей средой осуществляется через контрольные поверхности.
В зависимости от способа взаимодействия с окружающей средой различают следующие виды термодинамических систем:
•Если термодинамическая система не имеет никаких взаимодействий с окружающей средой, то её называют изолированной (замкнутой).
•Система, не имеющая теплообмена с окружающей средой, называется
адиабатной.
•Система, у которой отсутствует массообмен с окружающей средой (перенос вещества через контрольную поверхность), называется за-
крытой.
•Если у системы имеется массообмен с окружающей средой, то такая система называется открытой.
Система, имеющая во всех своих частях одинаковый состав и физические свойства, называется физически однородной.
Определенное сочетание свойств термодинамической системы назы-
вается состоянием системы.
Параметр состояния системы - это такой её показатель, изменение которого приводит к изменению состояния системы.
Равновесным состоянием системы называется такое состояние, при котором все параметры системы имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго.
Совокупность изменений состояния термодинамической системы при переходе из одного состояния в другое называется термодинамиче-
ским процессом.
Процесс, состоящий из непрерывной последовательности равновес-
ных состояний, называется равновесным. Равновесным может быть только бесконечно медленный процесс, поэтому равновесный процесс является абстракцией. Все реальные процессы являются неравновесными.

7
Неравновесным называют процесс, при протекании которого система не находится в состоянии равновесия (т. е. при протекании процесса раз-
личные части системы имеют различные значения температуры, давления, плотности, концентрации и т. д.).
1.2 Основные термодинамические параметры состояния
При отсутствии силовых полей (гравитационного, электромагнитного и др.) состояние однородной системы может быть однозначно определено тремя параметрами, в качестве которых в технической термодинамике принимают объем, абсолютную температуру и давление. Эти три параметра называются
основными.
Объем V
Объём - количественная характеристика пространства, занимаемого телом или веществом.
Единицей измерения в системе СИ является кубический метр: 1 м3. Из внесистемных единиц наиболее часто используется литр:
1 л = 10 -3 м3.
Давление p
Давление с точки зрения молекулярно-кинетической теории - это средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенки сосуда с газом и представляет собой отношение нормальной составляющей силы к поверхности, на которую действует сила:
, |
(1.1) |
где F - нормальная составляющая силы;
S - площадь поверхности, на которую действует эта сила.
В системе СИ единицей измерения давления является Паскаль.
1 Па = 1 Н/м 2
Из внесистемных единиц чаще всего используются следующие:
1). Бар, 1бар = 105 Па;
2). Физическая атмосфера (атм.) – представляет собой давление, оказываемое столбом ртути высотой 760мм на высоте уровня моря при температуре 0оС. Учитывая, что нормальное значение ускорения свободного падения равно 9,80665 м/с2, а плотность ртути при 0оС – 13,595г/см3, легко рассчитать:
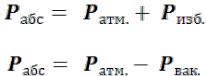
8
1 атм. = 760 мм рт. ст. = 101325 Па;
3). Техническая атмосфера (ат.) – давление, которое оказывает вес тела массой 1 кг, действуя на площадь в 1см2,
1ат. = 1 кГ/см2 = 1кгс/см2 = 98066,5 Па;
4). Давление также измеряют в миллиметрах ртутного и водного столбов,
т.е. приравнивают к давлению, которое оказывает столб жидкости соответствующей высоты.
1 мм рт. ст = 133,322 Па, |
1 мм вод. ст. = 9,81 Па |
|
Для измерения давлений применяют барометры и манометры, |
а для |
|
измерения разрежения - вакуумметры. |
|
|
Барометрами измеряют атмосферное давление Ратм. , |
|
|
Манометрами измеряют давление, |
превышающее атмосферное |
Рман. |
(Ризб.). Давление, превышающее атмосферное называется избыточным.
Вакуумметрами измеряют давление ниже атмосферного Рвак.. Их показания дают значение разрежения (или вакуума).
Абсолютным давлением называется давление, отсчитываемое от абсолютного нуля, или абсолютного вакуума. Абсолютное давление определяется:
(1.2)
(1.3)
Термодинамическим параметром состояния является только абсо-
лютное давление.
Температура T
Т е м п е р а т у р о й называется физическая величина, характеризующая степень нагретости тела. Понятие о температуре вытекает из следующего утверждения: если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениваться теплотой друг с другом, если же их температуры равны, то теплообмена не будет.
С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул. Ее численное значение связано с величиной средней кинетической энергии молекул вещества:
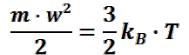
9
(1.4)
где kB — постоянная Больцмана, равная 1,380662 10 ˉ 23 Дж/К.
Из уравнения (1.4) следует, что с уменьшением температуры средняя скорость теплового движения молекул также уменьшается.
Следовательно, существует такая температура, при которой средняя скорость теплового движения молекул становится равной нулю.
Эта температура получила название абсолютного нуля. Температура T, отсчитываемая от абсолютного нуля, называется а б с о л ю т н о й .
В системе СИ единицей температуры является Кельвин (К); на практике широко применяется градус Цельсия (°С).
Соотношение между абсолютной Т (К) и t(°С) имеет вид: T = t + 273,15. Так как цена деления шкал одинакова, то очевидно, что Δt = Т.
В промышленных и лабораторных условиях температуру измеряют с помощью жидкостных термометров, пирометров, термопар и других приборов.
Для сравнения величин, характеризующих системы в одинаковых состоя-
ниях, вводится понятие «нормальные физические условия»:
p = 760 мм рт.ст. = 101,325 кПа; |
T = 273,15 K. |
В разных отраслях техники и разных странах вводят свои «условия»,
например: «технические условия» (p = 735,6 мм рт.ст.= 98 кПа , t = 15 ˚C) или «стандартные условия» (p = 101,325 кПа, t = 20 ˚С) и т. д.
Параметры состояния, не зависящие от массы системы, называются интенсивными параметрами (давление, температура).
Параметры, значение которых пропорциональны массе системы, называ-
ются аддитивными (экстенсивными) параметрами (объем).
Давление, объем и температуру также называют термическими пара-
метрами состояния.
