ответы на коллоки / бх коллок липиды
.docx|
Б.1.Бета-окисление жир.к-т. Бе́та-окисле́ние- метаболический процесс деградации жирных кислот. Своё название процесс получил по 2-му углеродному атому (С-3 или β-положение) от карбоксильной группы (-СООН) жирной кислоты, который подвергается окислению и последовательному отделению от молекулы. Продуктами каждого цикла β-окисления являются ФАДH2, НАДH и ацетил-КоА. Реакции β-окисления и последующего окисления ацетил-КоА в цикле Кребса служат одним из основных источников энергии для синтеза АТФ по механизму окислительного фосфорилирования. В эукариотических клетках β-окисление происходит исключительно в аэробных условиях в матриксе митохондрий или пероксисомах, у растений этот процесс осуществляется в глиоксисомах. У млекопитающих этот процесс происходит во многих тканях, в первую очередь в печени, почках и сердце.
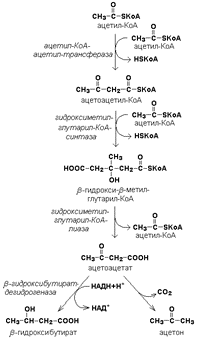
Дегидрогеназы— группа ферментов из класса оксидоредуктаз, катализирующих перенос протонов от субстрата (органических веществ) и пары электронов — к акцептору. Гидратаза-фермент класса лиаз, катализирующий обратимое присоединение воды к дианиону. 2.Жидко-мозаич.стр-ра мембран. Согласно жидкостно-мозаичной модели структуры мембраны, предложенной Сингером, биологическая мембрана представляет собой два параллельных слоя липидов (бимолекулярный слой, липидный бислой). Мембранные липиды имеют гидрофобную (углеводородные остатки жирных кислот и др.) и гидрофильную (фосфат, холин, коламин, сахар и т.п.) части. Такие молекулы образуют в клетке бимолекулярные слои: гидрофобные части их повернуты дальше от водного окружения, т.е. друг к другу, и удерживаются вместе сильными гидрофобными взаимодействиями и слабыми силами Лондона-Ван-дер-Ваальса. Таким образом, мембраны на обеих наружных поверхностях гидрофильны, а внутри – гидрофобны. По расположению белков в мембране и способу ассоциации с липидным слоем их можно разделить на: 1) поверхностные или периферические мембранные белки, связанные с гидрофильной поверхностью липидного бислоя; 2) погружённые в гидрофобную область бислоя – интегральные мембранные белки. Периферические белки связаны полярными радикалами с гидрофильной поверхностью бислоя за счёт ионных и водородных связей. Интегральные белки, как и липиды, являются амфифильными молекулами: а) у них есть гидрофобные области, взаимодействующие с гидрофобными радикалами липидных молекул внутри бислоя; и гидрофильные области, обращённые с обеих сторон мембраны к воде. Функции мембранных белков На основании функций, которые выполняют мембранные белки их можно разделить на две группы: - структурные белки – поддерживают структуру всей мембраны. Это, как правило, периферийные белки. - динамические белки - непосредственно участвуют в процессах, происходящих на мембране. Выделяют три класса таких белков: - транспортные – участвуют в переносе веществ через мембрану; - каталитические - это ферменты, интегрированные в мембрану и катализирующие происходящие там реакции; - рецепторные – это мембранные рецепторы, специфически связывающие сигнальные молекулы (гормоны, токсины) на наружной стороне мембраны, что служит сигналом для изменения процессов обмена на мембране и внутри клетки. .Б2.Синтез ацетоновых тел в печени. Под термином «кетоновые тела» подразумевают следующие соединения: ацетоуксусная кислота (ацетоацетат), β-гидроксимасляная кислота (β-гидроксибутират), ацетон. Это – продукты неполного окисления жирных кислот. Синтез их происходит в митохондриях печени из ацетил-КоА
|
Б.4.Бета-окисление.р-ии дегидрирования.. Бе́та-окисле́ние- метаболический процесс деградации жирных кислот. Своё название процесс получил по 2-му углеродному атому (С-3 или β-положение) от карбоксильной группы (-СООН) жирной кислоты, который подвергается окислению и последовательному отделению от молекулы. Продуктами каждого цикла β-окисления являются ФАДH2, НАДH и ацетил-КоА.
Дегидрогеназы представляют собой энзимы класса оксидоредуктаз, которые катализируют реакции отщепления водорода (то есть протонов и электронов) от субстрата, который является окислителем, и транспортируют его на другой субстрат, который восстанавливается. Функцию первичных акцепторов атомов водорода, отщепляющихся от соответствующих субстратов, выполняют дегидрогеназы 2 типов: пиридинзависимые дегидрогеназы - содержат коферменты никотинамид (НАД +) или никотинамидадениндинуклеотидфосфат (НАДФ +). флавинзависимые дегидрогеназы, простетической группой которых является флавинадениндинуклеотид (ФАД) или флавинмононуклеотид (ФМН). В зависимости от химической природы акцептора, с которым взаимодействуют дегидрогеназы, их делят на несколько групп: Анаэробные дегидрогеназы, которые катализируют реакции, в которых акцептором водорода является соединение, которое отличается от кислорода. Аэробные дегидрогеназы, которые катализируют реакции где акцептором водорода может быть кислород (оксидазы) или другой акцептор. Аэробные дегидрогеназы относятся к флавопротеинам, продукт реакции - перекись водорода. Дегидрогеназы, которые обеспечивают транспортировку электронов от субстрата к акцептору электронов. К этой группе дегидрогеназ принадлежат цитохромы дыхательной цепи митохондрий. Дегидрогеназы, которые катализируют прямое введение в молекулу субстрата окисляется, 1 или 2 атомов кислорода. Такие дегидрогеназы получили название оксигеназы. Энерг.эффект окисления.
Особенности бета-окисл. Ненасыщенные жирные кислоты (НЖК) составляют почти половину от общего количества жирных кислот в организме человека. Особенности β-окисления таких кислот определяются положением и числом двойных связей. Двойные связи (-C=C-) природных ненасыщенных жирных кислот (олеиновой, линолевой и т. д.) имеют цис-конфигурацию, а в КоА-эфирах ненасыщенных кислот, являющихся промежуточными продуктами при β-окислении насыщенных жирных кислот, двойные связи имеют транс-конфигурацию. β-Окисление этих кислот идёт обычным путём до тех пор, пока двойная связь не окажется между третьим и четвёртым атомами углерода. Затем фермент еноил-КоА-изомераза (КФ 5.3.3.8) перемещает двойную связь из положения Δ3-4 в положение Δ2-3 и изменяет цис-конформацию двойной связи на транс-, которая требуется для β-окисления. Далее процесс протекает также, как и для насыщенных кислот. При окислении жирных кислот, имеющих две (-С=C-C-C=C-) и более ненасыщенные связи, требуется ещё один дополнительный фермент β-гидроксиацил-КоА-эпимераза. Скорость окисления ненасыщенных жирных кислот много выше, чем насыщенных, что обусловлено наличием двойных связей. 2.Синтез холестерина.
Регуляция процесса. Регуляция синтеза холестерина – его ключевого фермента (ГМГ-КоА редуктазы) проходит разными способами. Фосфорилирование / дефосфорилирование ГМГ-редуктазы. При увеличении соотношения инсулин/глюкагон этот фермент фосфорилируется и переходит в активное состояние. Действие инсулина осуществляется через 2 фермента. Фосфатазу киназы ГМГ-КоА-редуктазы, которая привращает киназу в неактивное дефосфорилированное состояние: Фосфотазу ГМГ-КоА-редуктазы путем превращения ее в дефосфорилированное активное состояние. Результатом этих реакций служит образование дефосорилированной активной формы ГМГ-КоА-редуктазы. Следовательно, в абсорбтивный период холестерин увеличивается. Метаболическая функция. Холестерин является предшественником биологически активных веществ: витамина D3,СТЕРОИДНЫХ гормонов (АНДРОГЕНОВ, ЭСТРОГЕНОВ, КОРТИКОИДОВ) При окислении холестерина в печени при участии ЦИТОХРОМА Р-450 образуются желчные кислоты. В свободном виде холестерин транспортируется по организму с помощью транспортных ЛИПОПРОТЕИНОВ крови. Источники холестерина: |
|
Синтез кетоновых тел в организме усиливается при ускоренном катаболизме жирных кислот (голодание, сахарный диабет). В этих условиях в печени имеется дефицит оксалоацетата, образующегося преимущественно в реакциях углеводного обмена. Поэтому затрудняется взаимодействие ацетил-КоА с оксалоацетатом и все последующие реакции цикла трикарбоновых кислот Кребса. Ацетоуксусная и β-гидроксимасляная кислоты, которые относятся к кетоновым телам, являются сильными кислотами. Поэтому накопление их в крови приводит к сдвигу рН в кислую сторону (метаболический ацидоз).Норма-0,03-0,6 мМ/л. 2.Виды транспорта молекул через мембрану. Пассивный транспорт. Происходит за счет разности концентраций и разности потенциалов. Есть несколько видов пассивного транспорта (рис. 59). Химическая энергия при пассивном транспорте не затрачивается. Виды пассивного транспорта: простая диффузия (а), транспорт через каналы (б), облегченная диффузия (в),эстафетная передача (г) Простая диффузия (по закону Фика). Это диффузия кислорода, углекислого газа, ряда лекарственных веществ. Процесс медленный. Транспорт через каналы (поры). Через них идут молекулы воды, крупные ионы. Каналы увеличивают проницаемость мембран и обеспечивают селективность. Облегченная диффузия – перенос ионов специальными молекулами-переносчиками, за счет диффузии переносчика вместе с веществом. Наиболее подробно это изучено для переноса ионов некоторыми антибиотиками, например валиномицином. Последний повышает проницаемость мембран для K+. Эстафетная передача – здесь образуются из молекул-переносчиков временные цепочки поперек мембраны, которые передают друг другу диффундирующую молекулу (рис. 59 г). Грамицидин, например, передает ион Na+ (эстафетно). б) Активный транспорт. Перенос происходит при затратах химической энергии. При этом нейтральные молекулы переносятся в область большей концентрации, а ионы против сил, действующих на них со стороны поля. Движение здесь происходит противоположно движению по уравнению Нернста–Планка. Энергия получается за счет гидролиза молекулы АТФ – аденозинтрифосфорной кислоты. Захватив одним активным центром ион калия из наружной среды, а другим ион натрия из внутренней, система, потребляя АТФ, поворачивается внутри мембраны на 180°, после чего ионы освобождаются. Молекула белка принимает затем исходное положение, и далее все повторяется. За счет этого транспорта клетка поддерживает внутри себя высокую концентрацию калия и низкую натрия. Активный транспорт обеспечивает механизм селективной проницаемости клеточных мембран. |
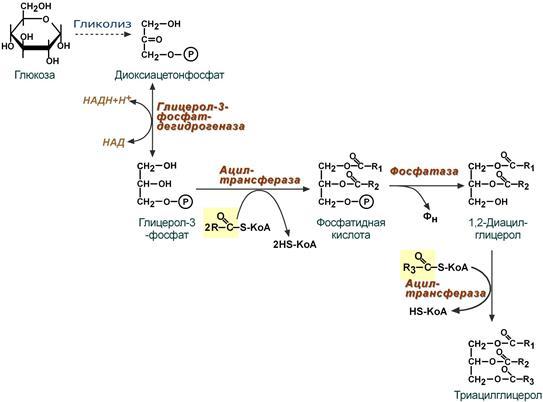
Б5.Схема взаимосвязи угл. И лип.обмена Обмен углеводов и липидов тесно взаимосвязан как в физиологических условиях, так и при патологии. Эта взаимосвязь возможна благодаря наличию общих метаболитов в обмене углеводов и липидов. Углеводы могут использоваться для синтеза различных классов липидов. Некоторые возможные пути перехода углеводов в липиды: Глюкоза→фосфодигидроксиацетон→глицерофосфат→ТАГ, ФЛ Глюкоза→ацетил-КоА→жирные кислоты, холестерин→липиды Глюкоза→ ацетил-КоА→ холестерин→ стероиды Глюкоза→НАДФН2(пентозофосфатный путь)→синтез жирных кислот, синтез сфингозина, синтез холестерина. У детейуглеводы очень активно используются для синтеза липидов.
2.Образ-е и метаболизм ЛПНП. Транспорт холестерола в составе ЛПНП. Рецепторы ЛПНП. На ЛППП, оставшиеся в крови, продолжает действовать ЛП-липаза, и они превращаются в ЛПНП, содержащие до 55% холестерола и его эфиров. Апопротеины Е и С-II реносятся обратно в ЛПВП. Поэтому основным апопротеином в ЛПНП служит апоВ-100. Апопротеин В-100 взаимодействует с рецепторами ЛПНП и таким образом определяет дальнейший путь холестерола. ЛПНП - основная транспортная форма холестерола, в которой он доставляется в ткани. Около 70% холестерола и его эфиров в крови находится в составе ЛПНП. Из крови ЛПНП поступают в печень (до 75%) и другие ткани, которые имеют на своей поверхности рецепторы ЛПНП. Рецептор ЛПНП - сложный белок, состоящий из 5 доменов и содержащий углеводную часть. Рецепторы ЛПНП синтезируются в ЭР и аппарате Гольджи, а затем экспонируются на поверхности клетки, в специальных углублениях, выстланных белком клатрином. Эти углубления называют окаймлёнными ямками. Выступающий на поверхность N-концевой домен рецептора взаимодействует с белками апоВ-100 и апоЕ; поэтому он может связывать не только ЛПНП, но и ЛППП, ЛПОНП, остаточные ХМ, содержащие эти апопротеины. Клетки тканей содержат большое количество рецепторов ЛПНП на своей поверхности: например, на одной клетке фибробласта имеется от 20 000 до 50 000 рецепторов. Из этого следует, что холестерол поступает в клетки из крови в основном в составе ЛПНП. Если количество холестерола, поступающего в клетку, превышает её потребность, то синтез рецепторов ЛПНП подавляется, что уменьшает поток холестерола из крови в клетки. При снижении концентрации свободного холестерола в клетке, наоборот, активируется синтез ГМГ-КоА-редуктазы и рецепторов ЛПНП. В регуляции синтеза рецепторов ЛПНП участвуют гормоны: инсулин и трийодтиронин (Т3), полрвые гормоны. Они увеличивают образование рецепторов ЛПНП, а глюкокортикоиды (в основном кортизол) уменьшают. Эффекты инсулина и Т3, вероятно, могут объяснить механизм гиперхолестеролемии и увеличение риска атеросклероза при сахарном диабете или гипотиреозе. Роль ЛПВП в обмене холестерола. ЛПВП выполняют 2 основные функции: они поставляют апопротеины другим ЛП в крови и участвуют в так называемом "обратном транспорте холестерола". ЛПВП синтезируются в печени и в небольшом количестве в тонком кишечнике в виде "незрелых липопротеинов" - предшественников ЛПВП. |
|
Б.3.Метаболизм мембран. Внутренний обмен, или метаболизм, представляет собой совокупность двух противоположных реакций: анаболический и катаболический. Анаболические реакции – это реакции синтеза сложных органических веществ из более простых. Протекают они с затратами энергии, обеспечивая постоянство состава клеток и тканей организма. Примером ассимиляции может быть биосинтез белка, синтез углеводов из воды и углекислого газа в процессе фотосинтеза, синтез нуклеотидов, ДНК, РНК, полисахаридов, липидов и других соединений. Катаболические реакции – это реакции расщепления сложных органических веществ (жиров, белков и углеводов) до более простых с выделением энергии, значительная часть которой идет на образование АТФ.
Активные формы кислорода— включают ионы кислорода, свободные радикалы и перекиси как неорганического, так и органического происхождения. АФК постоянно образуются в живой клетке как продукты нормального метаболизма кислорода. Однако повышенная продукция АФК приводит к оксидативному стрессу. Нормальные функции АФК включают индукцию иммунной системы и мобилизацию систем ионного транспорта. Например, клетки крови на месте повреждения начинают продуцировать АФК, что рекрутирует тромбоциты, необходимые для начала процесса заживления раны. АФК использ.для обезвреж-я эндоген.токсинов и ксенобиотиков. В-ва блокир.ПОЛ:вит.Е,К,Д,С,стеролы,билирубин,мочевая к-та.цистеин. Показатели ПОЛ:кол-во своб.радикалов,конц-я малонового диальдегида(фотометрия),конц-я Шиффовых осн-й(флуор.метод),кол-во липофусцина в тканях(гистохим.опр-е) и т.д 2.Переваривание липидов. Для взрослого человека суточная потребность в липидах составляет от 70-80 г до 100 г, для детей5 – 7 г/кг. У взрослых людей процесс переваривания липидов происходит в тонком кишечнике. Необходимыми условиями для этого являются: - наличие ферментов; - оптимальное рН; - эмульгирование жиров. Необходимость эмульгирования липидов связана с водонерастворимостью жиров. Водорастворимые ферменты могут действовать на липиды только на поверхности капли. Эмульгирование повышает поверхность раздела липид / вода и обеспечивает большую поверхность контакта фермента и липида. В эмульгировании липидов основную роль играют жёлчные кислоты, выделяемые в просвет кишечника в составе жёлчи. Различают простые и парные, первичные и вторичные жёлчные кислоты: Простые жёлчные кислоты являются производными холановой кислоты. К простым жёлчным кислотам относятся холевая, дезоксихолевая кислота, хенодезоксихолевая и литохолевая кислоты. Синтез жёлчных кислот из холестерина происходит в печени. Ключевым ферментом является 7 – α -гидроксилаза. Полярность простых жёлчных кислот увеличивается при образовании парных жёлчных кислот путём присоединения глицина (гликокола) и таурина. У взрослого человека до 80% всех жёлчных кислот представлено гликохолевой и таурохолевой кислотами. В кишечнике под действием микрофлоры происходит отцепление таурина, гликокола и ОН группы в 7 положении с образованием вторичных желчных кислот: дезоксихолевой и литохолевой. Все жёлчные кислоты относятся к поверхностно активным веществам, имеющим в своем составе гидрофобные и гидрофильные участки. Гидрофильными являются ОН - группы, остатки таурина и гликокола, а гидрофобными – радикал жёлчной кислоты. Благодаря дифильности жёлчные кислоты располагаются в поверхностном слое жировой капли и уменьшают поверхностное натяжение. В результате снижения поверхностного натяжения под действием перистальтики кишечника, выделения СО2в результате нейтрализации бикарбонатами соляной кислоты желудочного содержимого происходит дробление крупных капель липида на множество мелких – эмульгирование, резко возрастает поверхность соприкосновения липидных капель и ферментов. Липолитические ферменты, участвующие в переваривании липидов, активны при pН 8 – 8,5. Такая среда обеспечивается секрецией бикарбонатов поджелудочной железой. Впереваривании ТАГучаствует поджелудочная липаза. Она вырабатывается в неактивной форме, и в тонком кишечнике взаимодействует с дополнительным белком колипазой, который повышает активность липазы и обеспечивает контакт фермента с соответствующими жирами. Поджелудочная липаза отщепляет последовательно остатки жирных кислот из α - положений с образованием β – моноацилглицерина (β -МАГ) Переваривание глицерофосфолипидов происходит под действием ферментов фосфолипаз поджелудочной железы. Под действием фосфолипазы А2 отщепляется остаток жирной кислоты из β – положения с образованием продукта неполного распада глицерофосфолипида – лизофосфолипида, содержащего в β – положении гидрофильную гидроксильную группу. фиры холестеринарасщепляются ферментом холестеролэстеразой. Переваривание сфинголипидовосуществляется ферментами эстеразами, фосфатазами, амидазами, гликозидазами. |
Б.6.Образование и метаболизм ЛПОН и ЛПНП. Биосинтез триацилглицеролов в печени Из глюкозы можно синтезировать жирные кислоты. Далее эти жирные кислоты этерифицируются, образуя триацилглицеролы. Эти триацилглицеролы не должны накапливаться в печени — в противном случае развивается жировой гепатоз, как у гусей при насильственном кормлении для приготовления фуагра. Гидрофобные жировые глобулы необходимо вывести из печени в водную среду крови. Для этого триацилглицеролы упаковываются в гидрофильную оболочку из фосфолипидов и белков, и в результате образуются ЛПОНП. ЛПОНП выводятся из печени по печеночной вене и транспортируются к периферическим тканям.
Удаление триацилглицеролов из крови тканях-мишенях По пути к тканям-мишеням формирующиеся ЛПОНП получают от ЛПВП аполипопротеины апоС2 и апоЕ. Теперь они становятся «зрелыми» ЛПОНП. В капиллярах тканей-мишеней апоВЮО и апоЕ связываются с рецептором ЛПОНП, а апоС2 активирует липопротеинлипазу (ее активность также стимулирует инсулин). Липопротеинлипаза гидролизует триацилглицеролы в составе ЛПОНП, расщепляя их на жирные кислоты и глицерол. Их дальнейшая судьба зависит от типа ткани-мишени:
в жировой ткани жирные кислоты снова связываются с глицеролом и образуют триацилглицеролы — запасные вещества; в мышцах жирные кислоты могут использоваться в качестве источника энергии; в различных тканях из жирных кислот и глицерола синтезируются фосфолипиды для построения клеточных мембран. Расщепление липопротеинов промежуточной и низкой плотности (ЛППП и ЛПНП) В капиллярах периферических тканей под действием липо-протеинлипазы из ЛПОНП образуются ЛППП, из которых затем формируются ЛПНП. В печени аполипопротеин апоВЮО частицы ЛПНП связывается с рецептором ЛПНП. Далее рецепторы интернализуются клеткой, где частицы ЛПНП распадаются на жирные кислоты, глицерол, аминокислоты и холестерол. 2.Метаболизм мембран. Внутренний обмен, или метаболизм, представляет собой совокупность двух противоположных реакций: анаболический и катаболический. Анаболические реакции – это реакции синтеза сложных органических веществ из более простых. Протекают они с затратами энергии, обеспечивая постоянство состава клеток и тканей организма. Примером ассимиляции может быть биосинтез белка, синтез углеводов из воды и углекислого газа в процессе фотосинтеза, синтез нуклеотидов, ДНК, РНК, полисахаридов, липидов и других соединений. Катаболические реакции – это реакции расщепления сложных органических веществ (жиров, белков и углеводов) до более простых с выделением энергии, значительная часть которой идет на образование АТФ. Перекисное окисление липидов (ПОЛ) — окислительная деградация липидов, происходящая, в основном, под действием свободных радикалов. Этапы:
Активаторы ПОЛ: Прооксид.в-ва или агенты способные генерировать актив.формы кислорода. 1.Неферм-е восст-е О2,индуцируемое металлами с переменной валентностью(Cu.Fe..) -оксил-е аскорб.к-ты(высокие конц-ии) в присут. Ме. -р-и взаим-й оксидов азота Ферм-е: -окисл-е убихинола в убихинон -цитохромооксидантная р-я -окисл-е гипоксантина и ксантина под действием ксантинооксидазы -окисл-е ряда токсич.в-в в микросомальной цепи. Показатели ПОЛ: кол-во своб.радикалов,конц-я малонового диальдегида(фотометрия),конц-я Шиффовых осн-й(флуор.метод),кол-во липофусцина в тканях(гистохим.опр-е) и т.д Б.7.Синтез насыщ.жир.к-т. Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя или после еды. Условно можно выделить 4 этапа биосинтеза: 1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот. 2. Перенос ацетил-SКоА из митохондрий в цитозоль: может быть в комплексе с карнитином, подобно тому как переносятся внутрь митохондрии высшие жирные кислоты, но здесь транспорт идет в другом направлении, обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК. Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА. Оксалоацетат в дальнейшем восстанавливается до малата, и последний либо переходит в митохондрии (малат-аспартатный челнок), либо декарбоксилируется в пируват малик-ферментом ("яблочный" фермент). 3. Образование малонил-SКоА из ацетил-SКоА. Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов.
В первых двух реакциях последовательно присоединяются малонил-SКоА к фосфопантетеину ацил-переносящего белка и ацетил-SКоА к цистеину 3-кетоацилсинтазы. 3-Кетоацилсинтаза катализирует третью реакцию – перенос ацетильной группы на С2 малонила с отщеплением карбоксильной группы. Далее кетогруппа в реакциях восстановления (3-кетоацил-редуктаза), дегидратации (дегидратаза) и опять восстановления (еноил-редуктаза) превращается в метиленовую с образованием насыщенного ацила, связанного с фосфопантетеином. Ацилтрансфераза переносит полученный ацил на цистеин 3-кетоацил-синтазы, к фосфопантетеину присоединяется малонил-SКоА и цикл повторяется 7 раз до образования остатка пальмитиновой кислоты. После этого пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой. 4. Синтез пальмитиновой кислоты. Осуществляется мультиферментным комплексом "синтаза жирных кислот" (синоним пальмитатсинтаза) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ). Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин (ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза, также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФН.
2.Участие липидов в построении мембран. Характерной особенностью молекул фосфолипидов и гликолипидов является их амфифильность: один конец молекулы гидрофобный, другой — гидрофильный. Гидрофобный конец составляют углеводородные радикалы жирных кислот и сфингозина; он занимает большую часть длины молекулы, до 3/4- В гликолипидах гидрофильный конец образован углеводной частью, в фосфолипидах — фосфатным остатком с присоединенным к нему холином, этаноламином или серином. Вследствие амфифильности эти липиды в водной среде образуют многомолекулярные структуры с упорядоченным расположением молекул: гидрофобные части вытесняются из водной среды и взаимодействуют друг с другом (как бы растворяются друг в друге), а гидрофильные части контактируют с водой и гидратируются (как бы растворяются в воде). Именно эта особенность строения и физико-химических свойств определяет роль фосфолипидов и гликолипидов в построении биологических мембран: основу мембран составляет бимолекулярный липидный слой.белки (/) и липиды наружной поверхности содержат углеводные компоненты (2), обычно разветвленные олигосахариды. С внутренней поверхностью мембраны контактируют белки (3), соединенные со скелетными и сократительными структурами клетки — микрофибриллами и микротрубочками Холестерин, хотя и содержит небольшую гидрофильную группу (гидроксил в положении 3), в основном является гидрофобным, его амфифильность выражена слабо. Молекула холестерина имеет вытянутую форму |
|
|
|