ответы на коллоки / коллок 1 весна бх
.docx|
Б9Схема полного окисления глюкозы.. С6Н12О6 + 6 О2 → 6 СО2 + Н2О + 2820 кДж/моль.
Рег-я:отнош-е АТФ АДФ,НАДН2 и НАД.инсулин-актив,глюкагон-ингиб,кислород,регулят.ферм-ты.
|
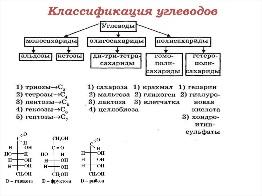
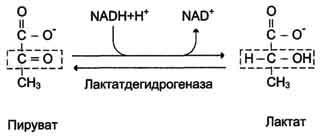
Б14 Основные углеводы пищи,примеры. Основными углеводами пищи являются сложные сахара, так называемые полисахариды: крахмал и гликоген, построенные из большого числа остатков глюкозы. Сама глюкоза относится к группе моносахаридов и содержится в больших количествах в винограде и сладких фруктах. В меде и фруктах, помимо глюкозы, содержатся значительные количества фруктозы. В молоке и молочных продуктах содержатся большие количества менее сладкого, молочного сахара – лактозы, в состав которого наряду с глюкозой входит и моносахарид галактоза. Все ферменты, участвующие в переваривании можно разделить на две группы: 1.Эндогликозидазы гидролизуют олиго- и полисахариды, разрывая гликозидные связивнутри цепочек, а не на их концах: в. α-Амилазаслюны; г. α -Амилаза поджелудочной железы. 2.Экзогликозидазы гидролизуют олиго, три- и дисахариды, разрывая концевые гликозидные связи: д. Мальтаза; е. Сахараза;ж.Лактаза;Трегалаза. Гликозидазы, как правило, строго специфичны к структуре и конфигурации гликозидных цепочек, а также к типу гликозидных связей. Конечными продуктами переваривания углеводов являются моносахариды, которые всасываются клетками кишечника (энтероцитами). Переваривание углеводов начинается в ротовой полости под действием фермента слюны α -амилазы (КФ 3.2.1.1), которая лишь частично гидролизует полисахариды, разрывая α(1→4)- гликозидные связи. В природе существуют α(1→4)- и β(1→4)-гликозидазы,но у человека отсутствуют вторые, поэтому он не способен усваивать углеводы, содержащие β (1→4)-гликозидныесвязи (например, целлюлозу). Продуктами действия α-амилазына полисахариды являются короткие разветвленные и неразветвленные олигосахариды —декстрины. Дисахариды, содержащиеся в пище, не расщепляютсяα-амилазой. Вдвенадцатиперстной кишке кислая реакция содержимого желудка нейтрализуется бикарбонатами, секретируемыми поджелудочной железой. Переваривание углеводов возобновляется уже под действиемα-амилазыподжелудочной железы (панкреатическая α -амилаза).Оставшиеся полисахаридные цепочки гидролизуются до олигосахаридов. Олигосахариды, образовавшиеся при расщеплении полисахаридов α-амила-зой, и дисахариды пищи подвергаются дальнейшему гидролизу под действием олиго- и дисахаридаз, встроенных в мембраны энтероцитов. Продуктами этого гидролиза являются моносахариды, которые затем транспортируются через мембрану в цитозоль энтероцитов (этот процесс называетсявсасыванием). Основные олиго- и дисахаридазы кишечника:1.Глюкоамилаза каттализирует гидролиз терминальных α(1→4)-гликозидных связей на нередуцирующих концах мальто-олигосахаридов или мальтозы. 2.Сахаразакатализирует гидролиз α(1→2)-гликозидныхсвязей в молекуле саха- розы (продукты: молекула глюкозы и фруктозы); 3. Лактазакатализирует гидролиз β(1→ 4)-гликозидныхсвязей в молекуле лактозы (или терминальных связей между остатками β-D-галактозына нередуцирующих концах вβ-D-галактозидах).Продуктом гидролиза лактозы является молекула галактозы и глюкозы. 4.Трегалазакатализирует гидролиз трегалозы до двух молекул глюкозы. Переваривание олигосахаридов обычно завершается в тощей кишке. В основе патологии переваривания и всасывания углеводов могут быть причины двух типов: Дефекты ферментов, участвующих в гидролизе углеводов в кишечнике.Нарушения всасывания продуктов переваривания углеводов в клетки слизистой оболочки кишечника. Эссенциальная фруктозурия отмечается при дефекте фруктокиназы печени. Наследственная непереносимость фруктозы является следствием генетически обусловленного дефекта фермента альдолазы фруктозо-1-фосфата. Нарушение метаболизма галактозы проявляется при наследственном заболевании – галактоземии. Оно является следствием врожденного дефекта ферментагексозо-1-фосфат-уридилилтрансферазы. Б 14 Лактатдегидрогеназная реакция,ее регуляция.
Инс,адф,фр-2,6 ф -/глюкагон и атф +.Часть лактата используется для синтеза энергии. Лактат универсальный переносчик энергии. Цикл Кори (глюкозо-лактатный цикл).Он представляет собой биохимический транспорт лактата из мышц в печень и дальнейший синтез глюкозы из лактата, катализируемый ферментами глюконеогенеза:
При интенсивной мышечной работе и в условиях отсутствия или недостаточного числа митохондрий (например, в эритроцитах) глюкоза подвергается анаэробному гликолизу с образованием лактата. При накоплении лактата в мышцах возникает лактат-ацидоз, раздражаются чувствительные нервные окончания, что вызывает боль в мышцах. Лактат переносится кровью в печень и превращается в пируват, а затем в глюкозу (глюконеогенез), которая с током крови может возвращаться в работающую мышцу. ГЛИКОЛИТИЧЕСКАЯ ОКСИДОРЕДУКЦИЯ - это сопряжение между 6-й стадией (окисление ФГА) и 11-й стадией (восстановление ПВК до лактата) гликолиза.
|
|
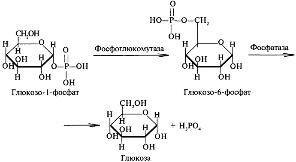
Б10 Фосфоролитический путь мобилизации гликогена,реакции.
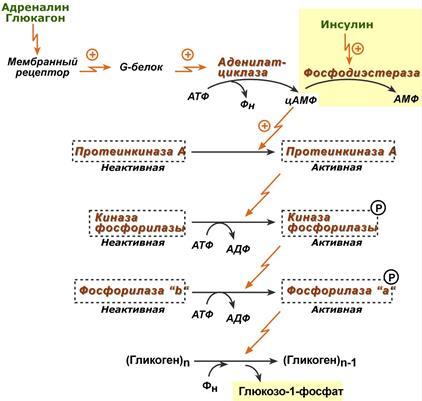
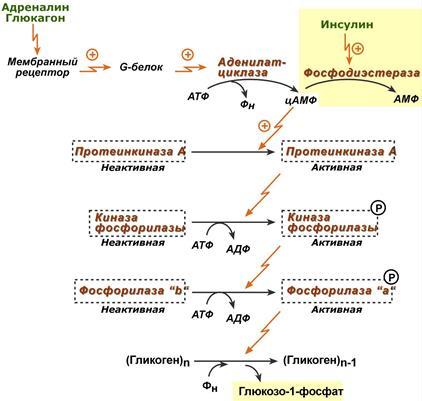
Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться тремя способами: ковалентная модификация,кальций-зависимая активация,аллостерическая активация с помощью АМФ. (кофермент пиридоксальфосфат) При действии некоторых гормонов на клетку происходит активация фермента через аденилатциклазный механизм.
Самый частый гликогеноз I типа или болезнь фон Гирке (печень) обусловлен аутосомно-рецессивным дефектом глюкозо-6-фосфатазы. Гликогеноз V типа (болезнь Мак-Ардля) – отсутствие мышечной фосфорилазы. При тяжелой мышечной нагрузке возникают судороги, миоглобинурия, хотя легкая работа не вызывает каких-либо проблем. Гликогеноз II типа (болезнь Помпе, 10% всех гликогенозов) – поражаются все гликогенсодержащие клетки из-за отсутствия лизосомальной (кислой) α-1,4-глюкозидазы, поэтому данная болезнь относится к лизосомным болезням накопления. Агликогенозы – состояния, связанные с отсутствием гликогена. В качестве примера агликогеноза можно привести наследственный аутосомно-рецессивный дефицит гликоген-синтазы. |
Б15 Гликолиз,гликогенолиз,определения. Глико́лиз — процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты. Гликогено́лиз — биохимический процесс расщепления гликогена до глюкозы, осуществляется главным образом в печени и мышцах[ и не требует затрат энергии. Основная задача гликогенолиза — поддержание постоянного уровня глюкозы в крови.
Энергообесп: Рег-я: 1-актив АДФ,инсулин.Ингиб. гл-6-фосфат,большие конц-ии атф. 2-медленная-акт.адф Б 15 Роль инсулина в регуляции содержания глюкозы в крови. Инсулин снижает содержание глюкозы в крови после возрастания ее концентрации. Главную роль в формировании эффектов инсулина играет фосфорилирование внутриклеточных белков-субстратов инсулинового рецептора (IRS), основным из которых является IRS-1. Рецептор к инсулину обладает тирозинкиназной активностью. Он состоит из двух α-субъединиц и двух β-субъединиц, которые связаны между собой дисульфидными связями и нековалентными взаимодействиями. На поверхности мембраны находятся α-субъединицы с доменом для связывания с инсулином, β-субъединицы пронизывают бислой мембраны и не взаимодействуют непосредственно с инсулином. Каталитический центр тирозинкиназной активности находится на внутриклеточном домене находится β-субъединиц. Взаимодействие инсулина с α-субъединицами рецептора приводит к фосфорилированию β-субъединиц рецептора, в таком состоянии они способны фосфорилировать другие внутриклеточные белки, изменяя тем самым их функциональную активность. Фосфорилирование ИРФ-1 повышает активность этого белка и позволяет ему активировать различные цитозольные белки - ферменты. Это проводит к активации нескольких сигнальных путей и каскадов специфических протеинкиназ (фосфолипаза Ср, Ras-белок, Raf-1 протеинкиназа, митогенактивируемые про-теинкиназы (МАПКК, МАПК), фосфолипаза А2), вызывает фосфорилирование ферментов, факторов транскрипции (ПСАТ), обеспечивая многообразие эффектов инсулина. Активированный R-белок активирует протеинкиназу Raf-1. Эта протеинкиназа активирует протеинкиназу МАПКК, МАПК, что в конечном счете вызывает длительные эффекты инсулина через активацию ПСАТ. Инсулинорезистентность – это снижение чувствительности инсулинозависимых клеток к действию инсулина с последующим нарушением метаболизма глюкозы и поступления ее в клетки. ... При этом повышается риск возникновения сахарного диабета, сердечно-сосудистых заболеваний, нарушения обмена веществ, метаболического синдрома. амф фруктозо-2,6 бифосфат.Ингиб. избыток атф,надн2,цитрат,фруктозо-1,6 фосфат. |
|
|
|
|
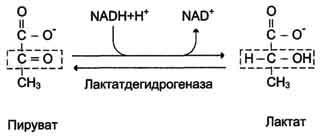
Б10 Лактатдегидрогеназная реакция,ее регуляция.
Инс,адф,фр-2,6 ф -/глюкагон и атф +.Часть лактата используется для синтеза энергии. Лактат универсальный переносчик энергии. Цикл Кори (глюкозо-лактатный цикл).Он представляет собой биохимический транспорт лактата из мышц в печень и дальнейший синтез глюкозы из лактата, катализируемый ферментами глюконеогенеза:
При интенсивной мышечной работе и в условиях отсутствия или недостаточного числа митохондрий (например, в эритроцитах) глюкоза подвергается анаэробному гликолизу с образованием лактата. При накоплении лактата в мышцах возникает лактат-ацидоз, раздражаются чувствительные нервные окончания, что вызывает боль в мышцах. Лактат переносится кровью в печень и превращается в пируват, а затем в глюкозу (глюконеогенез), которая с током крови может возвращаться в работающую мышцу. |
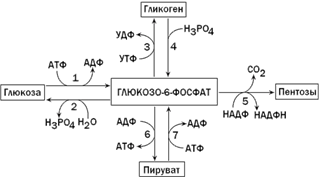
Б16 Глюкозо-6-фосфат –узловой метаболит углеводного обмена.Написать реакции его обр-я.
|
|
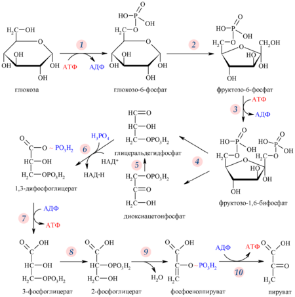
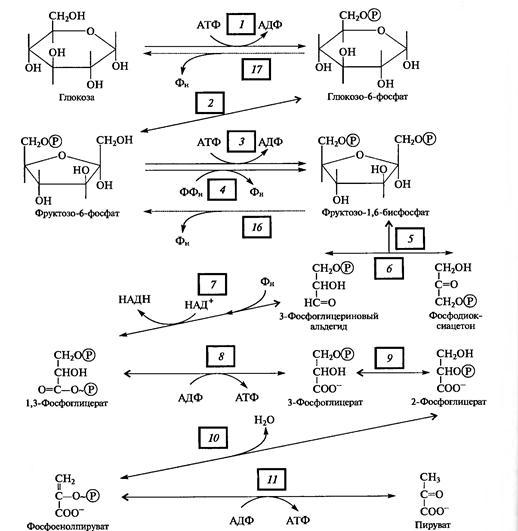
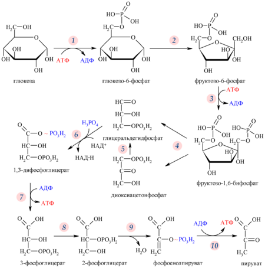
Б11 Гликолиз,общая характеристика процесса. Глико́лиз — процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты. Гликолиз состоит из цепи последовательных ферментативных реакций и сопровождается запасанием энергии в форме АТФ и НАДH. Гликолиз является универсальным путём катаболизма глюкозы и одним из трёх встречающихся в живых клетках. Реакция гликолиза в суммарном виде выглядит следующим образом: Глюкоза + 2НАД+ + 2АДФ + 2Pi → 2 пируват + 2НАДH + 2Н+ + 2АТФ + 2Н2O[2]. Кислород не требуется для протекания гликолиза. В аэробных условиях пировиноградная кислота далее декарбоксилируется, соединяется с коферментом А и вовлекается в цикл Кребса, а в анаэробных условиях или при гипоксии претерпевает дальнейшие превращения в ходе брожения
|
Б16 Фосфоролитический путь мобилизации гликогена.
Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться тремя способами: ковалентная модификация,кальций-зависимая активация,аллостерическая активация с помощью АМФ. (кофермент пиридоксальфосфат) При действии некоторых гормонов на клетку происходит активация фермента через аденилатциклазный механизм.
Самый частый гликогеноз I типа или болезнь фон Гирке (печень) обусловлен аутосомно-рецессивным дефектом глюкозо-6-фосфатазы. Гликогеноз V типа (болезнь Мак-Ардля) – отсутствие мышечной фосфорилазы. При тяжелой мышечной нагрузке возникают судороги, миоглобинурия, хотя легкая работа не вызывает каких-либо проблем. Гликогеноз II типа (болезнь Помпе, 10% всех гликогенозов) – поражаются все гликогенсодержащие клетки из-за отсутствия лизосомальной (кислой) α-1,4-глюкозидазы, поэтому данная болезнь относится к лизосомным болезням накопления. Агликогенозы – состояния, связанные с отсутствием гликогена. В качестве примера агликогеноза можно привести наследственный аутосомно-рецессивный дефицит гликоген-синтазы. |
|
Б11 Пентозофосфатный путь окисления. — альтернативный путь окисления глюкозы (наряду с гликолизом и путём Энтнера — Дудорова), включает в себя окислительный и неокислительный этапы. Суммарное уравнение пентозофосфатного пути: 3 глюкозо-6-фосфат + 6 НАДФ+ → 3СО2 + 6 (НАДФH + Н+) + 2 фруктозо-6-фосфат + глицеральдегид-3-фосфат. В дальнейшем глицеральдегид-3-фосфат превращается в пируват с образованием двух молекул АТФ.
|
|
|
Б13 Общая характеристика углеводов организма человека. Углево́ды — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп. Общая формула таких углеводов Cn(H2O)m. Примером может служить один из самых распространенных углеводов - глюкоза, элементный состав которой С6Н12О6.
Энергетическая функция состоит в том,что углеводы под влиянием ферментов легко расщепляются и окисляются с выделением энергии. Структурная(строительная)функция заключается в том ,что они используются в качестве строительного материала. Рецепторная функция заключается в том, что они являются компонентами цитоплазматической мембраны и воспринимают сигналы из окружающей среды и передают их в клетку. Метаболическая функция состоит в том,что моносахариды являются основой для синтеза многих органических веществ в клетках организмов --полисахаридов,нуклеотидов,спиртов,аминокислоти др. Запасающая функция заключается в том,что полисахариды я вляются запасными питательными веществами всех организмов,играя роль важнейших источников энергии. Защитная функция состоит в том ,что углеводы предохраняют от воздействий внешней и внутренней среды.
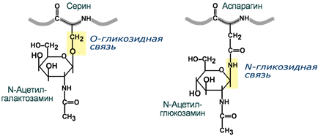
Функции гликопротеидов Структурная — клеточная стенка бактерий, костный матрикс, например, коллаген, эластин; Защитная — например, антитела, интерферон, факторы свертывания крови (протромбин,фибриноген); Рецепторная — присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ;Гормональная — гонадотропный, адренокортикотропный и тиреотропный гормоны; Ферментативная — холинэстераза, нуклеаза;Транспортная — перенос веществ в крови и через мембраны, например, трансферрин, транскортин, альбумин, Na+,К+-АТФаза. Функции протеогликанов По функции структурные протеогликаны значимы для межклеточного пространства, особенно соединительной ткани, в которое погружены коллагеновые волокна. Молекулы гликанов весьма гидрофильны, создают сетчатый желеподобный матрикс и заполняют пространство между клетками, являясь преградой для крупных молекул и микроорганизмов. Еще одним представителем протеогликанов является гепарин, включающий несколько сульфатированных цепей гетерополисахарида, связанного с белковым ядром через остатки серина. В крови гепарин связывается с антитромбином III, образуя комплекс, блокирующий факторы свертывания крови IIа, IХа, Ха, XIa и ХIIа, что применяется для профилактики тромбозов у больных различного профиля. Также функцией гепарина является активирующее влияние на активность фермента липопротеинлипазы, участвующего в метаболизме транспортных форм липидов в крови (хиломикроны и липопротеины очень низкой плотности). Как следствие, количество липидов в крови снижается.
|
Б13 гликолиз,общая характеристика процесса. Глико́лиз — процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты. Гликолиз состоит из цепи последовательных ферментативных реакций и сопровождается запасанием энергии в форме АТФ и НАДH. Гликолиз является универсальным путём катаболизма глюкозы и одним из трёх встречающихся в живых клетках. Реакция гликолиза в суммарном виде выглядит следующим образом: Глюкоза + 2НАД+ + 2АДФ + 2Pi → 2 пируват + 2НАДH + 2Н+ + 2АТФ + 2Н2O[2]. Кислород не требуется для протекания гликолиза. В аэробных условиях пировиноградная кислота далее декарбоксилируется, соединяется с коферментом А и вовлекается в цикл Кребса, а в анаэробных условиях или при гипоксии претерпевает дальнейшие превращения в ходе брожения.
Первые 3 реакции необратимы.гл 6 ф-фосфоглюкоизомераза.Потом фосфофруктокиназа.из глюкозы в гл-6-ф:активир.АДФ,инсулин,ингиб.гл-6-ф.Потом фруктозо-6 фосфат в фруктозо-1,6-дифосфат-самая медленная,акт.адф,амф,фр-2,6-бифосфат,инсулин.Ингиб. избыток атф,надн2,цитрат,фр-1,6-дифосфат. Значение: Субстратное фосфорилирование является альтернативным механизмом образования АТФ |
|
|
|





 Гликогеновые
болезни –
это наследственные заболевания,
обусловленные недостаточностью
каких-либо ферментов, отвечающих за
метаболизм гликогена. Могут быть
нарушены обе стороны обмена: как синтез
гликогена, так и его распад.
Гликогеновые
болезни –
это наследственные заболевания,
обусловленные недостаточностью
каких-либо ферментов, отвечающих за
метаболизм гликогена. Могут быть
нарушены обе стороны обмена: как синтез
гликогена, так и его распад.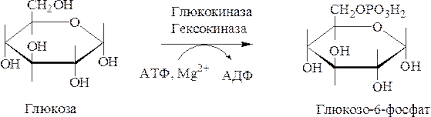


 Гликогеновые
болезни –
это наследственные заболевания,
обусловленные недостаточностью
каких-либо ферментов, отвечающих за
метаболизм гликогена. Могут быть
нарушены обе стороны обмена: как синтез
гликогена, так и его распад.
Гликогеновые
болезни –
это наследственные заболевания,
обусловленные недостаточностью
каких-либо ферментов, отвечающих за
метаболизм гликогена. Могут быть
нарушены обе стороны обмена: как синтез
гликогена, так и его распад.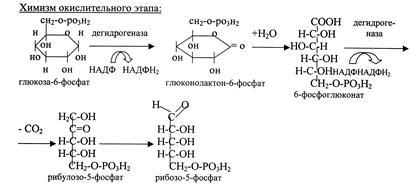 регуляция:метаболическая-актив.конц-й
глюкозы и гл-6-фосф,регулятор. Фермент
глю-6-фасфДГ(актив.НАДФ,ингиб
НАДФ2).гормон-я-инсулин актив
ПФП.Био.знач:1.путь образ-я пентоз для
синтеза нукл0в,нукл.к-т и коферментов.2.Пост-ет
восс-ый НАДФН2.3.Альтер-й путь окисл
глюк.
регуляция:метаболическая-актив.конц-й
глюкозы и гл-6-фосф,регулятор. Фермент
глю-6-фасфДГ(актив.НАДФ,ингиб
НАДФ2).гормон-я-инсулин актив
ПФП.Био.знач:1.путь образ-я пентоз для
синтеза нукл0в,нукл.к-т и коферментов.2.Пост-ет
восс-ый НАДФН2.3.Альтер-й путь окисл
глюк.