ответы на коллоки / 11бххх
.docx|
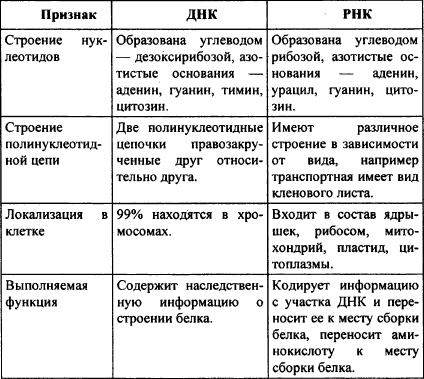
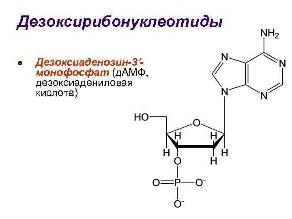
1.нуклеиновые кислоты — биополимеры, а их функция заключается в хранении, реализации и передаче генетической (наследственной) информации в живых организмах. Существует два типа нуклеиновых кислот — дезоксирибонуклеиновые (ДНК) и рибонуклеиновые (РНК). Мономерами в нуклеиновых кислотах служат нуклеотиды
|
10. Нуклеиновым кислотам присущи три важнейшие функции: хранение, передача и реализация генетической информации. Кроме этих, они выполняют и другие функции, например, участвуют в катализе некоторых химических реакций, осуществляют регуляцию реализации генетической информации, выполняют структурные функции и др. Гено́м — совокупность всех генов организма; его полный хромосомный набор. Следовательно, под геномом организма понимают суммарную ДНК гаплоидного набора хромосом и каждого из внехромосомных генетических элементов, содержащуюся в отдельной клетке зародышевой линии многоклеточного организма. некодирующие участки получили название интронов, кодирующие - экзонов. Такой тип структурной организации обнаружен для множества генов, локализованных в хромосомах эукариот, для некоторых генов внутриклеточных органелл эукариот - пластид и митохондрий, а также для генов нескольких РНК-содержащих и ДНК-содержащих вирусов, поражающих эукариот. У бактерий интронов в генах нет. Нет интронов и в генах вирусов, поражающих бактерии. Некоторые гены содержат только один-два интрона, но часто их значительно больше. Интроны транскрибируются наравне с экзонами, так что про-мРНК содержит участки, транскрибированные как с экзонов, так и с интронов. В дальнейшем в ходе процессинга, происходящего в ядре, участки про-мРНК, соответствующие интронам, вырезаются, а бывшие разобщенными участки, считанные с экзонов, «сращиваются», и зрелая мРНК содержит только транскрипты экзонов. Интроны всегда (установлено для генов, кодирующих белки) имеют на 5'-конце пару последовательностей СТ, а на 3'-конце — AG. Последовательности нуклеотидов в экзонах консервативны, а в интронах сильно варьируют. 11. Ген — структурная и функциональная единица наследственности живых организмов. Ген представляет собой участок ДНК, задающий последовательность определённого полипептида либо функциональной РНК. Гены (точнее, аллели генов) определяют наследственные признаки организмов, передающиеся от родителей потомству при размножении. ДНК, выделенная из древнеегипетской мумии возрастом 4000 лет Секвенирование древней ДНК (от лат. sequentum «последовательность») — определение нуклеотидной последовательности применительно к молекулам ДНК, извлечённым из древних биологических образцов, таких как палеонтологические и археологические находки, мумифицированные останки, засохшие остатки растений, копролиты. Первым шагом является измельчение образца и выделение ДНК. В случае костных остатков используют пескоструйные пистолеты или специализированные дрели для первичной фрагментации. Далее частицы ещё более измельчаются (до порошкообразного состояния) на перемешивающих мельницах. Порошок последовательно обрабатывается набором реагентов и подвергается центрифугированию для очистки ДНК от минералов и прочих примесей[16]. Следующий этап — изготовление ДНК-библиотек и их обогащение путем гибридизации[17]. Непосредственное получение нуклеотидной последовательности осуществляется путем секвенирования нового поколения. Виды генных мутаций: 1. замена: а) одного нуклеотида на другой без изменения смысла кода ААГ = ААА (ЛИЗИН) (квазидуплетность) б) замена одного нуклеотида на другой с изменением смысла кодона - МИССЕНС-МУТАЦИЯ в) замена с образованием терминирующего кодона- НОНСЕНС-МУТАЦИЯ. 2. вставка: а) вставка одного или нескольких кодонов без сдвига рамки считывания. В результате образуется белок, удлинённый на одну или несколько аминокислот. б) вставка не кратного 3 нуклеотидов. Происходит сдвиг рамки считывания. В результате синтезируется белок со случайной аминокислотной последовательностью. 3. ДЕЛЕЦИЯ (выпадение): а) выпадение одного или нескольких кодонов без сдвига рамки считывания. Образуется укороченный белок. б) выпадение одного или нескольких (но не кратное 3) нуклеотидов со сдвигом рамки считывания. Образуется белок со случайной последовательностью аминокислот . |
|
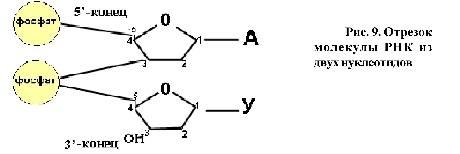
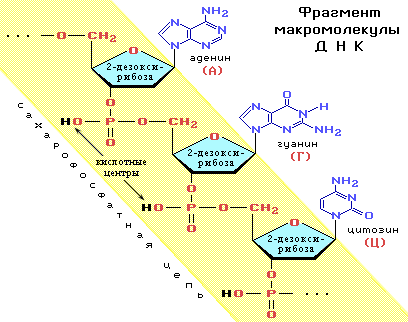
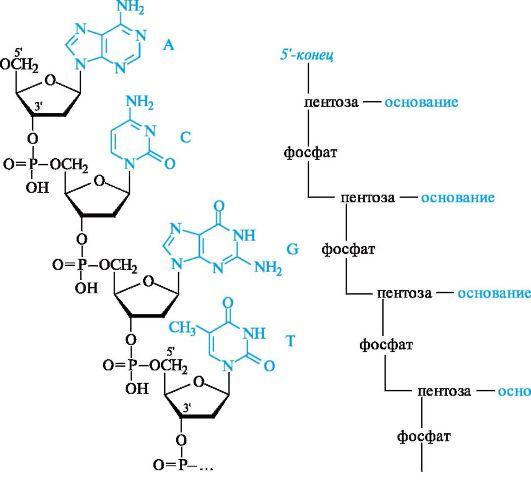
2. Строение полинуклеотидной цепи. Первичная структура. Первичная структура нуклеиновых кислот представляет собой набор нуклеотидных компонентов c последовательностью их чередования. В полинуклеотидных цепях нуклеотидные звенья связываются через фосфатную группу. Фосфатная группа образует две сложноэфирные связи: с С-3' предыдущего нуклеотидного звена и с С-5' последующего звена.
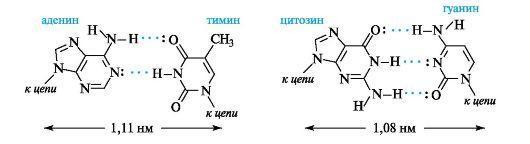
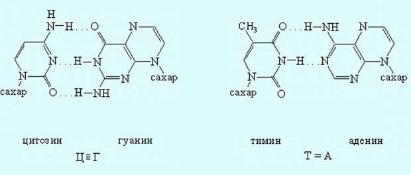
Пространственная организация цепи ДНК. Вторичная структура.Под вторичной структурой ДНК подразумевают пространственную организацию полинуклеотидной цепи. ве полинуклеотидные цепи антипараллельны друг другу, т.е. направления образования фосфодиэфирных связей в них противоположны: в одной цепи 5'-3', в другой - 3'-5'. Пуриновые и пиримидиновые основания направлены внутрь спирали. Между пуриновым основанием одной цепи и пиримидиновым основанием другой цепи возникают водородные связи. Эти основания составляют так называемые комплементарные пары.
|
12. Генетический код – это система записи наследственной информации в молекулах нуклеиновых кислот, основанная на определённом чередовании последовательностей нуклеотидов в ДНК или РНК, образующих кодоны, соответствующие аминокислотам в белке.
13. 1. ДНК-топоизомеразы, находясь перед репликативной вилкой, разрезают молекулу ДНК для облегчения ее расплетания и раскручивания. 2. ДНК-хеликазы, следуя за топоизомеразами, раскручивают и расплетают молекулу ДНК. 3. ДНК-связывающие белки (ДСБ) связывают расплетенные нити ДНК и стабилизируют их, не допуская обратного "слипания" друг с другом. 4. ДНК-полимераза δ (греч.: δ – дельта), согласовано со скоростью движения репликативной вилки, осуществляет синтез ведущей цепи дочерней ДНК в направлении 5'→3' на матрице материнской нити ДНК по направлению от ее 3'-конца к 5'-концу (скорость до 100 пар нуклеотидов в секунду). Этим события на данной материнской нити ДНК ограничиваются. Далее описан синтез отстающей цепи дочерней ДНК. 5. Непосредственно сразу после расплетания и стабилизации другой нити материнской молекулы к ней присоединяется ДНК-полимераза α (α- альфа ) и в направлении 5'→3' синтезирует праймер (РНК-затравку) – последовательность РНК на матрице ДНК длиной от 10 до 200 нуклеотидов. После этого фермент удаляется с нити ДНК. Вместо ДНК-полимеразы α к 3'-концу праймера присоединяется ДНК-полимераза ε. 6. ДНК-полимераза ε (греч.: ε – эпсилон) как бы продолжает удлинять праймер, но в качестве субстрата встраивает дезоксирибонуклеотиды (в количестве 150-200 нуклеотидов). В результате образуется цельная нить из двух частей – РНК (т.е. праймер) и ДНК. ДНК-полимераза ε работает до тех пор, пока не встретит праймер предыдущего фрагмента Оказаки (синтезированный чуть ранее). После этого данный фермент удаляется с цепи. 7. ДНК-полимераза β (греч.: β – бета) встает вместо ДНК-полимеразы ε, движется в том же направлении (5'→3') и удаляет рибонуклеотиды праймера, одновременно встраивая дезоксирибонуклеотиды на их место. Фермент работает до полного удаления праймера, т.е. пока на его пути не встанет дезоксирибонуклеотид (еще более ранее синтезированный ДНК-полимеразой ε). Связать результат свой работы и впереди стоящую ДНК фермент не в состоянии, поэтому он сходит с цепи. В результате на матрице материнской нити "лежит" фрагмент дочерней ДНК. Он называется фрагмент Оказаки. 8. ДНК-лигаза производит сшивку двух соседних фрагментов Оказаки, т.е. 5'-конца отрезка, синтезированного ДНК-полимеразой ε, и 3'-конца цепи, встроенного ДНК-полимеразой β. Репликация– это сложный процесс копирования (удвоения) ДНК, который обеспечивается генами самой ДНК. Репликация играет важную роль в прохождении таких процессов, как репарация, рекомбинация и транспозиция. |
|
3. Хроматин состоит преимущественно из скрученных нитей ДНК, связанных с основными белками (гистонами); его структура схематически представлена на рисунке. Главной структурной единицей хроматина является нуклеосома, которая состоит из сердечника, образованного четырьмя типами гистонов (по две молекулы каждого из гистонов Н2А, Н2В, Н3 и Н4), вокруг которого намотаны 166 пар оснований ДНК. Эухроматин соответствует менее скрученным участкам хромосом. Гетерохроматин обладает высокой электронной плотностью. Ген — это выраженный сегмент ДНК. Каждую минуту изо дня в день гены осуществляют один важный процесс — синтез протеинов (белков). Протеины — это молекулы, выполняющие разнообразные функции, имеющие решающее значение и касающиеся различных частей организма. Нуклеопротеины состоят из белков и нуклеиновых кислот. Последние рассматриваются как простетические группы. В природе обнаружено 2 типа нуклеопротеинов, отличающихся друг от друга по составу, размерам и физико-химическим свойствам,– дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП). Названия нуклеопротеинов отражают только природу углеводного компонента (пентозы), входящего в состав нуклеиновых кислот. У РНП углевод представлен рибозой, у ДНП – дезоксирибозой. Гистоны — обширный класс ядерных белков, выполняющих две основные функции: они участвуют в упаковке нитей ДНК в ядре и в эпигенетической регуляции таких ядерных процессов, как транскрипция, репликация и репарация. Негистоновые (кислые) белки. В хромосомах их количество приблизительно вдвое меньше гистоновых.
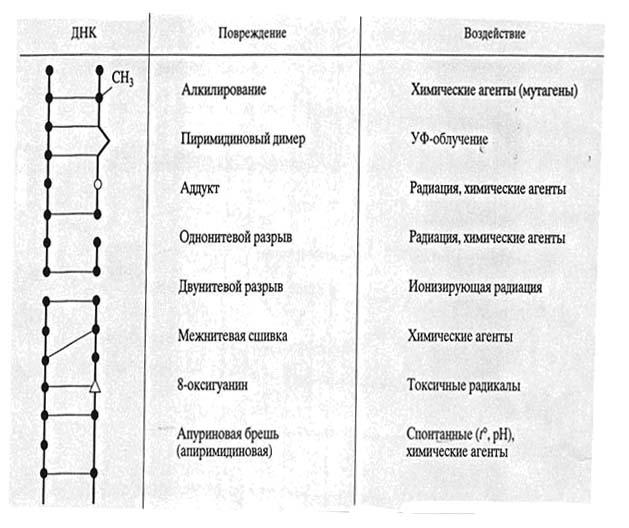
Прямая репарация — наиболее простой путь устранения повреждений в ДНК, в котором обычно задействованы специфические ферменты, способные быстро (как правило, в одну стадию) устранять соответствующее повреждение, восстанавливая исходную структуру нуклеотидов. Эксцизионная репарация включает удаление повреждённых азотистых оснований из ДНК и последующее восстановление нормальной структуры молекулы по комплементарной цепи. Ферментативная система удаляет короткую однонитевую последовательность двунитевой ДНК, содержащей ошибочно спаренные или поврежденные основания, и замещает их путём синтеза последовательности, комплементарной оставшейся нити. Пострепликативная репарация.Tип репарации, имеющей место в тех случаях, когда процесс эксцизионной репарации недостаточен для полного исправления повреждения: после репликации с образованием ДНК, содержащей повреждённые участки, образуются одноцепочечные бреши, заполняемые в процессе гомологичной рекомбинации при помощи белка RecA. |
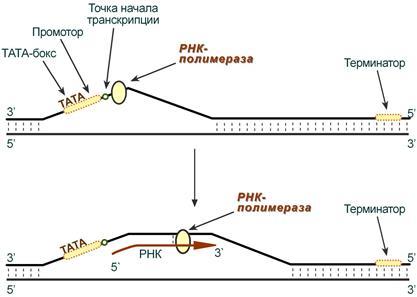
14. Транскри́пция (от лат. transcriptio — переписывание) —процесс синтеза РНК с использованием ДНК в качестве матрицы, происходящий во всех живых клетках. Другими словами, это перенос генетической информации с ДНК на РНК. В процессе транскрипции можно выделить четыре стадии: 1) Связывание РНК-полимеразы с промотором; 2) Инициация - начало синтеза. Она заключается в образовании первой фосфодиэфирной связи между АТФ или ГТФ и вторым нуклеотидом синтезирующейся молекулы и-РНК; 3) элонгация - рост цепи РНК, т. е. последовательное присоединение нуклеотидов друг к другу в том порядке, в котором стоят комплементарные нуклеотиды в транскрибируемой нити ДНК. Скорость элонгации достигает 50 нуклеотидов в секунду; 4) терминация - завершение синтеза и-РНК.
15. Рекогниция (распознавание) - узнавание между аминокислотами и их транспортной РНК. 2.АК + ТРНК аминоацил-т-РНК-синтетаза АК-ТРНК АТФАМФ + ФФ МЕТИОНИЛ-ТРНК РЕКОГНИЦИЯ происходит столько раз, сколько аминокислот входит в состав белка. Аминоацил-тРНК-синтетазы (АРС) - важнейшие ферменты внерибосомного этапа белкового синтеза, осуществляющие реализацию генетической информации. АРС активируют аминокислоты и присоединяют их к транспортным РНК (tРНК), которые садятся на mРНК в комплексе с рибосомой, на которой происходит полимеризация аминокислот (трансляция). Процесс аминоацилирования тРНК аминоацил-тРНК-синтетазами in vivo происходит в два этапа: вначале фермент активирует соответствующую аминокислоту с образованием 5'- аминоациладенилата, который затем атакуется 2'(3')-концом тРНК, что сопровождается возникновением соответствующей ковалентной связи между аминокислотой и тРНК. Нагруженные таким образом молекулы тРНК далее используются рибосомами в качестве субстратов при образовании пептидных связей. Функция тРНК заключается в переносе аминокислот из цитоплазмы в рибосомы, в которых происходит синтез белков. тРНК связывающие одну аминокислоту называются изоакцепторными. Всего в клетке одновременно существует 64 различных тРНК. Каждая тРНК спаривается только со своим кодоном.
|
|
4.
|
16. Рибозим,ферментативной РНК или каталитической РНК — это молекула РНК, обладающая каталитическим действием. Многие рибозимы естественного происхождения катализируют расщепление самих себя или других молекул РНК, кроме того образование пептидной связи в белках происходит при помощи рРНК рибосомы. В рамках исследований, посвященных происхождению жизни, удалось создать искусственные рибозимы типа РНК-полимеразы, способные при определенных условиях катализировать свою собственную сборку. Антибиотики действующие на рибосомы подавляют белковый синтез. Нарушение синтеза белка может происходить на всех уровнях, начиная с процесса считывания информации с ДНК и кончая взаимодействием с рибосомами – блокирование связывания транспортной т-РНК с 30S субъединицами рибосом (аминогликозиды), с 50S субъединицами рибосом (макролиды) или с информационной и-РНК (на 30S субъединице рибосом – тетрациклины). Хотя аминогликозидный антибиотик стрептомицин, неомицины и канамицин содержат в своем составе одну общую структурную группу, тем не менее все они связываются с рибосомами по-разному. В результате своеобразного действия стрептомицина рибосомы начинают неправильно считывать код. При этом неправильно считывается главным образом первое основание кодона. в группу антибиотиков действующих на рибосомы входят: – аминогликозиды,– макролиды,– тетрациклины,– фузидин, – линкомицин,– хлорамфеникол (левомицетин), нарушающий синтез белка микробной клеткой на стадии переноса аминокислот на рибосомы. 17. Фаза элонгации или удлинении пептида, включает в себя все реакции от момента образования первой пептидной связи до присоединения последней амк. Она представляет собой циклически повторяющиеся события, при которых происходит специфическое узнавание аминоацил –тРНК очередного кодона, находящегося в А-участке, комплементарное вз-е между антикодоном и кодоном. Фаза терминаци или завершения синтеза полипептида, связана с узнаванием специфическим рибосомным белком одного из терминирующих кодонов (УАА, УАГ, УГА), когда тот входит в зону входит А-участка рибосомы. При этом к последней амк в пептидной цепи присоединяется вода и ее карбоксильный конец отделяется от тРНК. В результате завершенная пептидная цепь теряет связь с рибосомой, которая распадается на две субчастицы. Посттрансляционное преобразование белков.Синтезированные в ходе трансляции пептидные цепи на основе своей первичной структуры приобретают вторичную и третичную, а многие четвертичную организацию, образуемую несколькими пептидными цепями. В зависимости от функций, выполняемых белками, их аминокислотные |
|
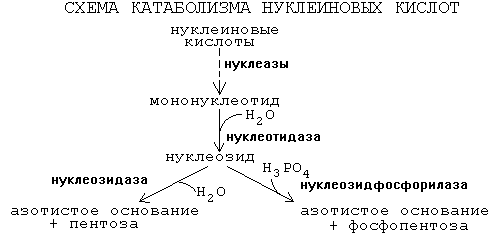
5. Нуклеозид может расщепляться путем гидролиза под действием фермента нуклеозидазы на азотистое основание и пентозу, но чаще происходит фосфоролиз - при этом нуклеозид расщепляется на азотистое основание и фосфорибозу.
Далее пентозы могут быть утилизированы во II-м этапе ГМФ-пути. Различия в катаболизме пуриновых и пиримидиновых азотистых оснований. Пиримидиновые азотистые основания подвергаются тотальному разрушению до СО2, Н2О и NH3. Пуриновые азотистые основания сохраняют циклическую структуру пурина. Конечный продукт: мочевая кислота - вещество пуриновой природы. |
последовательности могут претерпевать различные преобразования, формируя функционально активные молекулы белка. Многие мембранные белки синтезируются в виде пре-белков, имеющих на N-конце лидерную последовательность, которая обеспечивает им узнавание мембраны. Секреторные белки также имеют на N-конце лидерную последовательность, которая обеспечивает их транспорт через мембрану. Некоторые белки сразу после трансляции несут дополнительные аминокислотные про-последовательности, определяющие стабильность предшественников активных белков. При созревании белка они удаляются, обеспечивая переход неактивного пробелка в активный белок. Формируя третичную и четвертичную организацию в ходе посттрансляционных преобразований, белки приобретают способность активно функционировать, включаясь в определенные клеточные структуры и осуществляя ферментативные и другие функции. |
|
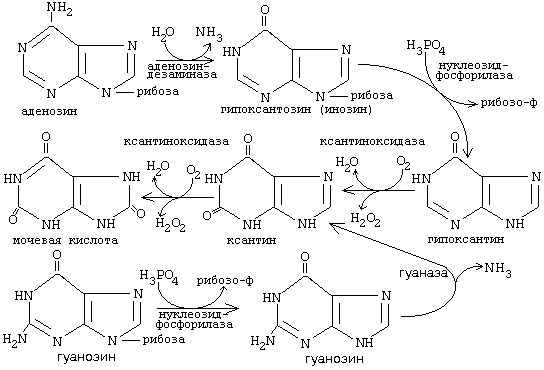
6. Распад начинается с отщепления аминогруппы (ее отщепление также возможно в составе ДНК).
При наследственном дефиците фермента аденозиндезаминазы наблюдается синдром врожденного иммунодефицита. Мочевая кислота выводится из организма с мочой - это обычный ее компонент, но в почках организма человека происходит ее интенсивная реабсорбция и концентрация мочевой кислоты в крови поддерживается на постоянном уровне 0.12-0.30 ммоль/л. Функции мочевой кислоты в крови: 1. Является мощным стимулятором центральной нервной системы - ингибирует фосфодиэстеразу цАМФ (посредник действия гормонов адреналина и норадреналина). Мочевая кислота пролонгирует (продлевает) действие этих гормонов на ЦНС. 2. Обладает антиоксидантными свойствами. при генетически обусловленном повышении содержания мочевой кислоты в крови. Это ведет к развитию заболеваний - МОЧЕКАМЕННОЙ БОЛЕЗНИ (при отложении кристаллов в почечной лоханке или в мочевом пузыре) и ПОДАГРЫ (при отложении солей мочевой кислоты в суставах). При лечении подагры используются ингибиторы фермента ксантиноксидазы, потому что гипоксантин лучше растворим в воде; соли лития, так как ураты лития лучше растворимы в воде: чем ураты натрия. Используется также диетическое питание, исключающее продукты, богатые нуклеиновыми кислотами, пуринами и их аналогами: икра рыб, мясо, кофе и чай. |
18. В клетках млекопитающих существуют два вида регуляции биосинтеза белков: - кратковременная, обеспечивающая адаптацию организма к изменениям окружающей среды; - длительная, стабильная, определяющая дифференцировку клеток и разный белковый состав органов и тканей. Регуляция на уровне транскрипции (образование первичного транскрипта) – наиболее распространенный механизм регуляции синтеза белков. Различают две формы регуляции – индукция синтеза (положительная регуляция) и репрессия синтеза (отрицательная регуляция). Понятия индукции и репрессии предполагают изменение скорости синтеза белка по отношению к исходному (базальному) уровню. Синтез в базальном состоянии называют конститутивным синтезом. Если скорость конститутивного синтеза белка высока, то белок регулируется по механизму репрессии синтеза, и, наоборот – при низкой базальной скорости бывает индукция синтеза. В генетическом аппарате клетки существуют опероны – отрезки ДНК, содержащие структурные гены определенных белков (цистроны), и регуляторные участки. Считывание генетического кода начинается с промотора, расположенного рядом с геном-оператором. Ген-оператор расположен на крайнем отрезке структурного гена. Он либо запрещает, либо разрешает репликацию мРНК на ДНК. Деятельность оперона контролирует ген-регулятор. Белок-репрессор осуществляет связь опероном и геном-регулятором. Репрессор образуется в рибосомах ядра на мРНК, синтезированной на гене-регуляторе. Он образует комплекс с геном-оператором и блокирует синтез мРНК, а, следовательно, и белка. Репрессор может связываться с низкомолекулярными веществами – индукторами, или эффекторами. После этого он теряет способность связываться с геном-оператором, ген-оператор выходит из-под контроля гена-регулятора, и начинается синтез мРНК. Это индукция синтеза (рис. 6). Наблюдается также эффект репрессии ферментов, когда концентрация ферментов в клетках снижается при увеличении содержания конечных продуктов цепи реакций синтеза (рис. 7). В этом случае репрессор синтезируется в неактивной форме и приобретают способность подавлять деятельность гена-оператора после образования комплекса с продуктом синтеза (корепрессором). Гормоны образуются в специализированных клетках желез внутренней секреции и с кровью разносятся по всему телу. Но регулируют они процессы синтеза РНК и белков лишь в так называемых клетках-мишенях. Гормоны связываются с белками-рецепторами, расположенными в мембранах таких клеток, и включают системы изменения структуры клеточных белков. Те в свою очередь могут влиять как на синтез белков на рибосомах, так и на транскрипцию определенных генов. Каждый гормон через систему посредников активирует свою группу генов. Так, например, адреналин включает синтез ферментов, расщепляющих гликоген мышц до глюкозы, а другой гормон – инсулин влияет на образование гликогена из глюкозы в печени.
|
|
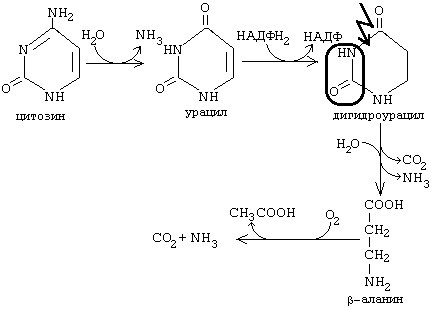
7. КАТАБОЛИЗМ ПИРИМИДИНОВЫХ АЗОТИСТЫХ ОСНОВАНИЙ Возможны несколько вариантов катаболизма. Разберем более простой вариант. Аминогруппа может отщепляться, когда азотистое основание еще находится в составе нуклеозида, мононуклеотида и даже в составе нуклеиновой кислоты. Но поскольку в организме урацил не входит в состав ДНК, то дезаминирование цитозина и превращение его в урацил воспринимается клеткой как ошибка и исправляется.
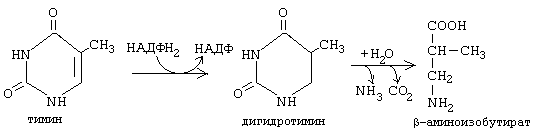
Бета-аланин обычно разрушается до CO2, H2O и NH3, но частично может использоваться для синтеза пептидов карнозина и ансерина в мышечной ткани и для синтеза КоА. Конечным продуктов распада пиримидиновых азотистых оснований можно считать и мочевину, которая образуется из аммиака по известному механизму, изложенному в лекциях по обмену белков. Тимин распадается подобно урацилу, но вместо бета-аланина образуется бета-аминоизобутират (альфа-метил-бета-аланин).
Бета-аминоизобутират выводится из организма и определение его количества в моче может использоваться для оценки катаболизма ДНК. 9. СИНТЕЗ ПУРИНОВЫХ МОНОНУКЛЕОТИДОВ Пуриновое кольцо строится из СО2, аспарагиновой кислоты, глутамина, глицина и серина. Эти вещества либо полностью включаются в пуриновую структуру, или передают для ее построения отдельные группировки. Глутамин отдает амидную группу и превращается в глутаминовую кислоту. Аспарагиновая кислота отдает аминогруппу и превращается в фумаровую кислоту. Глицин: 1) полностью включается в структуру пуринового азотистого основания; 2) является источником одноуглеродного радикала. Серин: тоже является донором одноуглеродного радикала. ФРПФ + глутамин -------> глутамат + ФФ + фосфорибозиламин Фермент, который катализирует эту реакцию, называется фосфорибозиламидотрансфераза. Он является ключевым ферментом синтеза всех пуриновых мононуклеотидов. Регулируется по принципу отрицательной обратной связи. Аллостерическими ингибиторами этого фермента являются АМФ и ГМФ. На второй стадии ФРПФ-амин взаимодействует с глицином. Третья стадия - включение углеродного атома, донором которого является глицин или серин. Затем достраивается шестичленный фрагмент пуринового кольца: 4-ая стадия - карбоксилирование с помощью активной формы СО2 при участии витамина Н - биотина. 5-ая стадия - аминирование с участием аминогруппы из аспартата. 6-ая стадия - аминирование за счет аминогруппы глутамина.
|
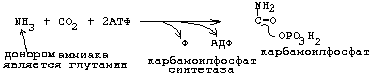
8. СИНТЕЗ ПИРИМИДИНОВЫХ МОНОНУКЛЕОТИДОВ.
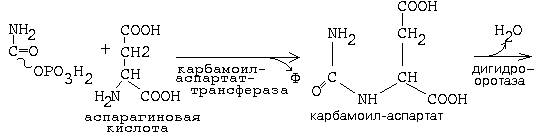
Образуется сначала циклическая структура азотистого основания, а затем присоединяется рибозо-фосфат. Первая реакция синтеза пиримидиновых монуклеотидов приводит к образованию карбамоилфосфата. Одна из молекул АТФ является донором фосфата.
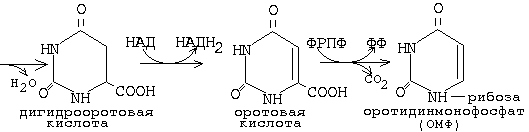
оротидинмонофосфат (ОМФ) является общим предшественником всех пиримидиновых мононуклеотидов.
Карбамоиласпартаттрансфераза является ключевым ферментом синтеза пиримидиновых мононуклеотидов. Ингибируется по принципу обратной связи ЦТФ, а активируется - АТФ. Благодаря такой регуляции достигается необходимый баланс между пуриновыми и пиримидиновыми мононуклеотидами - то есть происходит перекрестная регуляция. имидиновые мононуклеотиды необходимы для синтеза ДНК. Они должны содержать дезоксирибозу. В состав тимидина входит дезоксирибоза. Мононуклеотиды, содержащие дезоксирибозу синтезируются из рибонуклеотидов (содержащих рибозу). Субстратом для синтеза дезоксирибонуклеотидов является уридиндифосфат. Происходит восстановление рибозы в дезоксирибозу. Фермент, катализирующий реакцию превращения рибонуклеотида в дезоксирибонуклеотид, обладает специфичностью к дифосфатной форме. Источником протонов и электронов является НАДН2 , а переносятся они специальным белком - тиоредоксином, который затем способен восстанавливаться. У тимина имеется дополнительная метильная группа. Фермент, который переносит метильную группировку, специфичен к мононуклеотиду. Источником метильной группы является метилТГФК. На этот фермент направлено действие некоторых лекарственных препаратов. Ингибиторы этого фермента тормозят синтез ДНК опухолевых клеток. Для создания эффективных ингибиторов используются антивитамины ТГФК. При ингибировании превращения фолиевой кислоты в тетрагидрофолиевую замедляется синтез ДНК. |
|
|
|
|
9.7-ая, заключительная стадия - включение одноуглеродного фрагмента (с участием ТГФК).
Образуется пуриновая структура только на рибозо-фосфате. Предшественник всех пуриновых мононуклеотидов - инозинмонофосфат (ИМФ) или инозиновая кислота. Азотистое основание в ИМФ называется гипоксантин.
|
9.Активный С1 извлекается из глицина или серина с помощью фермента, в небелковой части которого содержится производное витамина Вc - фолиевой кислоты. Фолиевая кислота два раза восстанавливается в организме (к ней присоединяется водород). ИМФ превращается в АМФ: вместо ОН-группы появляется NH2-группа. Источником азота является аспарагиновая кислота, а для бразования ГМФ - глутамин. Другой способ синтеза пуриновых мононуклеотидов - повторная утилизация или реутилизация пуриновых азотистых оснований. |


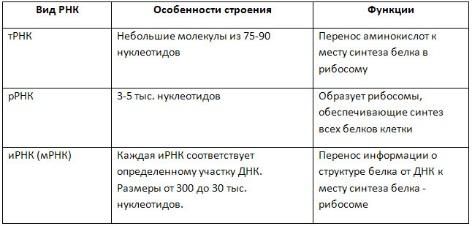 ирнк
в ядре и цитоплазме.трнк в цитопл.ррнк
в рибосомах.
ирнк
в ядре и цитоплазме.трнк в цитопл.ррнк
в рибосомах.