ответы на коллоки / бх коллок 4
.docx|
1.Функции белков. Структур.Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген, эластин, кератин, протеогликаны. Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности). К данной функции можно отнести участие в создании органелл – рибосомы. Ферментативная (Все ферменты являются белками. Но вместе с тем, имеются экспериментальные данные о существовании рибозимов, т.е. рибонуклеиновой кислоты, обладающей каталитической активностью. Гормональная(Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками. Рецепторная (Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. Транспортная (Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (транспорт кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы. Резервная (В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени. Сократительная (Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин). Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента (пропердин), при повреждении тканей работают белки свертывающей системы крови - например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны. Азотистый баланс- соответствие между количеством азота поглощённого органом и выделенного из него. Такое соответствие необходимо для устойчивого развития человека и животных. Например, организм взрослого человека в сутки должен потреблять 13—16 г азота, то есть 100 г белка. Полноценными считаются белки, включающие в состав восемь незаменимых аминокислот: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин. Неполноценные белки содержат недостаточное количество одной или нескольких аминокислот. Остаточный азот крови — это азот низкомолекулярных азотистых веществ крови, главным образом, продуктов обмена белков и нуклеиновых кислот.ПЕЧЕНЬ,ПОЧКИ болезни. |
10. Основными источниками аммиака являются следующие реакции: внутримолекулярное дезаминирование гистидина, катаболизм некоторых аминокислот (серина, треонина, глицина) – в печени, окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках, дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках, катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани, жизнедеятельность бактерий толстого кишечника, распад пуриновых и пиримидиновых оснований – во всех тканях.
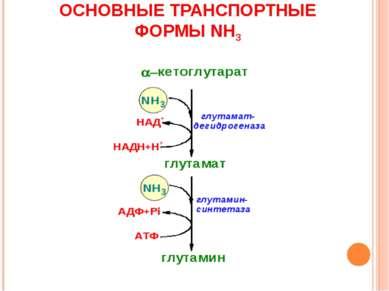
11. Так как аммиак является чрезвычайно токсичным соединением, то в тканях (!) существуют несколько реакций связывания (обезвреживания) аммиака – синтез глутаминовой кислоты и глутамина, синтез аспарагина, синтез карбамоилфосфата: синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком. Реакция по сути обратна реакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН. Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону α-кетоглутарата,
синтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях. Образование большого количества глутамина обеспечивает высокие концентрации его в крови (0,5-0,7 ммоль/л). синтез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи,
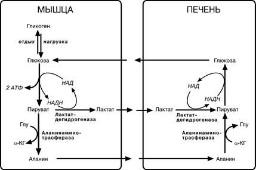
Глюкозо-аланиновый цикл функционирует в мышцах при голодании. При дефиците глюкозы, АТФ синтезируется за счет распад белков и катаболизма аминокислот в аэробных условиях, при этом глюкозо-аланиновый цикл обеспечивает: 1) удаление азота из мышц в нетоксичной форме; 2) синтез глюкозы (печень). |
|
2. Переваривание белков в желудке Хорошо известно, что в полости рта белки никаким изменениям не подвергаются вследствие отсутствия в слюне протеолитических ферментов. Переваривание белков начинается в желудке. Выделяют три основных фактора, обеспечивающих инициацию процесса переваривания: −стимуляция выделения гастрина присутствием белка пищи в желудке; −в свою очередь гастрин обеспечивает секрециюобкладочными клетками слизистой желудкасоляной кислоты; −секреция пепсиногена главными клеткамислизистой желудка. Желудочный сок характеризуется присутствием высокой концентрации HCl и, следовательно, низким значением рН (рН ≈ 2.0), а также наличием протеиназ семействапепсина. Высокая кислотность содержимого желудка имеет чрезвычайно важное физиологическое и биохимическое значение: −во-первых,сильно кислая среда обеспечивает набухание и денатурацию пищевых белков. При этом глобулярные белки утрачивают третичную структуру, вследствие чего внутренние петидные связи становятся доступными для действия протеиназ; −во-вторых,присутствие соляной кислоты обеспечивает инициацию аутокаталитического процесса превращения пепсиногена в пепсин и создает оптимальные условия для проявления его протеолитической активности. −наконец, высокая концентрация соляной кислоты препятствует развитию вполости желудка микрофлоры, действуя как антисептик, тем самым, предотвращая зарождение гнилостных процессов. вполость желудка соляная кислота связывается с катионитом, вытесняя хинин, который всасывается в кровь и выводится из организма с мочой. По количеству выделившегося хинина судят о содержании HCl в желудочном соке. Пепсин образуется главными клетками желудка в виде препепсина. Перевод препепсина в пепсин происходит путем отщепления 42 аминокислотных остатков. Процесс начинается под воздействием протонов водорода и идет медленно, а затем каждая активная молекула пепсина действует на неактивные молекулы, и этот процесс идет быстро. Таким образом, за короткое время в желудке образуется много активных молекул пепсина, которые расщепляют связи, образованные карбоксильными группами ароматических аминокислот (фенилаланина, тирозина и триптофана). Пепсин действует в сильно кислой среде при рН 1,5 - 2,5. Гастриксинобразуется в желудке, расщепляет связи, образованные карбоксильными группами дикарбоновых аминокислот (глутамата и аспартата), действует при рН 3,5. Показатели желу.сока:пепсин,ph,липаза,лабфермент,свобод.hcl,общ.кислот-ть. |
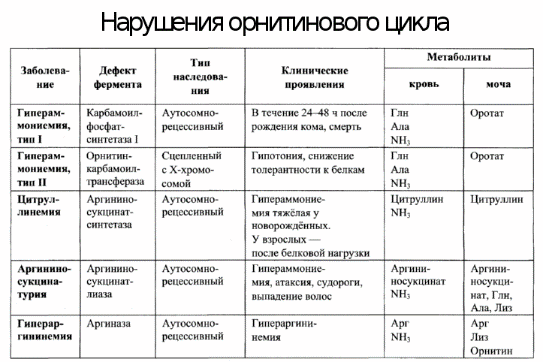
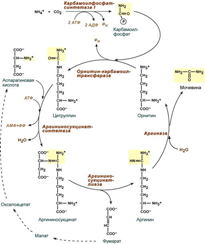
12. Реакции синтеза мочевины являются циклическим процессом и получили название орнитиновый цикл. Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики. В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ. Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
|
|
3. Переваривание белков в тонком кишечнике. Активация панкреатических зимогенов Как только кислое содержимое желудка попадает в тонкий кишечник, в нем под влиянием низкого pH начинается секреция гормона секретина, поступающего в кровь.Секретин, в свою очередь стимулирует выделение поджелудочной железой бикарбоната, что приводит к нейтрализации HCl желудочного сока. В результате pH резко возрастает от1,5-2,5до ~7,0. При нейтральном значении pH в тонком кишечнике продолжается переваривание белков под действием протеиназ поджелудочной железы. Секреция этих протеиназ стимулируется гормономхолецистокинином, продукция которого зависит от поступления в двенадцатиперстную кишку свободных аминокислот. Пищеварительный сок поджелудочной железы содержит большое количество проэнзимов эндопептидаз икарбоксипептидаз. Эти зимогены активируются только после того, как попадут в просвет тонкого кишечника. Ключевым ферментом, ответственным за их активацию, являетсяэнтерокиназа – протеиназа, продуцируемая эпителиальными клетками двенадцатиперстной кишки.Энтерокиназа активирует панкреатический трипсиноген посредством отщеплениягексапептида. Далее активный трипсин способен автокаталитически активировать другие молекулы трипсиногена. Более того, трипсин также действует на другие проэнзимы такие, как химотрипсиноген, проэластаза и прокарбоксипептидазы А и В (рис. 3.2). Поскольку трипсин играет роль общего мощного активатора панкреатических пищеварительных ферментов, в соке поджелудочной железы присутствует низкомолекулярный пептид,действующий как ингибитор трипсина и предотвращающий преждевременную активацию тех незначительных количеств трипсина, которые могут оказаться в клетках поджелудочной железы или ее протоках. Активация путем огранич.протеолиза.Несколько пептидаз, в том числе: энтеропептидаза — превращает неактивный трипсиноген в активный трипсин; аланинаминопептидаза — расщепляет пептиды, образовавшиеся из белков после действия протеаз желудка и поджелудочной железы. Полостное пищеварение происходит с помощью ферментов пищеварительных секретов, поступающих в полость тонкой кишки (поджелудочный сок, желчь, кишечный сок). В результате полостного пищеварения крупномолекулярные вещества (полимеры) гидролизуются в основном до стадии олигомеров. Дальнейший их гидролиз идет в зоне, прилегающей к слизистой оболочке и непосредственно на ней. Пристеночное пищеварение в широком смысле происходит в слое слизистых наложений, находящемся над гликокаликсом, зоне гликокаликса и на поверхности микроворсинок. Всасывание L-аминокислот (но не D) — активный процесс, в результате которого аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь. Известно пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот: 1. нейтральных, короткой боковой цепью (аланин, серии, треонин); 2. нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолейцин); 3. с катионными радикалами (лизин, аргинин); 4. с анионными радикалами (глутаминовая и аспарагиновая кислоты); 5. иминокислот (пролин, оксипролин). Существуют 2 основных механизма переноса аминокислот: симпорт с натрием и γ-глутамильный цикл. 1. Симпорт аминокислот с Na+. Симпортом с Nа+ переносятся аминокислоты из первой и пятой группы, а также метионин. γ-глутамильный цикл переносит некоторые нейтральные аминокислоты (фенилаланин, лейцин) и аминокислоты с катионными радикалами (лизин) в кишечнике, почках и, по-видимому, мозге. |
13. В норме этот показатель находится в пределах 40 - 60 мл/мин. Оба атома азота берутся из свободного аммиака и за счет дезаминирования аспартата, карбонильная группа — из гидрокарбоната.
|
|
4. Гниение белков в толстом кишечнике. Обезвреживание продуктов гниения в печени. Часть аминокислот не всасывается и подвергается процессам гниения с участием микрофлоры в толстом кишечнике. Продукты гниения аминокислот могут всасываться и попадают в печень, где подвергаются реакциям обезвреживания. За счет деятельности микрофлоры толстого кишечника а/к подвергаются гниению с образованием ядовитых продуктов: при распаде серусодержащих а/к (цистина, цистеина и метионина) образуются H2S и метилмеркаптан (CH3SH). Диаминокислоты, в частности орнитин и лизин, подвергаются декарбоксилированию с образованием протеиногенных аминов (трупных ядов). При разрушении фенилаланина, тирозина, триптофана, образуются соответствующие биогенные амины: фенилэтиламин, триптамин, серотонин. При разрушении этих же аминокислот могут образовываться крезол, фенол, скатол, индол, бензол. Все эти вещества гидрофобны и обладают мембранотропным действием (поражают мембраны клеток печени, эритроцитов, легких). Продукты распада аминокислот поступают в печень, где подвергаются детоксикации. В печени эти продукты обезвреживаются путемконъюгации с серной или глюкуроновой кислотой с образованием нетоксичных парных кислот (фенолсерная, скатоксилсерная). Пути утилизации аминокислот.Биосинтез белка (в основном);Синтез олигопептидов;Синтез биогенных аминов;NH3;Порфирины;Мочевина;Креатин, креатинфосфат;Азотистые основания;Холин, этаноламин;Аминоспирты (глюкозамин);Никотинамид;Гем;Гормоны;Глутатион;Желчные кислоты;Реакции обезвреживания и энергообмена. Каждые сутки в организм человека всасывается примерно 100 граммов аминокислот, которые поступают в кровь. Еще 400 граммов аминокислот поступает ежесуточно в кровь в результате распада собственных белков тела. Все эти 500 г аминокислот представляют собой метаболический пул аминокислот. Из этого количества 400 граммов используется для синтеза белков тела человека, а оставшиеся 100 г ежедневно распадаются до конечных продуктов: мочевины, CO2 . В процессе распада образуются также необходимые организму метаболиты, способные выполнять функции гормонов, медиаторов различных процессов и другие вещества (например: меланины, гормоны адреналин и тироксин).
|
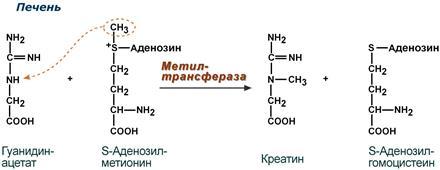
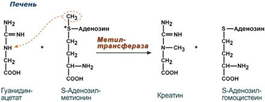
14.Участие аргинина в процессах мочевинообразования,синтез креатина и оксид азота. Превращение по NO-синтазному пути используется для образования оксида азота (NO), выполняющего функцию мессенджера. Аргинин используется в орнитиновом цикле мочевины, при синтезе креатина, выполяющего функцию запасного макроэрга.
. NO-синтаза – группа НАДФН-зависимых изоферментов, катализирующих сложную многоходовую реакцию окисления аргинина с образованием оксида азота (NO). Выделяют нейрональную, эндотелиальную и индуцируемую (в сердечно-сосудистой и иммунной системах) формы фермента. Оксид азота в организме выполняет множество функций, от регуляции тонуса сосудов до бактерицидного эффекта. После образования молекула NO при взаимодействии с супероксид анион-радикалом может превращаться в сильный окислитель пероксинитрит-анион. |
|
5. Значение аминокислот для организма в первую очередь заключается в том, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и внешней средой. Аминокислоты непосредственно участвуют в биосинтезе большого количества других биологически активных соединений, регулирующих процессы обмена веществ в организме, таких как нейромедиаторы и гормоны. Аминокислоты служат донорами азота при синтезе всех азотсодержащих небелковых соединений, в том числе нуклеотидов, гема, креатина, холина и др. Катаболизм аминокислот является источником энергии для синтеза АТФ. Энергетическая функция аминокислот становится значимой при голодании, некоторых патологических состояниях (сахарный диабет). Именно обмен аминокислот осуществляет взаимосвязь многообразных химических превращений в живом организме. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека составляет примерно 15 кг. Какой-либо специальной формы депонирования аминокислот и белков, подобно глюкозе или жирным кислотам не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Период полураспада белков различен – от нескольких минут до нескольких суток. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируется только углеродная часть молекулы, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи. |
15.
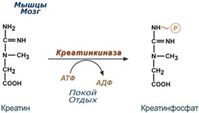
Креатин – вещество скелетных мышц, миокарда, нервной ткани. В виде креатинфосфатакреатин является "депо" макроэргических связей, используется для быстрого ресинтеза АТФ во время работы клетки. реатинфосфат обеспечивает срочный ресинтез АТФ в первые секунды работы (5‑10 сек), когда никакие другие источники энергии (анаэробный гликолиз, аэробное окисление глюкозы, β-окисление жирных кислот) еще не активированы, и кровоснабжение мышцы не увеличено. При мышечной работе ионы Са2+, высвободившиеся из саркоплазматического ретикулума, являются активаторами креатинкиназы. изоферменты (фракции) креатинкиназы: КК-МВ (сердечный изофермент, изменяющийся при повреждении клеток миокарда), КК-ВВ (мозговой изофермент, отражающий патологию клеток головного мозга), КК-ММ (мышечный изофермент, находящийся в скелетных мышцах). Повышение активности общей креатинкиназы наблюдается при повреждении любых вышеперечисленных клеток и поэтому не является специфичным. Наиболее часто значительное увеличение активности данного фермента отмечается при остром инфаркте миокарда При дистрофии скелет.мышц и тд. |
|
6. Трансаминирование — биохимическая ферментативная реакция обратимого переноса аминогруппы с аминокислотына кетокислоту без промежуточного образования аммиака. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот.
Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6). В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию. к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат. на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота,получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.При заб-ях печени(вирус.гепатиты) и инфаркт миокарда |
16. Биол.роль серосодержащих АК.Цистеин при окислении, декарбоксилировании, трансаминировании переходит в таурин и серную кислоту, входит в состав глютатиона, через стадию пирувата может использоваться для синтеза углеводов. Таурин используется на синтез парных жёлчных кислот и участвует в развитии нейросетчатки, головного мозга у плода и в раннем детском возрасте. Образующаяся серная кислота используется на синтез кислых гликозаминогликанов. В активной форме в виде ФАФС она участвует в обезвреживании токсичных продуктов в печени Метионин используется в многочисленных биосинтетических процессах: · синтез холина; · синтез тимина, с последующим включением его в ДНК; · синтез адреналина; · синтез карнитина – переносчика жирных кислот при их β - окислении; · синтез креатина – азотистого вещества мышц; · реакции обезвреживания; · донор серы. Гомоцистеинемия — накопление гомоцистеина в крови. Гомоцистеинемия считается фактором риска и обнаруживается в 30 % случаев атеросклероза, тромбозов, ишемической болезни сердца. Она выявляется при болезни Альцгеймера, нарушениях беременности — невынашивание, мертворождения. Все причины данного нарушения делят, как минимум, на две группы: 1. Наследственный дефект ферментов. Здесь расматривают три фермента — метионинсинтазу, цистатионин-синтазу, метилен-ТГФК-редуктазу. 2. Недостаточность витаминов В12, В6, В9, которые участвуют в метаболизме гомоцистеина. |
|
7. Окислительное дезаминирование — процессдезаминирования в печени, при котором образуются соответствующие карбоновые кислоты.
Биологическое значение реакций дезаминирования.1. Реакции дезаминирования необратимы, как и реакции декарбоксилирования - дезаминирование тоже может играть роль первого этапа на путях распада аминокислот. 2. Один из непосредственных продуктов дезаминирования -конечный продукт метаболизма аммиак. Это токсическое вещество. Поэтому клетки должны затрачивать энергию, чтобы обезвредить аммиак до безвредных продуктов, которые выводятся из организма. 3. Другой продукт реакции дезаминирования - альфа-кетокислота. Все образующиеся альфа-кетокислоты легко расщепляются дальше до СО2 и Н2О (например, аланин превращается в ПВК (путем дезаминирования; аспартат - в ЩУК; глутаминовая кислота - в альфа-кетоглутаровую). Оксидаза L-аминокислот.В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты . Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка. Оксидаза D-аминокислот также обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат |
17. Роль глутаминовой кислоты в обмене белков: она служит предшественником при синтезе биологически активных соединений, непосредственно или обеспечивая синтез незаменимых аминокислот. При введении глутаминовой кислоты устанавливается необходимое равновесие аминокислот, при котором наиболее эффективно осуществляется синтез белков и их использование. Глутаминовая кислота участвует в реакциях энергетического обмена. Об этом свидетельствует локализация значительного количества ее в митохондриях, а также способность последних активно окислять и воспроизводить глутамат. Включение глутаминовой кислоты в энергетический обмен осуществляется в основном путем переаминирования ее в а-кетоглутаровую кислоту с участием амино-трансфераз, коферментом для которых служит пиридоксальфосфат. Возможно также включение ее в цикл Кребса путем окислительного дезаминирования, катализируемого глутаматдегидрогеназой. В свежевыделенных митохондриях до 90% глутамата переаминируется в аспарагиновую кислоту и лишь 10% подвергается окислительному дезаминированию. Большое значение имеет реакция декарбоксилирования глутаминовой кислоты, катализируемая глутаматдекарбоксилазой (ГДК). |
|
8. Непрямое дезаминирование - это дезаминирование, которое происходит в 2 стадий с участием нескольких ферментов. Оно характерно для большинства АК, так как они не способны к прямому дезаминированию (нет ферментов). На первой стадии происходит одна и несколько реакций переаминирования с участием аминотрансфераз, в результате аминогруппа АК переходит на кетосоединение (α-КГ, ИМФ). На второй стадии происходит реакция дезаминирования аминосоединения (глу, АМФ), в результате чего образуется аммиак. Последовательность реакций непрямого дезаминирования зависит от набора ферментов в тканях.
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты. В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Можно выделить 4 стадии процесса:трансаминирование с α-кетоглутаратом, образование глутамата;трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата; гидролитическое дезаминирование АМФ. |
18.Пути превращения фенилаланина и тирозина в раздичных тканях.
Фенилкетонурия.В печени здоровых людей небольшая часть фенилаланина (до 10%) превращается в фениллактат и фенилацетилглутамин. Этот путь катаболизма фенилаланина становится главным при нарушении основного пути – превращения в тирозин, катализируемого фенилаланингидроксилазой. Ирозинемии.Наследственные нарушения метаболизма тирозина в печени. Известно два типа. I тип – дефект фермента фумарилацетоацетатгидроксилазы, из-за которого накапливаются в крови токсические метаболиты что приводит к тяжелому поражению печени и почек. При II типе нет фермента тирозинаминотрансферазы. Повышется концентрация тирозина, наблюдается гиперкератоз ладоней и подошв. Алкаптонурия.Причина заболевания – дефект диоксигеназы гомогентизиновой кислоты. Альбинизм.Обусловлен отсутствием тирозиназы и, соответственно, нарушается синтез пигментов меланинов. Клиническое проявление – отсутствие пигментации кожи и волос. Умственное развитие не страдает. У людей с альбинизмом повышенная склонность к солнечным ожогам.
|
|
9. Декарбоксилирование - Превращения аминокислот по карбоксильной группе. В тканях животных процесс декарбоксилирования аминокислот протекает под действием декарбоксилаз с образованием аминов. Декарбоксилазы аминокислот – сложные ферменты, коферментом которых является пиридоксальфосфат. Обнаружены процессы декарбоксилирования гистидина, триптофана, 5-гидрокситриптофана, тирозина, глутаминовой, аспарагиновой, цистеиновой кислот с образованием соответствующего амина: гистамина, триптамина, серотонина, тирамина, γ-аминомасляной кислоты, β-аланина, таурина. Их называют биогенными аминами, так как в малых дозах это биологически активные вещества с мощным фармакологическим действием, в больших дозах – фармакологические яды. Декарбоксилазы ароматических аминокислот, гистидина, глютаминовой кислоты и других не отличаются строгой специфичностью. Ферменты мало активны, и процесс протекает с малой скоростью. При декарбоксилировании тирозина образуется тирамин, проявляющий сосудосуживающее действие.
При декарбоксилировании производного триптофана - 5- гидрокситриптофана образуется 5- гидрокситриптамин или серотонин. Декарбоксилирование гистидина приводит к образованию гистамина.
ГАМК в большом количестве содержится в сером веществе мозга, в то время как в белом веществе мозга и периферической нервной системе ее почти нет. Является тормозным фактором в нервных клетках. В опытах с изолированной петлей кишечника показано, что ГАМК вызывает прекращение перистальтики даже в присутствии ацетилхолина, стимулирующего перистальтику. Используется в клинике при лечении заболеваний центральной нервной системы, связанных с резким возбуждением коры головного мозга (эпилепсия). МАО метаболизирует как эндогенные моноамины — нейромедиаторы и гормоны, так и экзогенные — попадающие в организм с пищей или в лекарствах и психоактивных веществах (ПАВ). Таким образом, этот фермент играет важную роль в поддержании постоянных концентраций эндогенных моноаминов в тканях, что особенно важно для нервной ткани. Диаминоксидаза (ДАО,DAO) – фермент, играющий ключевую роль в распаде гистамина, поступающего с пищей. Гистамин - это биогенный амин, синтезируется из аминокислоты гистидина в тучных клетках, базофилах, тромбоцитах и некоторых нейронах, где находится внутриклеточно в пузырьках, выделяется при стимуляции и является медиатором аллергических и псевдоаллергических реакций. Производные 2-пропиниламина являются специфическими ингибиторами отдельных изоферментов МАО в определенных диапазонах концентраций. хлоргилин.трибулин(ув.при стрессе и тревоге) |
|

 Мочевина —
допустимое значение 2,5—8,3 миллимолей
на литр.
Мочевина —
допустимое значение 2,5—8,3 миллимолей
на литр.