
- •10.Роль аденилатциклазной системы трансмембранной передачи гормонального сигнала.
- •11.Понятие о каскадном механизме усиления и подавления гормонального сигнала.
- •12.Роль ионов кальция в механизме гормональной регуляции.
- •13.Характеристика инозитолтрифосфатной системы трансмембранной передачи гормонального сигнала.
- •14.Рецептор инсулина и механизм действия инсулина.
- •15.Эйкозаноиды и их роль в регуляции метаболизма и физиологических функций.
- •16.Патологические состояния,связанные с гипер- и гипопродукцией гормонов.
|
1.Общее понятие о гормонах. Гормоны- это биологически активные вещества, выделяемые специальными эндокринными железами в ответ на специфические стимулы, которые секретируются в кровь и доставляются к тканям-мишеням, которые имеют специфические белковые молекулы-рецепторы к данному гормону, а рецепторы передают сигнал от первичного посредника или гормона внутрь клетки. Гормоны, органические соединения, вырабатываемые определенными клетками и предназначенные для управления функциями организма, их регуляции и координации.
|
|
||
|
2.Классификация гормонов по хим.строению и по био функциям.
|
|
||
|
Регулируемые процессы |
Гормоны |
||
|
Обмен углеводов, липидов, аминокислот |
Инсулин, глюкагон, адреналин, кортизол, тироксин, соматотропин |
||
|
Водно-солевой обмен |
Альдостерон, антидиуретический гормон |
||
|
Обмен кальция и фосфатов |
Паратгормон, кальцитонин, кальцитриол |
||
|
Репродуктивная функция |
Эстрадиол, тестостерон, прогестерон, гонадотропные гормоны |
||
|
Синтез и секреция гормонов эндокринных желёз |
Тропные гормоны гипофиза, либерины и статины гипоталамуса |
||
|
Изменение метаболизма в клетках, синтезирующих гормон |
Эйкозаноиды, гистамин, секретин, гастрин, соматостатин, вазоактивный интестинальный пептид (ВИП), цитокины |
||
|
3.Иерархия действия гормонов.
Гипоталамус Семейство гипоталамических гормонов – рилизинг-факторов – включает вещества, как правило небольшие пептиды, образующиеся в ядрах гипоталамуса. Их функция – регуляция секреции гормонов аденогипофиза: стимулирование – либерины и подавление – статины. Доказано существование семи либеринов и трех статинов. Тиреолиберин – является трипептидом, стимулирует секрецию тиреотропного гормона и пролактина, также проявляет свойства антидепрессанта. Кортиколиберин – полипептид из 41 аминокислоты, стимулирует секрецию АКТГ и ?-эндорфина, широко влияет на деятельность нервной, эндокринной, репродуктивной, сердечно-сосудистой и иммунной систем. Гонадолиберин (люлиберин) – пептид из 10 аминокислот, стимулирует высвобождение лютеинизирующего и фолликулостимулирующего гормонов. Гонадолиберин присутствует также в гипоталамусе, участвуя в центральной регуляции полового поведения. Фоллиберин – стимулирует высвобождение фолликулостимулирующего гормона. Пролактолиберин – стимулирует секрецию лактотропного гормона. Пролактостатин – предполагается, что он является дофамином. Снижает синтез и секрецию лактотропного гормона. Соматолиберин состоит из 44 аминокислот и повышает синтез и секрецию гормона роста. Соматостатин – пептид из 12 аминокислот, ингибирующий секрецию ТТГ, пролактина, АКТГ и СТГ из гипофиза. Он образуется также в островках поджелудочной железы и контролирует высвобождение глюкагона и инсулина, а также гормонов желудочно-кишечного тракта. Меланостимулирующий фактор, пентапептид, оказывает стимулирующее действие на синтез меланотропного гормона. Меланостатин, может быть как три-, так и пентапептидом, обладает антиопиоидным эффектом и активностью в поведенческих реакциях. Кроме рилизинг-гормонов в гипоталамусе синтезируются также вазопрессин (антидиуретический гормон) и окситоцин.
|
|
||
|
4.Клетки-мишени и клеточные рецепторы гормонов. Клетки-мишени - это клетки, которые специфически взаимодействуют с гормонами с помощью специальных белков-рецепторов. Эти белки-рецепторы располагаются на наружной мембране клетки, или в цитоплазме, или на ядерной мембране и на других органеллах клетки. Каждая клетка-мишень обладает наличием специфического рецептора к действию гормона, и часть рецепторов находится в мембране. Такой рецептор обладает стереоспецифичностью. У других клеток рецепторы расположены в цитоплазме – это цитозольные рецепторы, которые реагируют вместе с гормоном, проникающим внутрь клетки. Следовательно, рецепторы делятся на мембранные и цитозольные. Для того, чтобы клетка отреагировала на действие гормона необходимо образование вторичных посредников к действию гормонов. Это характерно для гормонов с мембранным типом рецепции. Разрушение циклического АМФ происходит под действием фермента фосфодиэстеразы. Циклический ГМФ оказывает противоположное действие. При активации фосфолипазы C образуются вещества, которые способствуют накоплению внутри клетки ионизированного кальция. Кальций активирует протеинциназы, способствует мышечному сокращению. Диацилглицерол способствует превращению фосфолипидов мембраны в арахидоновую кислоту, которая является источником образования простагландинов и лейкотриенов. Большинство рецепторов изучены недостаточно, потому что их выделение и очистка очень сложные, а содержание каждого вида рецепторов в клетках очень низкое. Но известно, что гормоны взаимодействуют со своими рецепторами физико-химическим путем. Между молекулой гормона и рецептором формируются электростатические и гидрофобные взаимодействия. При связывании рецептора с гормоном происходят конформационные изменения белка-рецептора и комплекс сигнальной молекулы с белком-рецептором активируется. В активном состоянии он может вызывать специфические внутриклеточные реакции в ответ на принятый сигнал. В зависимости от строения гормона существуют два типа взаимодействия. Если молекула гормона липофильна, (например, стероидные гормоны), то она может проникать через липидный слой наружной мембраны клеток-мишеней. Если молекула имеет большие размеры или является полярной, то ее проникновение внутрь клетки невозможно. Поэтому для липофильных гормонов рецепторы находятся внутри клеток-мишеней, а для гидрофильных - рецепторы находятся в наружной мембране. Для получения клеточного ответа на гормональный сигнал в случае гидрофильных молекул действует внутриклеточный механизм передачи сигнала. Это происходит с участием веществ, которых называют вторыми посредниками. Молекулы гормонов очень разнообразны по форме, а "вторые посредники" - нет. Существует два главных способа передачи сигнала в клетки-мишени от сигнальных молекул с мембранным механизмом действия:
Механизмы передачи информации от гормонов внутри клеток-мишеней с помощью перечисленных посредников имеют общие черты:
Гормоны являются основными гуморальными регуляторами физиологических функций организма, и в настоящее время хорошо известны их свойства, процессы биосинтеза и механизмы действия.
|
|
||
|
5.Синтез гормонов.Транспорт гормонов. 1. Белковые гормоны (белково-пептидные гормоны) образуются путем процессинга белковых предшественников (прогормонов) или даже препрогормонов. Как правило, синтез осуществляется в рибосомах шероховатого ретикулюма эндокринной клетки. Принцип синтеза таков — во внутреннем пространстве ретикулюма на рибосомах синтезируется препрогормон. Затем от него отщепляется 20—25 аминокислотных остатков и в таком виде образовавшийся прогормон отшнуровывается от ретикулюма в виде везикул или гранул и попадает в аппарат Гольджи. В этом аппарате содержимое гранул (везикул) высвобождается, происходит отщепление от прогормона лишних аминокислотных фрагментов и таким образом образуется гормон. Этот синтезированный гормон окружается мембранами и выносится в виде везикулы к плазматической мембране. По мере транспорта везикулы в ней происходит дозревание гормона, например, ацетилирование его конца. После слияния везикулы с плазматической мембраной происходит разрыв везикулы и излитие гормона в окружающую среду — происходит явление экзоцитоза. Вот пример синтеза инсулина: в результате рибосомального синтеза на мембранах шероховатого ретикулюма образуется пропроинсулин — 109 аминокислотных остатков; здесь же, в ретикулюме, от него отщепляется гидрофобный фрагмент, состоящий из 23 аминокислотных остатков, и остается проиисулин. Везикула с проинсулином переносится в аппарат Гольджи, где мембранная протеиназа выщепляет из молекулы проинсулина (1-86) фрагмент 31-65. В результате образуется инсулин — две цепи А и В, соединенные между собой двумя S-S мостиками. Здесь же в аппарате Гольджи заготовленная заранее везикула захватывает инсулин, а также ионы цинка. После присоединения везикулы к плазматической мембране ее содержимое — инсулин — выбрасывается в межклеточное пространство. Синтез молекулы происходит за 1—2 минуты, транспорт проинсулина от ретикулюма до аппарата Гольджи занимает 10—20 минут, а «созревание» везикул, несущих инсулин от аппарата Гольджи до плазматических мембран, происходит за 1—2 часа. В целом от начала синтеза белковых гормонов до момента их появления в местах секреции проходит 1—3 часа. Самое «узкое» место — это процесс секреции — процесс от эндо-плазматического ретикулюма до плазматической мембраны. Поэтому в основном регуляция уровня гормонов в крови осуществляется на этапах секреции, а не на этапах синтеза. Некоторые гормоны образуются из общего предшественника, например, АКТГ, МСГ, липотропины, эндорфины, энкефалины образуются из общего предшественника — пропио- омеланокортина. Поэтому индукция или репрессия синтеза этого предшественника сказывается одновременно на каждом из перечисленных гормонов. Белковые гормоны в силу их гидрофильности хорошо растворимы в крови и поэтому не требуют специальных переносчиков. Их разрушение в крови и тканях осуществляется с участием специфических протеиназ, содержащихся в клетках-мишенях, а также протеиназ жрови, печени, почек. Например, окситоцин разрушается окситоциназой. Полупериод жизни их в крови составляет 10—20 минут и меньше. 2. Синтез стероидных гормонов. Он осуществляется в клетках, начиная с подготовки холестерина, основного источника всех стероидов. В клетках-продуцентах стероидов имеется холестерин, который частично поступает из плазмы. Обычно холестерин связан с жирными кислотами. Поэтому первый этап синтеза — это отщепление жирных кислот, оно происходит под влиянием фермента холестеринэстеразы. Свободный холестерин поступает в митохондрии и здесь он превращается в прегненолон. В его образовании принимают 125 участие цитохром Р450, десмолаза и другие ферменты. Затем, образованный прегненолон поступает из митохондрий в эндоплазматический ретикулюм и микросомы. Здесь вначале образуется прогестерон, из которого с помощью различных ферментов образуются все сте-роидные гормоны. Один путь — это превращение прогестерона в кортикостерон и альдостерон. Второй путь — превращение прогестерона в кортизол, из которого образуются андрогены (тестостерон), которые в свою очередь превращаются в эстрогены. Суть всех превращений, начиная от процесса преобразования холестерина в прегненолон в митохондриях и последующих реакций в микросомах, заключается в гидроксилировании молекул стероидов. Эти процессы осуществляются специальными ферментами — гидроксилазами и оксидазами. Набор этих ферментов и определяет те стероидные гормоны, которые синтезируются в конкретной эндокринной клетке (глюкокортикоиды, минералокортикоиды, половые гормоны, прогестины). Интенсивность синтеза стероидных гормонов контролируется АКТГ и ЛГ, которые за счет изменения уровня цАМФ и (как следствие этого) повышения активности протеинкиназ активируют ферменты, участвующие в стероидогенезе, усиливая скорость образования соответствующих гормонов. Период полужизни в крови для стероидов примерно равен 0,5—1,5 часа. Транспорт осуществляется транскортином (для кортикостероидов), тестостерон-эстроген-связывающим глобулином. 3. Синтез катехоламинов. Он осуществляется за счет последовательного превращения аминокислоты тирозина в ДОФА (диоксифенилаланин), дофамин, норадреналин, адреналин. Превращение тирозина в ДОФА происходит в цитоплазме хромаффинной клетки под влиянием фермента тирозингидроксилазы. Это наиболее медленная стадия в биосинтезе катехоламинов. Инсулин, глюкокортикоиды, ацетилхолин повышают активность этого фермента и ускоряют процесс образования катехоламинов. Образовавшийся ДОФА в цитоплазме превращается в дофамин. Дофамин проникает в специально образованные гранулы (везикулы), в которых при наличии фермента дофамин-бета-оксидазы и кофакторов превращается в норадреналин. Из этих везикул норадреналин может выбрасываться в синаптическую щель (если речь идет о синапсе) или в цитоплазму. В цитоплазме с помощью фермента метилазы образуется адреналин, который поступает в специальные гранулы (везикулы) и с помощью этих гранул секретируется клеткой во внеклеточное пространство. Считается, что полупериод жизни катехоламинов в крови человека 1—3 минуты. Катехоламины в крови связываются белками и лишь 5—10% их находится в свободном состоянии. Благодаря этому белки выполняют функцию буфера, поддерживая на постоянном уровне концентрацию гормона в крови.
|
|
||
|
6.Механизм передачи гормонального сигнала через внутриклеточные рецепторы Передача сигнала гормонов с липофильными свойствами (стероидные гормоны) и тироксина возможна при прохождении их через плазматическую мембрану клеток-мишеней. Рецепторы гормонов находятся в цитозоле или ядре. Ядерные и цитозольные рецепторы содержат ДНК – связывающий домен. Последовательность событий, приводящих к активации транскрипции:
Эффекты гормонов, которые передают сигнал посредством внутриклеточных рецепторов, реализуются через определенный промежуток времени, так как на протекание матричных процессов (транскрипция и трансляция) требуется несколько часов.
|
|
||
|
7. ТРАНСМЕМБРАННАЯ ПЕРЕДАЧА СИГНАЛА. Важное свойство мембран - способность воспринимать и передавать внутрь клетки сигналы из внешней среды. "Узнавание" сигнальных молекул осуществляется с помощью белков-рецепторов, встроенных в клеточную мембрану клеток-мишеней или находящихся в клетке. Если сигнал воспринимается мембранными рецепторами, то схему передачи информации можно представить так:
Существует несколько механизмов трансмембранной передачи информации: с использованием аденилатциклазной системы, инозитолфосфатной системы, каталитических рецепторов, цитоплазматических или ядерных рецепторов.
Последовательность событий, приводящих к активации аденилатциклазы: Рецептор имеет два центра связывания: для гормона на наружной поверхности мембраны и для G-белка на внутренней поверхности мембраны.
белки по серину и треонину, в результате изменяются конформация и активность фосфорилированных белков, а это приводит к изменению скорости и направления регулируемых ими процессов в клетке.
|
|
||
|
8.Посредники реализации действия гормонального сигнала.(циклич.нуклеотиды и тд) цАМФ КАК ВТОРМЧНЫЙ ПОСРЕДНИК, ИЛИ ДЕЙСТВИЕ ГОРМОНОВ ЧЕРЕЗ АДЕНИЛАТЦИКЛАЗУ. Действие гормона начинается с его связывания со своим специфическим рецептором, расположенным на клеточной мембране. Выделяют два основных типа рецепторов: Rs (стимулирующий) и Ri ( ингибирующий).взаимодействие гормона с Rsприводит к активации АЦ и повышению уровня цАМФ, а связывание гормона с Ri сопровождается снижение уровня цАМФ вследствие ингибирования АЦ. Примером Rs могут служить бета -1 и бета-2 адренорецепторы, а Ri – льфа-2 адренорецепторы. Звеном, соединяющим рецептор с аденилатциклазой, являются G- или N-белки. Буквальное отражает их способность связывать гуаниловые нуклеотиды, ГТФ и ГДФ (N – от «нуклеотид» , G – от латинского написания гуанина ). Различают несколько типов G – белков, но лучше других охарактеризованы Gs и G1 ,которые соответственно стимулируют или ингибируют АЦ. Все G белки состоят из 3х разных суб единиц – альфа, бета, гамма. Т0000 В неактивном состоянии G белок ,а точнее его альфа суб»единица ,связана с ГД ,при связывании гормона с рецептором ГДФ замещается на ГТФ ,что приводит к диссоциации альфа – суб»единицы от бета – гамма – димера .в результате конформационных изменений комплекс альфа – суб»единица ГТФ связывается с АЦ и соответствующим образом меняет ее активность . альфа – суб»единица G – белка так же обладает ГТФазной активностью т.е. способностью расщеплять ГТФ на ГДФ и ФН . этот процесс сопровождается диссоциацией альфа суб»единицы от АЦ и возвращением ее к бета – гамма – димеру , т.е. прекращением передачи гормонального сигнала в клетку вплоть до взаимодействия рецептора с новой молекулой гормона. При некоторых заболеваниях наблюдается нарушение функционирования G – белков : коклюшный токсин препятствует замещению ГДФ на ГТФ , т.е. блокирует передачу сигнала на АЦ и образованием цАМФ ; холерный токсин ингибирует ГТФазную активность G – белка, поддерживая тем самым высокий уровень цАМФ даже в отсутствии гормона. Этанол и кокаин вызывают нарушения в количестве и функционировании G белков. При некоторых опухолях встречаются мутации на участках, ответственных за ГТФазную активность, что проявляется постоянной активацией АЦ. Дефицит G1 наблюдается при экспериментальном сахарном диабете. При сердечной недостаточности обнаружено уменьшение Gs белков и увеличение G1-белков. Глюкокортикоиды способны повышать синтез Gs-белка, а значит, и уровень цАМФ. При получении стимулирующего сигнала АЦ нарабатывает цАМФ, который активирует цАМФ - зависимую протеинкиназу (ПК А). Неактивная протеинкиназа ПК А состоит их двух каталитических (С) и двух регуляторных ( R) суб единиц. Связывание цАМФ с регуляторными суб единицами приводит к образованию активного димера, состоящего из каталитических суб единиц. Активная ПК А фосфорилирует определенные белки по остаткам серина или треонина, значительно меняя их активность. Таким образом реализуется действие гормона на клетку. Этими белками могут быть, на пример, тканевая липаза, или киназа фосфорилазы В, повышающие при этом свою активность при фосфорилировании. При прекращении действия гормона на клетку и диссоциации его от рецептора G-белок расщепляет ГТФ и уже не активирует АЦ. Имеющийся в летке цАМФ под действием фосфодиэстеразы цАМФ распадается до функционально неактивного АМФ. Некоторые препараты, в первую очередь метилированные производные ксантина, например, кофеин, теофиллин, теобромин, ингибируют ФДЭ, увеличиваю уровень цАМФ, тем самым воспроизводя и усиливая действие гормонов. Фосфопротеины дефосфорилируются под действием фосфопротеинфосфатаз, переходя в исходное Состояние. ИОНЫ Са КАК ВТОРИЧНЫЙ ПОСРЕДНИК ГОРМОНОВ. Концентрация ионов Са вне клетки – 10 моль, а в клетке – 10 моль. Несмотря на этот десятитысячный концентрационный градиент, уровень Са в клетке поддерживаеться на определенном уровне благодаря следующим механизмам : 1) В покое ионы Са могут поступать в клетку пассивной дифузией по градиенту концентрации.2) При изменении электрического потенциала клетки, при действии некоторых гормонов открываються ссответственно потенциал-зависимые и рецептор-зависимые кальциевые каналы (н-р, в сердце есть только потенциал-зависимые каналы, а в тромбоцитах – только рецептор зависимые). 3)Ряд гормонов может повышать активность Na/ Ca – обменника,который может работать в обоих направлениях, обменивая на 3 иона Na 1 ион Са. 4)Меанизмом обеспечивающим выведенеие Са из циозоля в обмен на 2 протона, являеться Са - АТФааа. Она находиться в цитоплазматической мембране, а так же в мембране эндоплазматического ретикулума и митихондоии. Т.о., этот насос откачивает ионы Са либо во внеклеточную жидкость, либо во внутриклеточные депо Са, которыми являються цистерны эндоплазматического ретикулума и МХ. Механизм действия гормонов через ионы Са можно представить следующим образом. Взаимодействие гормона со своим рецептором приводит к повышению концентрации ионов Са в цитоплазме и связыванию их с кальмодулином (КМ). Кальмодулин – это ниакомолекулярный регуляторный белок, который связывает 4 иона Са и переходит при этом в активное состояние. Са-КМ повышает активность многих процессов : Повышение уровня ионов Са в клетке может происходить и при его высвобождении из внутриклеточных депо под действием вторичных посредников липидной природы. В этом случае ионы Са выступают уже в роли третичного посредника. ВТОРИЧНЫЕ ПОСРЕДНИКИ ЛИПИДНОЙ ПРИРОДЫ (ДАГ И ИФЗ). Предшественником их является фосфатидилинозитол(ФИ), находящийся во внутреннем слое цитоплазматической мембраны. Предварительно фосфатидилинозитол фосфорилируеться специфической протеинкиназой сначала до фосфатидилинозитол-4-фосфата и далее- до фосфатидилинозитол-4,5-дифосфата. Во втором 2-м положении этих фосфатидилинозитолом находиться арахидоновая кислота. Схема образования липидных посредников выглядит следующим образом: Гормон связывается с рецептором, сигнал которого активирует фосфолипазу С. Она гидролизует фосфатидилинозитолдифосфат на инозитолтрифосфат (ИФз) и диацилглицерол (ДАГ), которые и являются гормональными посредниками липидной природы. Гидрофильный Ифз легко перемещаеться по цитоплазме, связываеться со спецефическими рецепторами на поверхности внутреклеточного депо Са, ионы Са при этом выходят в цитоплазму и активируют КМ-зависимые ферменты.(в том числе ПК С. В данном случае ионы Са можно рассматривать уже как третичный посредник тех гормонов, которые вызывают образование Ифз и ДАГ) Липофильный ДАГ активирует ПК С (изменяя ее чувствительность к ионам Са и фосфатидилсерину). ПК С фосфорилирует ключевые белки: рецепторы, ионные каналы, ферменты в цитоплазме и ядре, отвечая, таким образом, за регуляцию ряда клеточных функций: рост, деление, дефференцировка, экспрессия генов, метаболизм, секреция и др. Через (Са-фосфолипид-сигнальную систему) действуют некоторые ростовые факторы и онкогены, нейромедиаторы и многие гормоны. Н-р, вазопрессин, взаимодействует с V1-рецепторами в печени и галдкомышечных клетках кровеносных сосудов. Адреналин, связываясь с альфа-1-адренорецепторами, также вызывает образование липидных посредников.
|
|
||
9.Структурно-функциональная организация G-белков.
-белки (ГТФ-связывающие белки) — универсальные посредники при передаче сигналов от рецепторов к ферментам клеточной мембраны, катализирующим образование вторичных посредников гормонального сигнала. G-белки - олигомеры, состоящие из α, β и γ-субъединиц. Состав димеров βγ незначительно различаются в разных тканях, но в пределах одной клетки все G-белки, как правило, имеют одинаковый комплект βγ-субъединиц. Поэтому G-белки принято различать по их α-субъединицам.. Выявлено 16 генов, кодирующих различные α-субъединицы G-белков. Некоторые из генов имеют более одного белка, вследствие альтернативного сплайсинга РНК.
Каждая α-субъединица в составе G -белка имеет специфические центры:
• связывания ГТФ или ГДФ;
• взаимодействия с рецептором;
• связывания с βγ-субъединицами;
• фосфорилирования под действием протеинкиназы С;
• взаимодействия с ферментом аденилатциклазой или фосфолипазой С.
В структуре G -белков отсутствуют α-спиральные, пронизывающие мембрану домены. G -белки относят к группе «заякоренных» белков
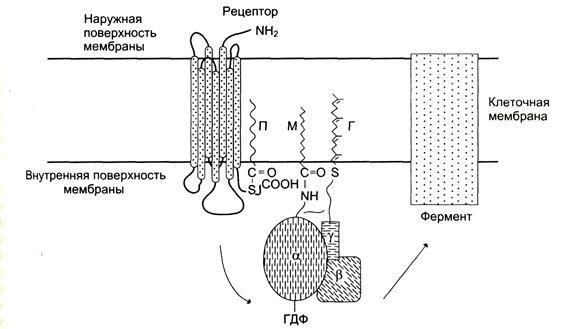
Положение G-белков в мембране.Для ассоциации G-белков важно ацилирование α-протомеров алифатическими радикалами жирных кислот, миристиновой кислоты (М) или изопреновой. γ-Субъединица G-белка имеет геранил-геранильную группу (Г), связанную тиоэфирной связью с остатком цистеина С-конца.
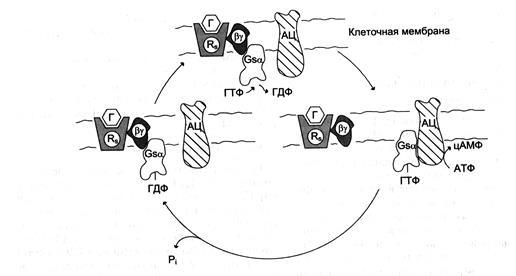
Цикл функционирования G-белка.Rs — рецептор; Г — гормон; АЦ — аденилатциклаза.
G-белки (ГТФ-связывающие белки) — универсальные посредники при передаче сигналов от рецепторов к ферментам клеточной мембраны, катализирующим образование вторичных посредников гормонального сигнала. G-белки - олигомеры, состоящие из α, β и γ-субъединиц. Состав димеров βγ незначительно различаются в разных тканях, но в пределах одной клетки все G-белки, как правило, имеют одинаковый комплект βγ-субъединиц. Поэтому G-белки принято различать по их α-субъединицам.. Выявлено 16 генов, кодирующих различные α-субъединицы G-белков. Некоторые из генов имеют более одного белка, вследствие альтернативного сплайсинга РНК.
Каждая α-субъединица в составе G -белка имеет специфические центры:
• связывания ГТФ или ГДФ;
• взаимодействия с рецептором;
• связывания с βγ-субъединицами;
• фосфорилирования под действием протеинкиназы С;
• взаимодействия с ферментом аденилатциклазой или фосфолипазой С.
В структуре G -белков отсутствуют α-спиральные, пронизывающие мембрану домены. G -белки относят к группе «заякоренных» белков (рис. 5-34).
Регуляция активностиG -белков
Различают неактивную форму G -белка - комплекс αβγ-ГДФ и активированную форму αβγ -ГТФ. Активация G-белка происходит при взаимодействии с комплексом активатор-рецептор, изменение конформации G-белка снижает сродство α-субъединицы к молекуле ГДФ и увеличивает к ГТФ. Замена ГДФ на ГТФ в активном центре G-белка нарушает комплементарность между α-ГТФ и βγ-субъединицами. Рецептор, связанный с сигнальной молекулой, может активировать большое количество молекул G-белка, таким образом обеспечивая усиление внеклеточного сигнала на этом этапе (рис. 5-35).
10.Роль аденилатциклазной системы трансмембранной передачи гормонального сигнала.
Аденилатциклазная система
При участии аденилатциклазной системы реализуются эффекты сотни различных по своей природе сигнальных молекул - гормонов, нейромедиаторов, эйкозаноидов.
Функционирование системы трансмембранной передачи сигналов обеспечивают белки: Rs-рецептор сигнальной молекулы, которая активирует аденилатциклазу, и Ri-рецептор сигнальной молекулы, которая ингибирует аденилатциклазу; Gs-стимулирующий и Gj-ингибирующий аденилатциклазу белки; ферменты аденилатциклаза (АЦ) и протеинкиназа А (ПКА).
Последовательность событий, приводящих к активации аденилатциклазы:
-
связывание активатора аденилатциклазной системы, например гормона (Г) с рецептором (Rs), приводит к изменению конфор-мации рецептора и увеличению его сродства к Gs-белку. В результате образуется комплекс [Г][R][О-ГДФ];
-
присоединение [Г][R] к G-ГДФ снижает сродство α-субъединицы Gs -белка к ГДФ и увеличивает сродство к ГТФ. ГДФ замещается на ГТФ;
-
это вызывает диссоциацию комплекса. Отделившаяся субъединица α, связанная с молекулой ГТФ, обладает сродством к адени-латциклазе:
[Г][R][0-ГТФ] → [Г][R] + α-ГТФ + βγ;
-
взаимодействие α-субъединицы с аденилатциклазой приводит к изменению конфор-мации
-
фермента и его активации, увеличивается скорость образования цАМФ из АТФ;
-
конформационные изменения в комплексе [α-ГТФ][АЦ] стимулируют повышение ГТФ-фосфатазной активности α-субъединицы. Протекает реакция дефосфорилирования ГТФ, и один из продуктов реакции - неорганический фосфат (Pi) отделяется от α-субъединицы, а комплекс [α-ГДФ] сохраняется; скорость гидролиза определяет время проведения сигнала;
-
образование в активном центре α-субъединицы молекулы ГДФ снижает его сродство к аденилатциклазе, но увеличивает сродство к βγ-субъединицам. Gs-белок возвращается к неактивной форме;
-
если рецептор связан с активатором, например гормоном, цикл функционирования Gs белка повторяется.
11.Понятие о каскадном механизме усиления и подавления гормонального сигнала.
Каскадный механизм усиления и подавления сигнала. Передача сигнала от мембранного рецептора через G-белок на фермент аденилатциклазу служит примером каскадной системы усиления этого сигнала. Одна молекула, активирующая рецептор, может "включать" несколько G-белков, и затем каждый активирует несколько молекул аденилатциклазы с образованием тысяч молекул цАМФ. На этом этапе сигнал усиливается в 102-103 раз. Образующийся цАМФ "включают" другой фермент - протеинкиназу А, усиливая сигнал ещё в 1000 раз. Фосфорилирование ферментов протеинкиназой А ещё больше усиливает сигнал, в результате суммарное усиление равно 106-107 раз. Таким образом, по механизму каскадного усиления одна молекула регулятора способна изменить активность миллионов других молекул.
12.Роль ионов кальция в механизме гормональной регуляции.
Концентрация ионов Са вне клетки – 10 моль, а в клетке – 10 моль. Несмотря на этот десятитысячный концентрационный градиент, уровень Са в клетке поддерживаеться на определенном уровне благодаря следующим механизмам : 1) В покое ионы Са могут поступать в клетку пассивной дифузией по градиенту концентрации.2) При изменении электрического потенциала клетки, при действии некоторых гормонов открываються ссответственно потенциал-зависимые и рецептор-зависимые кальциевые каналы (н-р, в сердце есть только потенциал-зависимые каналы, а в тромбоцитах – только рецептор зависимые). 3)Ряд гормонов может повышать активность Na/ Ca – обменника,который может работать в обоих направлениях, обменивая на 3 иона Na 1 ион Са. 4)Меанизмом обеспечивающим выведенеие Са из циозоля в обмен на 2 протона, являеться Са - АТФааа. Она находиться в цитоплазматической мембране, а так же в мембране эндоплазматического ретикулума и митихондоии. Т.о., этот насос откачивает ионы Са либо во внеклеточную жидкость, либо во внутриклеточные депо Са, которыми являються цистерны эндоплазматического ретикулума и МХ.
Механизм действия гормонов через ионы Са можно представить следующим образом. Взаимодействие гормона со своим рецептором приводит к повышению концентрации ионов Са в цитоплазме и связыванию их с кальмодулином (КМ). Кальмодулин – это ниакомолекулярный регуляторный белок, который связывает 4 иона Са и переходит при этом в активное состояние. Са-КМ повышает активность многих процессов :
Повышение уровня ионов Са в клетке может происходить и при его высвобождении из внутриклеточных депо под действием вторичных посредников липидной природы. В этом случае ионы Са выступают уже в роли третичного посредника.



