
охт (6sem) / методички митхт / Graphical schemes of CTS
.pdfУчебное пособие
Кононова Галина Николаевна, Цыганков Владимир Николаевич.
Графические изображения химико-технологических систем.
ЛР Код 221. Серия ИД №03507
Сдано в печать 2007. Формат 60х90/16 Бум. офсетн. Печать офсетн. Уч. изд. л. 1,6. Тир. 100 экз. Заказ № 4 8
117571, Москва, ИПЦ МИ'ГХТ им. М. В. Ломоносова.
Проспект Вернадского, 86.
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Московская государственная академия тонкой химической технологии им. М. В. Ломоносова
Кафедра Общей химической технологии
Г. Н. Кононова, В. Н. Цыганков
Графические изображения химико-технологических систем
Учебное пособие
Издание 2-ое, дополненное.
Москва 2007

УДК 66.01:66.047.6 + 303.732 Кононова Г. Н., Цыганков В. Н. Графические изображения
химико-технологических систем. Учебное пособие. – ИПЦ МИТХТ им. М. В. Ломоносова, 2007. – 20 с.
В учебное пособие вошли материалы для самостоятельной работы студентов направления бакалавриата: № 521500 «Менеджмент» по дисциплине «Основы системных закономерностей технологических процессов» и № 657100 «Прикладная математика».
Утверждено Библиотечно-издательской комиссией МИТХТ им. М. В. Ломоносова в качестве учебного пособия.
© Московская государственная академия тонкой химической технологии им. М. В. Ломоносова, 2007 г.
1.0 Разработка и построение функциональной схемы.
При разработке химико-технологических систем / ХТС / можно выделить два основных уровня:
1.Оценка химического взаимодействия, положенного в основу химико-технологического процесса / ХТП / - химическая концепция метода.
2.Организация ХТП в ХТС - технологическая концепция
метода.
Химическая концепция представляет собой обоснование / термодинамическое, кинетическое и физико-химическое / протекающих превращений, дает оценку максимальным возможностям разрабатываемого метода, а также накладывает соответствующие ограничения на параметры процесса, качество сырья и продукта, вспомогательные материалы и т.п. На ее основе рождается химическая схема процесса - схема превращения сырья в целевые продукты. Для реализации этого превращения необходима соответствующая обработка сырья, а для выделения целевого продукта, его очистки, отделения от примесей и т.п. - применение соответствующих приемов и операций.
Для описания последовательности этих действий используются различные графические описания - схемы.
В качестве первого уровня наглядного изображения ХТС после разработки химической концепции метода является функциональная схема системы. Она показывает, какие технологические операции и в какой последовательности необходимо осуществить для реализации разработанного химического процесса в промышленном масштабе.
В самом обобщенном виде эта схема может быть представлена в виде классической триады химического производства / рис. 1.1 /.
Она представляет собой совокупность блоков, каждый из которых соответствует необходимой функции*), которую требуется реализовать. Связи между блоками обозначаются соответствующими стрелками, указывающими направления потоков.
Эта схема детализируется путем представления каждого макроблока в виде совокупности блоков, отвечающим определенным операциям / т.е. "функциям " - откуда и название
*) Функция – от латинского слова functio – деятельность, обязанность, назначение.
3
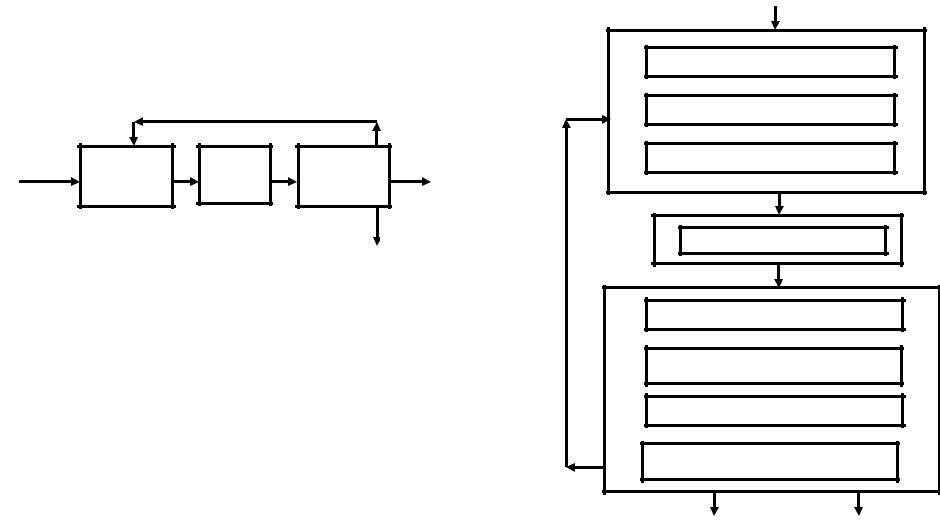
схемы /. Например подготовка сырья может быть представлена последовательными блоками: измельчения, рассева, смешения, нагрева; химическое превращение может включать разложение руды, экстракцию, синтез; разделение - ректификацию, конденсацию и сепарацию, фильтрацию, центрифугирование и т.п.
Непрореагировавшее сырье
Исходное |
1 |
2 |
3 |
Продукт |
|
|
|||
|
Подготовка |
Синтез |
Разделение |
|
сырье |
сырья |
|
|
|
|
|
|
|
|
|
|
|
|
Отходы |
Рис.1.1. Функциональная схема химического производства, 1,2,3 - подсистемы ХТС.
Уровень детализации схемы и, соответственно, количество блоков внутри каждой подсистемы определяется степенью отработки каждого этапа к моменту разработки схемы, а также поставленной задачей. На рис.1.2 представлена более детализированная функциональная схема условной ХТС.
Такая схема позволяет получить общее представление о функционировании ХТС и является предпосылкой для аппаратурного оформления системы и разработки технологической схемы.
Рассмотрим построение функциональной схемы на примере производства азотной кислоты. Соответствующая ей химическая схема может быть сведена к четырем основным стадиям:
1. |
Окисление аммиака |
|
|
4NH3 + 5O2 → 4NO + 6H2O |
∆H < 0 |
(1) |
|
2. |
Окисление NO в NO2 |
|
|
2NO + O2 ↔ 2NO2 |
∆H < 0 |
(2) |
|
3. |
Абсорбция нитрозных газов / смеси оксидов азота / |
||
водой |
|
|
|
3NO2 + H2O→ 2HNO3 + NO |
|
(3) |
|
4. |
Каталитическая очистка отходящих газов |
|
|
CH4 + 4NO → CO2 + 2N2 + 2H2О |
(4) |
||
4
Исходное сырье
Смешение
Сжатие
Нагревание
Синтез
Охлаждение
Конденсация
Сепарация
Ректификация
Продукт |
Отходы |
Рис.1.2. Функциональная схема ХТС.
При разработке химической концепции метода было установлено, что процесс окисления аммиака необходимо проводить на платиновом катализаторе при температурах 800900°С, давлении 0,8 МПа и мольном соотношении О2/NH3 = 1,7.
5

Следовательно, прежде, чем проводить окисление аммиака, необходимо: смешать аммиак со сжатым воздухом до соответствующих параметров; очистить исходные вещества от примесей из-за высокой чувствительности к ним платинового катализатора; нагреть исходную смесь до температуры, обеспечивающей проведение реакции в автотермическом режиме.
Окисление NO в NO2 - гомогенный, экзотермический процесс. Следовательно, полученные после окисления аммиака газы необходимо охладить, а после окисления NO в NO2 также необходимо охлаждение в соответствии с оптимальными условиями процесса абсорбции. При этом отделяется некоторое количество азотной кислоты, образовавшейся попутно из NO2 /реакция 2 / и H2O /реакция I/.
Поскольку абсорбция оксидов азота проходит не на 100 %, необходимо предусмотреть очистку отходящих газов от оксидов азота перед выбросом их в атмосферу.
На рис.1.3 приведена функциональная схема производства азотной кислоты.
Химическая система получения HNO3 имеет мощный источник энергии в виде тепловых эффектов реакций окисления аммиака и оксида азота (II). Высокопотенциальное тепло реакции окисления аммиака может быть использовано для производства пара в котле - утилизаторе /парогенераторе /, а пар может использоваться, например, для привода паровой турбины компрессора в цехе синтеза аммиака. Более низкопотенциальное тепло после окисления NO регенерируется путем подогрева входящих потоков /воздуха и газов после абсорбции/ отходящими после окисления NO нитрозными газами.
При очистке отходящих поcле абсорбции газов от оксидов азота температура потока составляет ≈ 700°С. Перед выбросом в атмосферу их тепловая энергия может быть превращена в механическую и использована для привода газовой турбины компрессора сжатия воздуха.
Таким образом, производство азотной кислоты является энерготехнологическим, поскольку в нем наряду с товарной азотной кислотой производится энергия, которая может быть использована в данном производстве или передана в другие цеха.
6
Рис.1. 3. Функциональная схема получения азотной кислоты.
Функциональная схема энерготехнологической системы производства азотной кислоты представлена на рис. 4.
Сравнивая две схемы / рис 1.3 и рис 1.4 / видно, как меняется функциональная схема по мере углубления степени проработки отдельных этапов процесса.
7
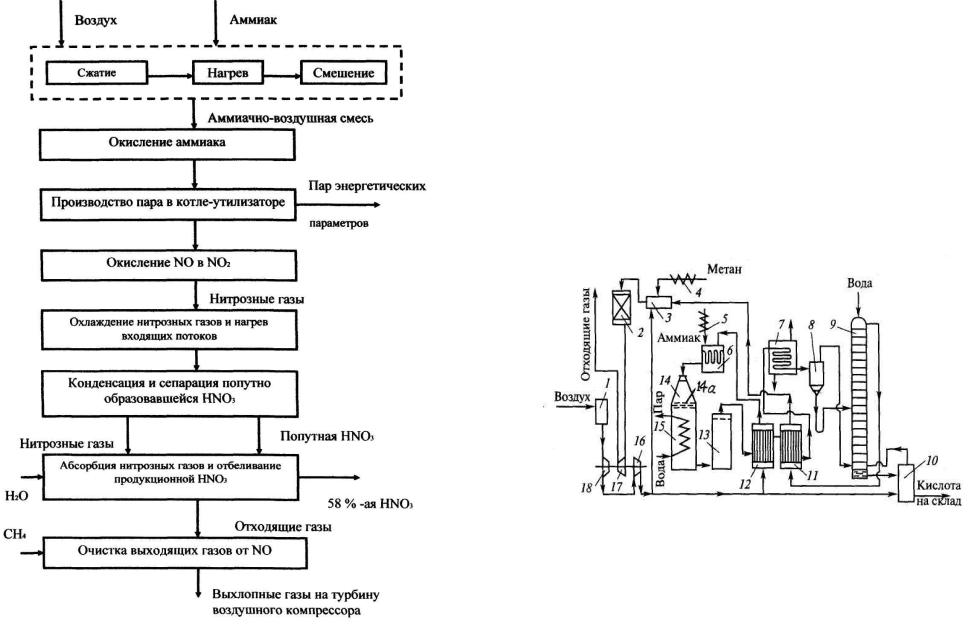
Рис.1. 4. Функциональная схема энерготехнологического производства HNO3.
8
2.0 Технологическая схема производства.
Технологическая схема ХТС дает наиболее полное качественное представление об еѐ организации. Каждый аппарат на ней представляется в виде условного стандартного изображения, а потоки (связи) - стрелками, соответствующими их направлению. Соотношение размеров аппаратов и расположение их на схеме соответствует реальному. При этом приводится спецификация оборудования. Иногда на этих схемах дается информация о составе потоков и технологических параметрах процесса, а также приводится схема автоматического контроля и регулирования.
Эти схемы наглядны и широко используются как на стадии проектирования, так и при эксплуатации ХТС.
На рис.2.1 приведена технологическая схема процесса производства азотной кислоты.
Рис. 2.1. Технологическая схема производства азотной кислоты под давлением 0,716 МПа с приводом компрессора от газовой турбины:
1 — фильтр воздуха, 2 — реактор каталитической очистки; 3 — топочное устройство: 4 — подогреватель метана; 5 — подогреватель аммиака; 6
— смеситель аммиака и воздуха с паралитовым фильтром; 7 — холодильник-конденсатор; 8 — сепаратор; 9 — абсорбционная колонна; 10 — продувочная колонна; 11 — подогреватель отходящих газов; 12 — подогреватель воздуха; 13 — сосуд для окисления нитрозных газов; 14 — контактный аппарат; 14а – катализатор; 15 — котел-утилизатор; 16, 18 — двухступенчатый турбокомпрессор: 17 — газовая турбина.
9
Воздух проходит очистку в фильтре 1. Очищенный воздух |
устройство (камера сжигания 3 установки каталитической |
сжимают двухступенчатым воздушным компрессором (16,18). |
очистки). Здесь газы нагреваются до температуры 390-450 °С за |
Основной поток воздуха после сжатия нагревают в |
счет горения природного газа, подогретого в подогревателе 4, и |
подогревателе воздуха 12 до 250-270°С теплотой нитрозных |
направляются в реактор с двухслойным катализатором 2. |
газов и подают на смешение с аммиаком в смеситель 6. |
Очистку осуществляют при 760°С. Очищенные газы поступают |
Газообразный аммиак, после очистки от влаги, масла и |
в газовую турбину 17 при температуре 690-700°С; энергия, |
катализаторной пыли через подогреватель 5 при температуре |
вырабатываемая турбиной за счет теплоты хвостовых газов, |
150°С также направляют в смеситель 6. После очистки |
используется для привода турбокомпрессора 18. Содержание |
аммиачно-воздушную смесь с содержанием NH3 не более 10% |
оксидов азота в очищенных выхлопных газах составляет 0,005- |
подают в контактный аппарат 14 на конверсию аммиака. |
0,008%, содержание СО2 - 0,23%. |
Конверсия аммиака протекает на платинородиевых сетках |
|
(14 а) при температурах 870-900ºС, причем степень конверсии |
|
составляет ≈ 96%. Нитрозные газы при 890-910°С поступают в |
|
котел-утилизатор 15, расположенный под контактным |
|
аппаратом. В котле за счет охлаждения нитрозных газов до |
|
170°С происходит испарение воды, питающей котел-утилизатор; |
|
при этом получают пар с давлением 1,5 МПа и температурой |
|
230°С. |
|
Нитрозные газы поступают в окислитель нитрозных газов |
|
13. Частично окисление нитрозных газов происходит уже в |
|
котле-утилизаторе (до 40%). В окислителе 13 степень окисления |
|
возрастает до 85%. За счет реакции окисления нитрозные газы |
|
нагреваются до 300-335°С. Эта теплота используется в |
|
подогревателе воздуха 12. Охлажденные в теплообменнике 12 |
|
нитрозные газы поступают в теплообменник 11, где происходит |
|
снижение их температуры до 150°С и нагрев выхлопных |
|
(хвостовых) газов до 110-125°С. Затем нитрозные газы |
|
направляют в холодильник-конденсатор 7. При этом |
|
конденсируются водяные пары, и образуется слабая азотная |
|
кислота. Нитрозные газы отделяют от сконденсировавшейся |
|
азотной кислоты в сепараторе 8, из которого азотную кислоту |
|
направляют в адсорбционную колонну 9 на 6-7-ю тарелку, а |
|
нитрозные газы - под нижнюю тарелку абсорбционной колонны. |
|
Кислота направляется в продувочную колонну 10, а отбеленная |
|
азотная кислота поступает на склад. Воздух после продувочной |
|
колонны подается в нижнюю часть абсорбционной колонны 9. |
|
Степень абсорбции оксидов азота достигает 99%. |
|
Выходящие из колонны хвостовые газы с содержанием оксидов |
|
азота до 0,11% при температуре 35°С проходят подогреватель |
|
11, где нагреваются до 110-145°С и поступают в топочное |
|
10 |
11 |
|
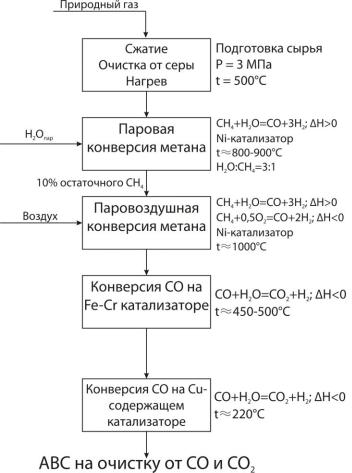
Рис.3.1 Функциональная и химическая схемы получения водородсодержащих газов
(в данном случае азотоводородной смеси для синтеза аммиака)
3.0 Функциональные схемы химических производств.
Из химической схемы вытекает:
1. Конверсию природного газа необходимо вести в две ступени: а. конверсия метана; б. конверсия СО.
2. Конверсию метана осуществляют, в свою очередь, в две ступени, вводя на второй ступени азот с воздухом.
3. Конверсию СО осуществляют в две ступени, в зависимости от условий используемого катализатора.
4. В связи с высокими температурами процесса, необходимо утилизировать тепло для производства пара и использовать подогрев входящих потоков отходящими.
12 |
13 |
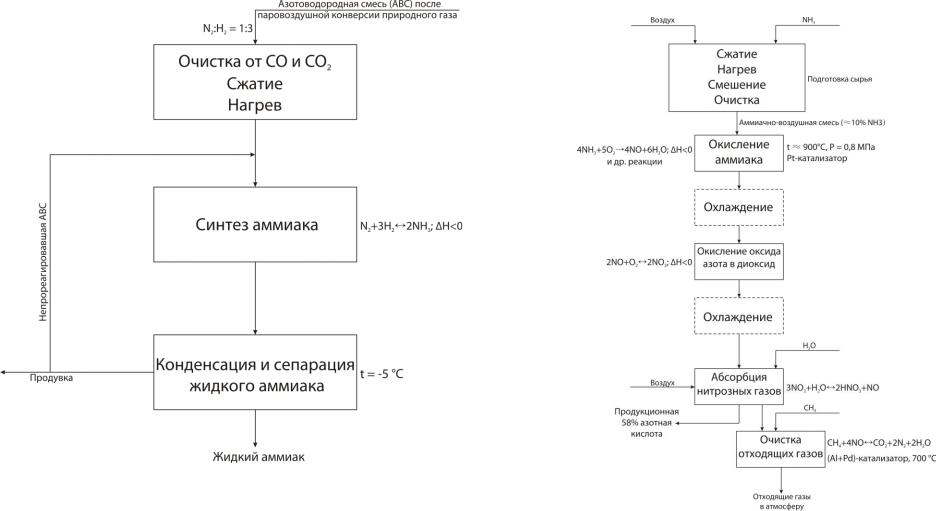
Рис.3.2 Функциональная и химическая схемы синтеза аммиака |
Рис.3.3 Функциональная и химическая схемы производства |
|
азотной кислоты |
Из химической схемы вытекает:
1.Очистка от CO и CO2 азотоводородной смеси (АВС), т.к. они
|
являются ядом для железного катализатора и обратимо отравляют |
|
Из химической схемы вытекает: |
|
его. |
1. |
Получение аммиачно-воздушной смеси, очищенной от примесей, |
2. |
Сжатие до 30 МПа как до оптимального давления (из |
|
сжатой и нагретой. |
|
экономических соображений). |
2. |
Окисление аммиака на платиновом катализаторе при 900 °С. |
3. |
Синтез аммиака на железном катализаторе при t ≈ 450-500 °C и P |
3. |
Утилизация тепла и охлаждение. |
|
= 30 МПа. |
4. |
Окисление NO в NO2. |
4. |
Разделение аммиака и непрореагировавшей АВС. |
5. |
Абсорбция водой нитрозных газов с получением 58%-й азотной |
5. |
Возврат непрореагировавшей АВС на синтез. |
|
кислоты. |
6. |
Вывод части реакционной смеси из системы с целью |
6. |
Очистка газов после абсорбции от оксидов азота на Al-Pd |
|
предотвращения накопления инертных примесей. |
|
катализаторе при 700 °С. |
7. |
Необходимо организовать использование тепла экзотермической |
7. |
Утилизация энергии отходящих газов для привода турбины |
|
реакции синтеза аммиака и утилизацию тепла. |
|
компрессора. |
14 |
15 |
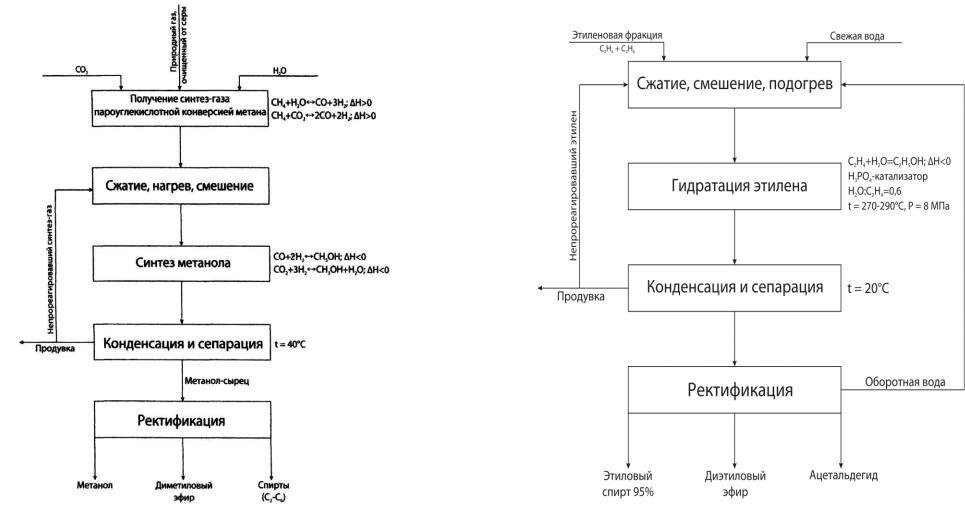
Рис.3.4 Функциональная и химическая схемы синтеза метанола
Из химической схемы вытекает:
1.Получение синтез-газа пароуглекислой конверсией метана с целью получения определенного соотношения Н2:СО.
2.Возврат (рецикл) непрореагировавшего синтез-газа.
3.Смешение, нагрев и сжатие до соответствующих параметров в зависимости от используемого катализатора.
4.Охлаждение газа после синтеза с целью выделения метанола и при этом нагрев входящих в реактор потоков.
5.Разделение непрореагировавших газов и жидкой фазы.
6.Отделение метанола от побочных продуктов.
Рис.3.5 Функциональная и химическая схемы синтеза этанола
Из химической схемы вытекает:
1.Рецикл по этилену и воде из-за низких степеней превращения.
2.Сжатие и подогрев сырья до условий синтеза.
3.Отвод из системы инертных примесей, которые могут накапливаться при рециркуляции («продувка»).
4.Подпитка катализатора фосфорной кислотой и нейтрализация уносимой с потоком продуктов фосфорной кислоты.
16 |
17 |
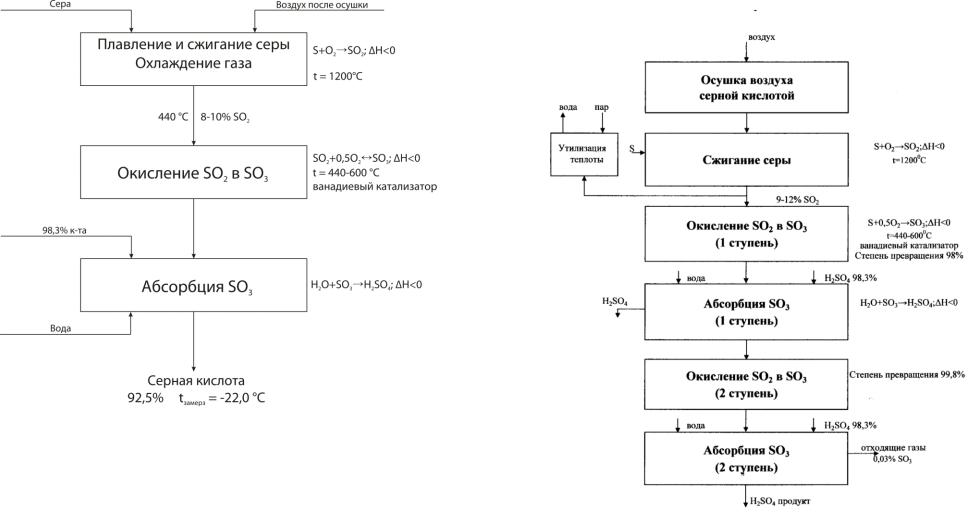
Рис.3.6 Функциональная и химическая схемы производства |
Рис.3.7 Функциональная и химическая схемы производства |
серной кислоты |
серной кислоты методом ДКДА-двойного контактирования- |
|
двойной абсорбции. |
Из химической схемы вытекает:
1.Получение SO2-содержащего газа с концентрацией, обеспечивающей оптимальное выделение тепла при окислении
SO2 в SO3.
2.Контактное окисление SO2 в SO3 на ванадиевом катализаторе при температуре 440-600 °С по линии оптимальных температур и с использованием двойного контактирования и двойной абсорбции (метод ДКДА).
3.Использование для абсорбции 98,3%-й кислоты как имеющей
минимальное парциальное давление паров воды и SO3. Закрепление ее не более чем на 1-1,5%.
18 |
19 |
|
