
охт (6sem) / методички митхт / ШВАРЦ-Основы термодинамики и кинетики гомогенных процессов (2013)
.pdf
МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего
профессионального образования
Московский государственный университет тонких химических технологий имени М.В.Ломоносова
Кафедра Общей химической технологии
А.Л. Шварц, Л.Г. Брук
Основы термодинамики и кинетики гомогенных процессов
Учебное пособие
\
Москва МИТХТ им. М.В.Ломоносова
2012
УДК 541.121;541.124 ББК 24.53; 24.54 Я 73
Рецензент: к.х.н., доцент Ошанина И.В.
Рекомендовано к изданию кафедрой общей химической технологии (протокол № 1 от 30.08.11)
Шварц А.Л., Брук Л.Г.
Основы термодинамики и кинетики гомогенных процессов. – М.: ИПЦ МИТХТ имени М.В. Ломоносова, 2012. – 54 с.: ил.
В предлагаемом учебном пособии в наиболее доступной форме рассмотрены основы термодинамики и кинетики гомогенных процессов.
Пособие может быть рекомендовано студентам дневной и вечерней формы обучения по направлениям «Химическая технология» и «Материаловедение».
Утверждено Библиотечно-издательской комиссией МИТХТ имени М.В. Ломоносова в качестве учебного пособия.
©А.Л. Шварц
©Л.Г. Брук
2
Оглавление |
|
1. Основные направления развития химической промышленности на современном |
|
этапе .................................................................................................................................... |
5 |
1.1. Предмет химической технологии .......................................................................... |
5 |
1.2. Краткие сведения об истории развития химической технологии ...................... |
5 |
1.3. Понятие химико-технологического процесса (ХТП) .......................................... |
8 |
1.4. Основные принципы организации химических производств ............................ |
9 |
1.4.1. Принцип наилучшего использования сырья ................................................ |
10 |
1.4.2. Принцип максимальной интенсивности процесса ...................................... |
10 |
1.4.3. Принцип наилучшего использования энергии ............................................ |
10 |
1.4.4. Принцип экологической безопасности ......................................................... |
11 |
1.6. Современные тенденции развития химической промышленности ................. |
13 |
1.6.1. Сокращение количества отходов и создание безотходных (малоотходных) |
|
производств................................................................................................................ |
13 |
1.6.2. Комплексное использование сырья .............................................................. |
14 |
1.6.4. Комбинирование производств ....................................................................... |
15 |
Комбинирование производств возможно по нескольким принципам....................... |
15 |
Реакции: ............................................................................................................................ |
16 |
1.6.5. Повышение степени энергосбережения на предприятиях химической |
|
промышленности....................................................................................................... |
16 |
1.6.6. Создание агрегатов большой единичной мощности ................................... |
17 |
1.6.7. Интенсификация ХТП .................................................................................... |
18 |
2. Разработка химико-технологического процесса...................................................... |
19 |
2.1. Алгоритм разработки химической концепции ХТП ......................................... |
19 |
2.2.1. Изобарно-изотермический потенциал (энергия Гиббса) ............................ |
22 |
2.2.2. Константа равновесия..................................................................................... |
24 |
2.3. Анализ зависимости константы равновесия от температуры для реакций, |
|
протекающих с различными изменениями энтальпии и энтропии......................... |
26 |
2.4. Связь константы равновесия реакции с равновесной степенью превращения |
|
исходных реагентов (равновесным выходом продуктов)........................................ |
30 |
2.5.1. Влияние температуры..................................................................................... |
32 |
3
2.5.2. Влияние соотношения реагентов на их степень превращения и выход |
|
продукта ..................................................................................................................... |
32 |
2.5.2.1. Соотношение реагентов - стехиометрическое....................................... |
32 |
2.5.2.2. Один из реагентов - в избытке................................................................. |
33 |
2.5.4. Влияние введения в систему инертного компонента (D) , при сохранении |
|
величины общего давления...................................................................................... |
35 |
2.5.5. Вывод продукта из зоны реакции.................................................................. |
36 |
3. Кинетический анализ и кинетика гомогенных процессов ...................................... |
36 |
3.1. Понятие о кинетическом анализе ........................................................................ |
36 |
3.2. Кинетика гомогенных процессов ........................................................................ |
37 |
3.2.1. Скорость химической реакции ...................................................................... |
37 |
3.2.2. Методы определения скорости химической реакции и кинетическая |
|
модель процесса ........................................................................................................ |
38 |
3.2.3. Понятие элементарной реакции .................................................................... |
41 |
3.2.4. Простые по механизму и стехиометрически простые реакции ................ |
42 |
3.2.5. Сложные реакции............................................................................................ |
43 |
3.2.6. Понятие дифференциальной селективности и ее зависимость от |
|
концентраций реагирующих веществ ..................................................................... |
44 |
3.2.7. Зависимость скорости реакции от температуры.......................................... |
45 |
3.2.8. Зависимость дифференциальной селективности от температуры............. |
47 |
3.2.9. Особенности кинетики окисления оксида азота(II) в оксид азота (IV).... |
48 |
3.2.10. Скорость обратимых реакций...................................................................... |
49 |
3.2.10.1. Обратимая эндотермическая реакция................................................... |
50 |
3.2.10.2. Обратимая экзотермическая реакция ................................................... |
50 |
3.2.11. Влияние катализатора на скорость химической реакции ......................... |
53 |
4. Литература ................................................................................................................... |
53 |
4

1. Основные направления развития химической промышленности на современном этапе
1.1. Предмет химической технологии
Слово «технология» образовано на основе двух греческих слов: «techne» - некий гибрид искусства и ремесла, «logos» - знание, учение, наука. Таким образом, смысл слова технология означает: «наука о ремесле», «наука о производстве», «искусство что-то делать».
Технология является прикладной наукой, которая на базе достижений естественных наук решает прикладные задачи, связанные с разработкой методов, приемов, устройств для получения веществ и материалов, необходимых для удовлетворения потребностей людей (целевых продуктов).
Технологию можно условно поделить на механическую и химическую. Если понимать технологию как совокупность знаний о способах и средствах обработки веществ и материалов, то механическая технология предполагает разработку процессов без изменения состава исходных веществ (материалов), а химическая - глубокие изменения их состава и структуры. Условность этого деления в том, что ряд механических процессов протекает с участием химических превращений, например, литьѐ пластмасс, а любое химическое превращение на уровне производства сопровождается механическими и физическими процессами.
Обязательным в химической технологии, коренным образом отличающим еѐ от других технологий, является наличие химического превращения.
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ - наука о способах переработки сырьевых и техногенных материалов в целевые продукты, реализуемых с использованием химических превращений.
В1901 г. Д.И. Менделеев в статье для энциклопедического словаря Брокгауза
иЭфрона писал: «Она (технология) содержит в себе приложение к жизни других, более отвлечѐнных знаний. Еѐ содержание должно изменяться по обстоятельствам
иусловиям времени и места». Отсюда вытекает, что технология - прикладная наука, которая не является чем-то застывшим: она постоянно развивается. Еѐ эволюция базируется, прежде всего, на уровне современных знаний и еѐ основой являются достижения фундаментальных научных дисциплин и ресурсные (сырьевые и энергетические) возможности.
1.2. Краткие сведения об истории развития химической технологии
Первые специализированные производства по получению химических веществ появились в Европе примерно в XV веке, в России - на рубеже XVI - XVII веков. Эти
5
предприятия представляли собой небольшие фабрики, производившие соду, серную кислоту, соли, краски, порох, некоторые органические вещества весьма ограниченной номенклатуры.
Слово «технология» было предложено немецким ученым, профессором Геттингенского университета И. Бекманом в 1772 г.
Позднее (1795 г.) его коллега И.Ф. Гмелин подготовил и издал первый учебник по химической технологии - «Руководство по технической химии».
В1803 г. этот труд издается в России в русском переводе В.М. Севергина под названием «Химические основания ремесел и заводов».
С начала XIX века химическая технология стала обязательным предметом, преподававшимся в высших как технических, так и в экономических учебных заведениях, и неотъемлемым элементом высшего технического образования.
Первые учебники по химической технологии представляли собой фактически набор прописей, рецептов с описанием устройств, в которых эти рецепты можно было реализовать.
В1807-1808 гг. появляется собственно первый русский учебник по химической технологии профессора Московского университета И.А. Двигубского «Начальные основания технологии, или краткое показание работ на заводах и фабриках производимых».
Первая попытка систематизировать общие приемы, применявшиеся к тому времени в химической технологии, была осуществлена в 1828 г. профессором Денисовым Ф.А. в учебнике «Пространное руководство к общей технологии, или к познанию всех работ, средств, орудий и машин, употребляемых в разных технических искусствах». В этом учебнике впервые были обобщены приемы и процессы, применяемые в химической технологии.
К началу XIX века в Российской Академии наук появилась кафедра химической технологии, начинают издаваться первые научные журналы по химической технологии. Можно считать, что с этого момента химическая технология стала существовать как наука, которая обобщала и суммировала приемы, используемые для наиболее эффективного получения химических веществ.
До научного этапа химической технологии способы получения различных веществ разрабатывались эмпирическим путем.
Вкачестве примера рассмотрим развитие технологии получения одного из важнейших продуктов химической промышленности – серной кислоты. Серную кислоту называют «хлебом» химии. Это один из самых широко используемых многотоннажных продуктов химической технологии. Человечеству серная кислота известна более тысячи лет. Первое документальное упоминание о серной кислоте относится к VIII веку н.э.
6
Арабский ученый Джабир ибн Хайян использовал серную кислоту в качестве катализатора дегидратации этилового спирта:
2С2Н5ОН → (С2Н5)2О + Н2О |
(1.1) |
В «донаучную эпоху» (до начала XVI в.) серную кислоту получали термическим разложением железного купороса в присутствии воздуха при нагревании:
FeSO4 ·7H2O + О2 → Fe(OH)SO4 + Fe2(SO4)3 + Fe2O3 + H2O + SO3 |
(1.2) |
Пары серного ангидрида и воды конденсировали на выходе из реакционного сосуда с получением концентрированной серной кислоты. К плюсам данного метода можно отнести то, что железный купорос присутствует в природе в виде минерала мелантерита, но этот способ чрезвычайно неэффективный и годится для получения только небольших количеств серной кислоты.
В 1666 г. европейские ученые Лемери и Лефебр заложили основы камерного способа получения серной кислоты. По этому методу брали самородную серу, добавляли селитру и нагревали в присутствии воздуха и воды. Процесс был реализован в Бирмингеме (Англия) в 1746 г. Робеком.
Сначала сера окислялась до сернистого ангидрида, а затем до серного ангидрида, который и поглощался водой. Долгое время не была понятна роль селитры в этом процессе. Эмпирически было уставлено сильное влияние присутствия селитры в реакционной смеси на скорость процесса.
Только в начале XIX века ученые Клеман и Дезорм поняли механизм действия селитры в этом процессе.
Суть в том, что при нагревании в присутствии серной кислоты селитра разлагается с образованием кислого сульфата натрия, оксидов азота и кислорода:
NaNO3 + Н2SO4 → NaHSO4 + HNO3 и 2H NO3 → NO2 + O2 + H2O + NO (1.3)
Образующийся NO2 катализирует процесс гомогенного окисления SO2 кислородом воздуха в SO3, а именно: сернистый ангидрид быстро окисляется оксидом азота(IV) в серный ангидрид:
SO2 + NO2 = SO3 + NO |
(1.4) |
а образовавшийся оксид азота(II) быстро окисляется кислородом до оксида |
|
азота(IV): |
|
2NO + O2 = 2NO2 |
(1.5) |
|
7 |
И этот маршрут оказывается гораздо быстрее, чем прямое окисление сернистого ангидрида кислородом. Суммарно процесс описывается стехиометрическим уравнением окисления оксида серы(IV) в оксид серы(VI) :
2SO2 + O2 = 2SO3 |
(1.6) |
Камерный способ получения серной кислоты реализовали в металлических камерах, в которые загружали серу и селитру в присутствии небольшого количества воды, и нагревали. После поглощения выделившегося SO3 загружали новую порцию серы с селитрой. Этот процесс был весьма трудоемким. Позднее этот метод стал основой башенного метода получения серной кислоты.
В 1831 г. английский исследователь Филлипс получил патент на получение серного ангидрида окислением сернистого ангидрида кислородом воздуха в присутствии платины и последующим получением собственно серной кислоты.
Платина очень эффективный катализатор этого процесса, который позволяет проводить процесс при сравнительно невысоких температурах (примерно 250 - 300 0С), но этот катализатор легко отравляется примесями, содержащимися в исходном газе, полученном обжигом пирита (серного колчедана). Именно нестабильность, неустойчивость платинового катализатора была препятствием к использованию этого способа.
Только в конце XIX века данный способ был реализован в промышленности, когда удалось очищать получаемый обжиговый газ от соединений мышьяка, селена, и теллура. Однако платину в качестве промышленного катализатора использовали сравнительно недолго, так как в начале XX века одновременно в нескольких странах было установлено, что хорошим катализатором для данного процесса является смешанный оксидный катализатор на основе V2O5 .
Существует много вариантов этого катализатора, который оказался значительно стабильнее по отношению к каталитическим ядам, чем платина и существенно дешевле. До настоящего времени именно катализаторы такого типа широко применяются в производстве серной кислоты.
Таким образом, процесс развивался более 400 лет и будет развиваться в дальнейшем.
1.3.Понятие химико-технологического процесса (ХТП)
Воснове химической технологии всегда лежит химико-технологический процесс (ХТП). ХТП – это совокупность химических, физических и физикохимических процессов, направленных на превращение сырья или техногенных материалов в так называемые целевые продукты, то есть продукты, обладающие определенными потребительскими свойствами.
8
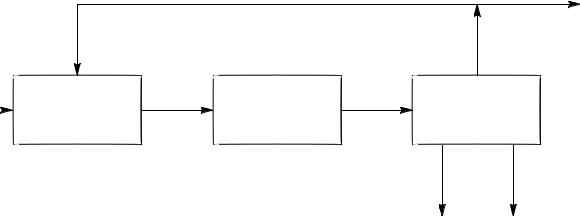
ХТП состоит из трех главных составляющих, обычно изображаемых в виде триады:
Непрореагировавшее сырье |
Вывод |
|
примесей |
Исходное |
Подготовка |
Химическое |
Разделение |
сырье |
сырья |
превращение |
и очистка |
Продукты Отходы
Каждая из этих частей одинаково важна. Подготовка сырья – это очистка его до необходимой для данного процесса степени чистоты, смешение исходных реагентов, подогрев, сжатие и т.д.
Химическое превращение может включать в себя несколько химических технологических стадий.
Выделение и очистка продукта необходимы для того чтобы отделить непрореагировавшие реагенты, побочные продукты и довести целевые продукты до необходимой степени чистоты в соответствии с требованиями ГОСТ (ТУ).
Реагенты, как правило, возвращаются на стадию подготовки сырья. Побочные продукты процесса либо превращаются в дополнительные целевые продукты, либо становятся отходами, которые должны быть утилизированы.
Отходы – остатки сырья, материалов, полупродуктов, которые утратили свои первоначальные свойства, не соответствуют требуемым стандартам и не обладают потребительской ценностью.
Однако, как говорил Д.И. Менделеев, "в химии нет отходов и отбросов, а есть сырьѐ, не нашедшее своего хозяина". Поэтому, как только отходы приобретают потребительскую ценность, так они переходят в разряд вторичных материальных (ВМР) или энергетических (ВЭР) ресурсов. Химический продукт, образовавшийся в ходе процесса наряду с целевым и соответствующий определѐнному стандарту, называется побочным продуктом. Например, диэтиловый эфир в производстве этанола, или сульфат аммония в производстве капролактама.
1.4. Основные принципы организации химических производств
Создание и эксплуатация химических производств базируются на нескольких принципах. Они достаточно просты и очевидны.
9
1.4.1. Принцип наилучшего использования сырья
Затраты на сырье являются одной из главных составляющих себестоимости химических продуктов. В среднем они составляют около 50 % себестоимости произведенных продуктов. Надо отметить, что многие виды сырья (руды, природный газ, нефть и др.) – невозобновляемы. Имеет место тенденция к истощению запасов сырьевых ресурсов, возникает необходимость в переработке бедных по содержанию ценных компонентов руд. Места добычи полезных ископаемых смещаются в труднодоступные районы.
С экологической точки зрения, если сырье не превращается в целевые продукты, оно превращается в отходы, которые, так или иначе, попадают в окружающую среду.
Существуют конкретные приемы, с помощью которых можно реализовать этот принцип. О них подробнее в следующем пособии.
1.4.2. Принцип максимальной интенсивности процесса
Достаточно очевидно, что необходимо проводить ХТП как можно более интенсивно. Если мы за один и тот же промежуток времени получаем больше целевых продуктов, то и себестоимость эти целевых продуктов будет ниже, потому что кроме пропорциональных затрат на сырье, энергию есть условно постоянные затраты. Под ними понимают заработную плату обслуживающего персонала, содержание зданий, помещений, затраты на освещение, обогрев и т.п. При увеличении интенсивности процесса указанные выше затраты раскладываются на большее количество целевого продукта и себестоимость его становится ниже.
Поэтому, при прочих равных условиях, продукт, который произведен быстрее, оказывается и дешевле.
1.4.3.Принцип наилучшего использования энергии
Кэтому принципу относится все тоже самое, что и к первому принципу. Энергию, в основном, получают за счет сжигания топлива, которое является невозобновляемым. С учетом постоянного роста цен на энергетическое сырье вклад его в себестоимость продукции непрерывно возрастает.
При существующих темпах добычи нефти в России хватит примерно на 20 лет. Другие страны находится в несколько лучшем положении. В Саудовской Аравии – нефти на 40 лет, в Иране и Казахстане примерно на 80 лет. Естественно, оценки эти достаточно условны, поскольку меняются темпы добычи и мировая конъюктура. Поэтому экономия топлива (энергии) – один из базовых принципов организации любого производства, в том числе и ХТП.
Необходимо отметить, что само химическое производство может стать источником энергии. В частности, экзотермические реакции могут быть основой для получения энергии, которую можно использовать как для проведения данного
10
