
- •Экспериментальные и расчетные данные
- •Контроль процесса
- •Таблица 2.1.1
- •Библиографический список
- •2.2.2. Введение
- •2.2.3. Теоретические основы процесса
- •Выход по току
- •Удельный расход электроэнергии
- •Состав электролита
- •Исходные данные
- •Расчет технологических показателей
- •Таблица 2.2.4
- •2.3.2.Введение
- •2.3.3. Теоретические основы процесса
- •2.3.5. Расчетная часть
- •Исходные данные
- •2.3.7. Задание
- •Библиографический список
- •Таблица 3.3.1
- •3.3.4. Выбор оптимального технологического режима
- •3.3.5. Описание лабораторной установки
- •3.3.8. Задание

Министерство образования и науки Российской Федерации
Московский государственный университет тонких химических технологий имени М.В. Ломоносова
Кафедра Общей химической технологии
ОСНОВЫ ХИМИЧЕСКОЙ
ТЕХНОЛОГИИ
Лабораторный практикум
2
Москва 2013
УДК 66.0 (075)
ББК 35я73
П68
Брук Л. Г., Егорова Е. В., Киричек И. Д., Кононова Г. Н., Сафонов В. В., Цыганков В. Н., Чабан Н. Г., Шварц А. Л., Устюгов А. В., Путин А., Ю.
П68 Основы химической технологии. Лабораторный практикум. Учебное пособие. - М.: ИПЦ МИТХТ им М.В. Ломоносова, 2013.- 18Х с.
Рецензент:
Лабораторный практикум предназначен для студентов 3-го курса дневной и вечерней формы обучения по всем направлениям бакалавриата. Издание расширено и переработано в соответствии с новыми учебными планами.
УДК 66.0 (075)
ББК 35я73
3
Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В. Ломоносова в качестве учебного пособия.
© МИТХТ им. М. В. Ломоносова
© сотр. каф. ОХТ
Раздел 1
Основные понятия и технологические критерии эффективности химикотехнологических процессов
4
1.1. Классификация химико-технологических процессов.
Химико-технологический процесс (ХТП) – это совокупность физических и химических процессов, направленных на превращение исходных реагентов (сырья) в необходимые для дальнейшей переработки или потребления (целевые) продукты. ХТП классифицируют по сочетанию признаков, характеризующих типы процессов, лежащих в их основе, и по способу их осуществления. Эта классификация важна, поскольку тип ХТП определяет способ его реализации, в частности, тип используемого реактора, необходимость рециркуляции реагентов и т.д.
ВХТП можно условно выделить часть, связанную
схимическими превращениями – реакционную систему,
и часть, включающую в основном физические процессы, направленные на выделение и очистку продуктов процесса. В практикуме «Основы химической технологии» основное внимание уделено химической составляющей ХТП. В связи с этим под
обозначением |
«ХТП» |
будем |
подразумевать, |
в |
основном, реакционную систему. |
|
|
||
Основными |
признаками химического превращения |
|||
являются: |
|
|
|
|
а) химизм, включающий информацию о степени сложности протекающих реакций, их количестве и стехиометрии;
б) особенности термодинамики; в) кинетические закономерности
протекания ХТП;
5
г) фазовая характеристика ХТП.
С точки зрения химизма ХТП делят на простые и
сложные.
Простой ХТП можно описать одним стехиометрическим уравнением превращения исходных реагентов, например, А и В в продукты Р и R (1.1.)
аА вВ rR pP |
(1.1) |
где а, в, r и p – стехиометрические коэффициенты.
При этом не все продукты основной реакции могут представлять одинаковую практическую ценность, поэтому их делят на целевые и побочные, которые могут найти применение или являться отходами производства.
Сложный ХТП описывают более чем одним стехиометрическим уравнением, т.е. кроме основной реакции протекают параллельные, последовательные и параллельно-последовательные превращения реагентов и продуктов. В результате протекания побочных реакций также образуются побочные продукты. Таким образом, сложный ХТП всегда включает основную реакцию, дающую целевые продукты (иногда вместе с побочными) и побочные реакции, приводящие к образованию побочных продуктов.
С термодинамической точки зрения ХТП делят на
необратимые и обратимые, экзотермические и эндотермические.
Необратимыми (односторонними) ХТП называют процессы, равновесие основной реакции которых практически полностью смещено в сторону образования продуктов во всем доступном для ХТП диапазоне изменения температуры и давления.
|
|
6 |
|
Константа |
равновесия |
необратимого |
процесса |
остается |
больше чем |
102 во всем |
доступном |
диапазоне условий. Необратимыми можно считать и процессы, равновесие которых во всём диапазоне доступных для ХТП условий практически полностью смещено в сторону исходных реагентов (константа равновесия очень мала). Такие процессы называют
запрещенными |
по термодинамическим |
соображениям. |
Они не представляют практического интереса. |
||
Обратимый |
(двухсторонний) ХТП – |
это процесс, |
на положение равновесия которого можно в заметной степени повлиять изменением условий проведения. Если в результате удается подобрать условия проведения ХТП таким образом, чтобы константа равновесия имела величину ~102 или больше, а равновесный выход целевого продукта был близок к 100% или к 1 (в долях) (см. ниже), то процесс называют обратимым смещенным. Если константа равновесия и равновесный выход не достигают указанных значений в выбранных условиях проведения, то ХТП считают обратимым несмещенным. При разработке технологии необратимых процессов не возникает вопросов, связанных с термодинамическими ограничениями, и разработчики более свободны в выборе условий (см. ниже).
При организации ХТП необходимо учитывать тепловой эффект протекающих реакций. Тепловой эффект реакции (Q) и изменение энтальпии (∆Н) одинаковы по абсолютной величине, но противоположны по знаку. Реакции, протекающие с
выделением |
тепла, |
называют |
экзотермическими |
(Q > 0, Н < 0), реакции, приводящие к поглощению |
|||
тепла – эндотермическими (Q < 0, |
Н > 0). |
||
Тепловой |
эффект |
ХТП складывается из тепловых |
|
эффектов основной и побочных реакций. Если сумма тепловых эффектов положительна, т.е. преобладают
реакции, |
протекающие с выделением тепла, то ХТП |
|||
является |
экзотермическим. Если основной вклад в |
|||
суммарный тепловой |
эффект |
вносят |
реакции, |
|
7
протекающие с поглощением тепла, то ХТП – эндотермический. Часто под тепловым эффектом ХТП имеют ввиду тепловой эффект целевой реакции. Очевидно, что для экзотермических ХТП необходимо обеспечить теплоотвод при соблюдении оптимального температурного режима в реакционной зоне (или организовать автотермический режим), а для эндотермических процессов – решить проблему теплоподвода. Знаком и величиной теплового эффекта в значительной мере определяется выбор температурного режима проведения ХТП. С этой точки зрения различают изотермические и автотермические
процессы. |
Первые |
проводят |
при |
постоянной |
||
температуре, |
отводя |
тепло |
экзотермических реакций |
|||
и |
подводя |
тепло |
в |
случае |
эндотермических |
|
процессов. В случае экзотермических процессов наиболее экономичен вариант, при котором выделяющееся тепло расходуется на поддержание оптимальной температуры. В последнем случае реактор изолируют для уменьшения потерь тепла в окружающую среду. Такие реактор и процесс называют также адиабатическими. В автотермических процессах рационально используют тепло, выделяющееся при протекании реакций, и существенно упрощается устройство реактора.
Константа равновесия связана с изменением стандартного изобарно-изотермического потенциала
реакции уравнением (1.2.): |
|
G° = Н° – Т S° = – RT lnK |
(1.2) |
Отсюда следует связь константы равновесия реакции и температуры (изобара Вант-Гоффа) (1.3):
|
= |
∆° |
− |
∆° |
|
(1.3) |
|
|
|
||||
|
|
|
|
|||
Это |
уравнение |
|
позволяет |
проводить |
||
термодинамический анализ |
реакционных |
систем при |
||||
8
известных или рассчитанных по справочным данным изменениях энтальпии ( Н°) и энтропии ( S°) реакции.
Равновесный выход или равновесная степень превращения – это доля исходного реагента, превратившегося в продукты реакции к моменту достижения равновесия. Равновесный выход - величина более информативная в практическом плане, чем величина константы равновесия, поскольку это максимально достижимый выход в данных условиях.
Связь равновесного выхода и константы равновесия определяется видом уравнения реакции. Покажем алгоритм нахождения этой связи на примере реакции синтеза метанола из синтез-газа (1.4).
СО + 2Н2 = СН3ОН |
(1.4) |
Предположим, что исходная смесь газов содержит 1 моль СО и 2 моля водорода (стехиометрическое соотношение). Метанол в исходной смеси отсутствует. Обозначим равновесный выход метанола на монооксид углерода буквой x. Тогда к моменту
установления равновесия |
в |
равновесной |
газовой |
смеси содержится (1 – x) |
молей |
СО, (2 – 2x) |
молей Н2 |
и x молей СН3ОН (из каждого исходного моля СО часть, равная х, превратилась в метанол).
|
СО |
Н2 |
СН3ОН |
|
|
|
|
Исходная смесь, моль |
1 |
2 |
0 |
Равновесная смесь, моль |
1 – х |
2 – 2х |
х |
Для того чтобы связать константу равновесия (1.5) с равновесным выходом, выразим парциальные давления веществ, присутствующих в равновесной системе, через равновесный выход. Для этого воспользуемся выражением (1.6.).

9
|
|
|
|
|
|
|
|
||
= |
|
|
|
(1.5) |
|
∙ |
|
||
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
= |
∙ |
|
|
(1.6) |
||
где |
Рi |
–парциальное |
давление |
i-ого |
|||
|
вещества, |
|
|
|
|||
|
P – общее давление в системе, |
||||||
|
Ni |
– |
мольная |
доля |
i-ого вещества |
||
|
|
|
|
|
|
|
|
|
( = |
|
- |
отношение количества |
|||
|
∑ |
||||||
|
|
|
|
|
|
|
|
молей данного вещества к сумме молей всех веществ, присутствующих в данной фазе системы, для данного
случая ni = 3 – 2x).
Тогда для рассматриваемого примера выражение для константы равновесия (1.5) перепишем с учетом выражений для парциальных давлений веществ (1.7).
P |
N |
|
P |
|
|
|
P |
x |
|
P x |
|
CH OH |
( 1 x 2 |
2x x ) |
( 3 2x ) |
||||||||
CH OH |
|
|
|
||||||||
3 |
|
3 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
P |
|
|
P ( 1 x ) |
|
|
|||
|
|
|
|
( 3 |
2x ) |
|
|
||||
|
|
|
CO |
|
|
|
|||||
|
|
|
|
|
|
|
|
||||
(1.7)
|
|
|
|
|
P |
|
|
P ( 2 2x ) |
|
|
|
|
||||
|
|
|
|
|
|
( 3 |
2x ) |
|
|
|
|
|
||||
|
|
|
|
|
H |
2 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
После |
|
сокращений |
|
|
и |
|
преобразований |
|
||||||||
(1.8). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
P x ( 3 2x ) |
3 |
|
x ( 3 2x ) |
2 |
|
||||||||
|
|
|
|
|
|
|||||||||||
P |
3 |
|
|
|
3 |
|
|
|
|
2 |
|
|
3 |
|||
|
4 P |
( 1 |
x ) |
( 3 |
2x ) |
4 P |
( 1 x ) |
|||||||||
|
|
|
|
|
|
|||||||||||
получим
(1.8)
Уравнения типа (1.8) позволяют не только исследовать взаимосвязь температуры и равновесного
10
выхода (совместно с уравнением 1.3), но и определить чувствительность равновесного выхода к изменению давления (при постоянной температуре и константе равновесия). Так, легко показать, что для вышеприведенного примера величина константы равновесия и равновесный выход будут уменьшаться с увеличением температуры ( Н < 0), и равновесный выход будет увеличиваться при увеличении давления
(реакция протекает в газовой фазе с уменьшением количества молей). Причем, при малых х (х << 1)
равновесный выход будет увеличиваться пропорционально Р2.
В первом приближении можно считать, что константа равновесия не зависит от давления и является функцией только температуры. Это совершенно верно при относительно низких давлениях и высоких температурах. При высоких давлениях законы для идеальных газов перестают описывать наблюдаемые зависимости. Для сохранения возможности пользоваться простыми законами были введены понятия активности и коэффициента активности. Взаимосвязь активности и давления выражается уравнением (1.9).
|
|
= |
|
∙ |
|
(1.9) |
|
|
|
|
|||
А константа равновесия |
|
реакции, протекающей |
||||
под давлением, должна выражаться через активности компонентов. Например, для реакции синтеза метанола из синтез-газа выражение для константы равновесия с использованием равновесных активностей и коэффициентов активностей выглядит следующим образом (1.10).
|
|
|
|
|
|
|
∙ |
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||||||
= |
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
= ∙ (1.10) |
|
|
∙ |
|
|
∙ |
|
∙ |
|
|
∙ |
|
|
||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
11 |
|
|
|
Поскольку при |
расчете по |
формулам |
(1.2) и |
|||
(1.3) |
получают |
значение |
|
термодинамической |
||
константы |
равновесия |
Ка, |
а |
для |
расчета |
|
равновесного выхода необходимо значение измеряемой константы КP, то необходимо для процессов, протекающих под давлением, рассчитывать Кγ, так как эта величина в этом случае будет отличаться от единицы. Для этого используют различные подходы,
описанные |
в |
литературе |
|
по |
химической |
||
термодинамике. |
|
|
|
|
|
|
|
Таким |
образом, |
на |
величину |
константы |
|||
равновесия |
реакции |
влияет |
температура |
в |
|||
зависимости |
от |
знака |
теплового |
эффекта. Давление |
|||
может влиять на величину КP только через изменение Кγ. На величину равновесного выхода влияет температура (через значение КP), общее давление и соотношение концентраций (парциальных давлений веществ). Избыток одного реагента приводит к увеличению степени превращения другого(-их) реагента(-ов) и к уменьшению степени превращения реагента, находящегося в избытке.
Большая величина константы равновесия и отсутствие термодинамических ограничений (Хравн. = 1) необходимое, но не достаточное условие возможности практической реализации ХТП.
Очень большое значение для выбора условий проведения ХТП имеют кинетические закономерности целевой и побочных реакций (т.е. закономерности протекания процесса во времени или зависимость скорости от концентрации веществ, температуры, наличия катализатора и его характеристик).

12
Ea,прям
Ea,обр
E
A + B
C + D
-DH 
Координата реакции
Рис. 1.1 Энергетическая диаграмма элементарной реакции.
Столкновение двух молекул исходных реагентов, обладающих достаточной энергией для преодоления энергетического барьера, приводит к получению продуктов (промежуточных или конечных) реакции и называется элементарным актом химического взаимодействия (рис.1.1). Точку на вершине энергетического барьера называют переходным состоянием или активированным комплексом (это термины из соответствующих теорий элементарных реакций, см. курс «Физическая химия»).
Совокупность одинаковых элементарных актов – элементарная реакция (1.13).
аА + вВ → сС + dD |
(1.13) |
Элементарную реакцию от сложной (по механизму) отличает отсутствие промежуточных продуктов. Скорость элементарной реакции может быть описана законом действия масс. Для реакции (1.13) уравнение (1.14).

|
13 |
|
|
|
|
|
|
= |
|
∙ |
|
(1.14) |
|
|
|
|||||
|
|
|
|
Скорость элементарной реакции пропорциональна концентрациям реагентов в степенях, равных их стехиометрическим коэффициентам в уравнении реакции. Для газофазных реакций вместо концентраций используют парциальные давления веществ. Коэффициент пропорциональности – константа скорости элементарной реакции. Зависимость константы скорости элементарной реакции от температуры описывают уравнением Аррениуса (1.15).
− |
|
= |
(1.15) |
где А – предэкспоненциальный член,
Е – энергия активации, R – газовая постоянная,
Т – абсолютная температура.
Показатель степени концентрации (или
парциального давления) в кинетическом уравнении называют порядком по данному реагенту. Для элементарной реакции порядок совпадает со стехиометрическим коэффициентом данного вещества (и должен быть положительным, целочисленным и не превышать двух). Сумма показателей степени для концентраций реагентов – суммарный порядок. Для элементарной реакции суммарный порядок совпадает с молекулярностью (числом молекул реагентов,
14
участвующих в элементарной реакции) и не превышает двух. Одновременное столкновение более двух
молекул – маловероятно. |
|
|
||
Сложные |
по |
механизму |
реакции |
включают |
несколько элементарных реакций. На энергетической диаграмме сложной по механизму реакции (1.16), (1.17) будет соответствовать кривая потенциальной энергии с несколькими минимумами и максимумами
(рис. 1.2)
A B X
X C P
E |
|
E |
|
|
a,1 |
|
|
A + В + С |
E |
|
|
|
DH |
|
|
|
a,2 |
|
|
DH |
1 |
|
P |
|
Х + С |
||
|
|
||
Координата реакции
(1.16)
(1.17)
Рис. 1.2. Энергетическая диаграмма сложной по механизму реакции (Х – промежуточный продукт).
Скорость сложной по механизму реакции часто можно описать эмпирическим уравнением, по форме совпадающим с уравнением закона действия масс (например, 1.14). Но в случае сложной по механизму реакции порядки по реагентам могут быть нецелочисленными, переменными, отрицательными, большими по абсолютной величине.
С точки зрения организации ХТП кинетические порядки основной и побочных реакций по реагентам важны, так как они отражают степень чувствительности скоростей образования целевых и
|
|
15 |
|
|
побочных |
продуктов |
(а, |
следовательно, |
и |
показателей процесса, см. ниже) к изменению концентраций (парциальных давлений) веществ – участников ХТП. Чем выше порядок по данному веществу, тем сильнее влияет изменение его концентрации на скорость. Зависимость наблюдаемой константы скорости (kэфф) от температуры может описываться уравнением, по форме совпадающим с уравнением Аррениуса, но значения предэкспоненты и энергии активации могут быть любыми (в отличие от определенных значений этих параметров для элементарных реакций). Например, наблюдаемая
энергия активации сложной |
реакции |
может |
быть |
отрицательна, т.е. скорость |
сложной |
реакции |
может |
уменьшаться с увеличением температуры из-за |
того, |
||
что в kэфф входят константы равновесия экзотермических стадий (реакций), значения которых уменьшаются с увеличением температуры. С технологической точки зрения знак и величина наблюдаемой энергии активации отражает чувствительность скоростей реакций ХТП к изменению температуры. Чем больше наблюдаемая энергия активации данной реакции, тем сильнее влияет изменение температуры на скорость этой реакции. Скорость реакции, имеющей более высокую энергию активации, растет быстрее при увеличении температуры, чем скорость реакции с меньшей величиной Еа. При понижении температуры быстрее
уменьшается скорость реакции, имеющей |
большую |
энергию активации. |
|
В подавляющем большинстве промышленных ХТП используют катализаторы. Функция катализатора – селективное ускорение основной реакции. Как правило, катализатор обеспечивает возможность снижения наблюдаемой энергии активации и, вследствие этого, ускорение основной реакции при той же температуре или возможность снизить
16
температуру при сохранении приемлемого значения
скорости образования целевого продукта. |
|
||||||
Тип |
катализатора |
и |
его |
характеристики |
|||
определяют, |
как |
правило, |
выбор |
условий |
и |
||
показатели ХТП. В связи с этим ХТП делят на каталитические и некаталитические. А каталитические ХТП подразделяют в зависимости от типа используемого катализатора на гомогеннокаталитические (катализатор находится в той же
газовой или, чаще, |
жидкой фазе, в которой |
находятся реагенты) и |
гетерогенно-каталитические. |
В гетерогенно-каталитических процессах используют твердые (гетерогенные) катализаторы, а реагенты находятся в газообразном или жидком состоянии.
Для способа организации ХТП важна фазовая характеристика системы, в которой протекает ХТП. С
этой точки зрения системы делят на гомофазные (все вещества находятся в одной фазе, отсутствуют границы раздела фаз) и гетерофазные (система, в которой протекает ХТП, включает хотя бы одну границу раздела фаз). Границей раздела фаз может быть поверхность твердого катализатора в газофазном или жидкофазном процессе. Поэтому все гетерогенно-каталитические процессы всегда протекают в гетерофазных системах, а гомогеннокаталитические могут реализоваться как в гомофазных, так и гетерофазных системах.
1.2. Основные технологические критерии эффективности
Для оценки качества ХТП используют количественные технологические показатели: степень превращения сырья, селективность образования и выход продукта, производительность реактора или

17
установки, интенсивность работы реактора или катализатора, расходные коэффициенты по реагентам, другим веществам (в ходе ХТП расходуются катализаторы, инерты и т.д.) и энергии. Эти показатели характеризуют степень совершенства ХТП.
Рассмотрим основные показатели на примере реакции (1.18), которую будем считать основной реакцией ХТП.
aA + bB = pP |
(1.18) |
1.2.1Степень превращения (степень конверсии)
реагента (Х) – это отношение количества превращенного реагента к введенному в реакционную систему количеству этого реагента.
Количества реагента могут быть выражены в единицах массы, молях, в мольных потоках (количество молей вещества, поступающее в реактор или выходящее из реактора в единицу времени) и, даже, в единицах объема, взятых при одинаковых условиях (температуре и давлении).
= ( − );
где
|
( |
− ) |
|
|
= |
|
|
|
(1.19) |
|
|
|
||
|
|
|
|
|
G |
A |
и |
G |
A |
- массы |
|
0 |
|
|
|
|
введенного |
|
и |
|||
непрореагировавшего |
|||||
реагента |
|
|
А, |
||
соответственно; |
|
||||

18
N |
A |
|
0 |
и |
N |
– те же
A
величины, выраженные в молях.
Если объем реакционной системы остается
постоянным |
в ходе ХТП, то |
во всех |
расчетах |
||
количества |
веществ |
могут |
быть |
заменены их |
|
молярными |
концентрациями. |
При |
использовании |
||
формул (1.19) степень превращения получают в долях единицы. Умножив полученное значение на сто
процентов, получим |
величину Х в процентах. |
|||
1.2.2 |
Выходом |
продукта по данному |
реагенту |
|
называют |
отношение |
количества |
реагента, |
|
превратившегося в данный продукт, к количеству этого реагента, введенного в систему.
Эквивалентная формулировка: - Выход продукта
по данному реагенту – это отношение количества продукта, полученного практически, к количеству этого продукта, которое должно быть получено из
введенного количества |
данного реагента в |
|
соответствии с уравнением реакции. |
||
|
Обе формулировки выражаются одной формулой. |
|
Для |
уравнения (1.18) выходы продукта Р на реагенты |
|
А и |
В выражаются формулами (1.20). |
|
=
=
∙
∙
(1.20)
∙
∙
где
19
N |
, N |
и |
N |
B |
количества |
|
|
P |
A |
|
|
|
|
|
|
0 |
|
|
||
|
|
0 |
|
|
|
|
молей |
|
продукта |
Р, |
|||
полученное |
|
|
|
в |
||
реакции |
(1.18), |
и |
||||
реагентов |
|
А |
и |
В, |
||
введенные |
в |
|
реакционную |
|||
систему, |
соответственно, |
|||||
а, |
b |
|
и |
p |
– |
|
стехиометрические |
коэф- |
|||||
фициенты |
реакции (1.18). |
|||||
Для уточнения связи формулы (1.20) с двумя формулировками определения выхода перепишем ее для реагента А в двух видах: (1.21) – для первой формулировки, (1.22) – для второй.
=
=
∙ |
|
|
|
|
||
|
(1.21) |
|||||
|
||||||
|
|
|
|
|||
|
|
|
|
|||
|
|
|
|
|
||
|
|
|
|
(1.22) |
||
∙ |
|
|||||
|
||||||
|
|
|
||||
|
|
|||||
Выражение |
( |
∙ |
|
) в формуле |
(1.21) – это |
||
|
|||||||
|
|
|
|
|
|
|
|
количество |
молей |
|
реагента |
А, |
из |
которого |
|
образуется NP молей продукта Р в соответствии с уравнением (1.18) и т.д.
Выход можно рассчитывать для каждого из
продуктов |
по |
любому |
из реагентов (а если |
необходимо, |
то |
и по |
всем реагентам основной |
реакции). Чаще выход рассчитывают для наиболее ценного (целевого) продукта на наиболее дорогой из реагентов.
Например, в синтезе метанола из синтез-газа наряду с основной (1.23) идут побочные реакции
(1.24 - 1.26).
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
СО + 2Н2 = СН3ОН |
|
|
|
(1.23) |
||||||||
|
2СО + 2Н2 = СН4 + СО2 |
|
|
|
(1.24) |
||||||||
|
СО + 3Н2 = СН4 + Н2О |
|
|
|
(1.25) |
||||||||
|
2СН3ОН = СН3ОСН3 + Н2О |
|
|
|
(1.26) |
||||||||
Выход метанола |
(ηCH3OH) |
в соответствии |
со |
||||||||||
стехиометрией |
уравнения |
|
(1.23) |
по |
|
оксиду |
|||||||
углерода(II) рассчитывают по формуле (1.27), а по |
|||||||||||||
водороду – по формуле (1.28). |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
(1.27) |
|||
|
|
|
= |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
∙ |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
(1.28) |
|||
|
|
|
= |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– полученное |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
количество |
|
|
молей |
|||||
|
|
|
|
|
метанола, |
|
|
|
|
||||
|
|
|
|
|
|
|
и |
|
|
|
– |
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
введенные |
|
|
|
в |
||||
|
|
|
|
|
систему |
количества |
|||||||
|
|
|
|
|
молей СО и Н2. |
|
|
||||||
Аналогичным образом может быть рассчитан выход по каждому из побочных продуктов. Очевидно, что практический выход не может превышать равновесный выход при условиях проведения процесса.
Для процессов, в которых нельзя выделить одну стехиометрическую реакцию образования целевого продукта и поэтому нельзя рассчитать выход описанным способом, определяют показатель, который также называют выходом или массовым выходом и

21
который представляет собой отношение массы полученного продукта к массе затраченного сырья. Например, выход этилена для процесса пиролиза фракций нефти находят как отношение массы этилена
кмассе поступившей в реактор фракции нефти.
1.2.3Селективность – важнейший показатель сложного ХТП, характеризующий эффективность превращения сырья в целевой продукт.
Селективность образования продукта по реагенту (φ) – это отношение количества этого реагента, превратившегося в продукт, к общему количеству превратившегося реагента.
В отличие от выхода, селективность учитывает только превратившийся реагент, поэтому этот показатель более чувствителен к соотношению различных направлений химического превращения. Для реакции (1.18) селективность образования продукта Р по реагентам А и В выразится формулами (1.29) и (1.30), в знаменателе которых, в отличие от формул для выхода (1.21) и (1.22), количество превращенного реагента. Символом N обозначены мольные количества веществ или мольные потоки (для
открытых |
систем, |
работающих |
в |
стационарном |
режиме). |
|
|
|
|
|
A |
|
|
|
|
N |
P |
a |
|
||||
|
|
P |
|
( N |
|
N |
|
) p |
|||||
|
|
|
|
A |
A |
||||||||
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
B |
|
|
|
N |
P |
b |
|
|||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||
|
P |
|
|
( N |
|
|
N |
|
|
) p |
|||
|
|
|
|
B |
B |
||||||||
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
(1.29)
(1.30)
Для селективности, также как для выхода, есть второе определение: селективность – это отношение
количества полученного практически продукта, к количеству этого продукта, которое должно было быть получено из прореагировавшего количества
22
реагента в соответствии со стехиометрией реакции,
по которой образуется этот продукт. |
|
|||
Если |
продукт |
образуется |
по |
нескольким |
реакциям, |
то |
селективность, |
как |
правило, |
рассчитать нельзя. |
|
|
|
|
Селективность, |
рассчитанную |
по |
формулам |
|
(1.29,1.30) называют интегральной в отличие от дифференциальной селективности.
Дифференциальной селективностью
(
'PA
)
образования продукта Р по реагенту А называют отношение скорости расходования реагента А на образование продукта Р к суммарной скорости превращения А. Рассчитывают дифференциальную селективность как отношение скоростей образования продукта и расходования реагента, умноженное на обратное отношение стехиометрических коэффициентов
(1.31 для |
реакции |
1.18). |
Член |
( |
|
|
∙ |
) |
в уравнении |
||||||
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
(1.31) |
равен |
скорости |
|
расходования |
А на |
||||||||||
образование Р. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
′ |
|
|
|
|
|
∙ |
|
|
|
|
|
||
|
|
|
→ |
|
|
|
|
|
|
|
|
|
|
(1.31) |
|
|
|
= |
|
= |
|
|
∙ |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Например, |
|
для |
|
реакции |
|
синтеза |
|||||||||
метанола |
(1.23) |
|
интегральную |
|
|
|
|
селективность |
|||||||
образования метанола по СО и по Н2 рассчитывают по формулам (1.32) и (1.33), соответственно.
|
|
∙ |
|
|
|
|
|||
|
|
|
|
|
|
|
|
(1.32) |
|
|
= |
( |
|
− )∙ |
|
||||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
∙ |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
(1.33) |
|
= |
( |
|
− |
|
)∙ |
|
||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||

|
23 |
1.2.4. Взаимосвязь |
степени превращения |
реагента, выхода и интегральной селективности образования продукта по этому реагенту легко
получить, |
перемножив |
|
выражения |
для |
степени |
||
превращения |
(1.19) |
и |
селективности |
(1.29). |
|||
Сократив |
одинаковые |
|
члены |
в |
числителе |
и |
|
знаменателе, получим (1.34) (сравнить с (1.21)).
|
A |
x |
|
|
A |
|
( N |
A |
N |
A |
) |
|
|
|
N |
P |
a |
|
|
N |
P |
a |
|||
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
P |
|
A |
|
P |
|
|
N |
|
|
|
|
( N |
|
N |
|
) p |
|
N |
|
|
p |
|||
|
|
|
|
|
|
|
|
A |
|
|
|
A |
A |
|
A |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
0 |
|
|
|
|
|
|
0 |
|
||
(1.34)
Очевидно, что для простых ХТП селективность равна единице (100%) для всех продуктов единственной реакции (стехиометрического уравнения). В этом случае выход каждого из продуктов реакции по любому из реагентов равен
степени превращения этого реагента ( |
|
= |
|
). |
|
|
|||||
|
|
|
|||
В случае сложных ХТП для получения |
высокого |
||||
выхода необходимо иметь высокие значения и степени превращения, и селективности. Если процесс протекает с полным превращением реагента, то выход продуктов по этому реагенту равен селективности образования каждого из продуктов по данному реагенту.
Например, в контактном окислении аммиака весь
поступающий |
в |
процесс |
аммиак |
реагирует, |
превращаясь |
в оксид азота |
и побочные |
продукты. |
|
Выход оксида азота на аммиак в этом случае равен селективности образования NO по аммиаку.
1.2.5.Производительность аппарата.
Производительность аппарата (П) - это масса (или объем) выработанного целевого продукта за единицу времени:
|
G |
|
|
П |
|
(кг/ч, |
т/ч, м /ч) |
t |

24
где G – масса (или объем) продукта, полученная за время t/
1.2.6.Интенсивность работы аппарата.
Интенсивностью работы аппарата (I) называют его производительность, отнесенную к какой-либо величине, характеризующей размеры данного аппарата. Обычно производительность относят к объему аппарата V или к площади его сечения S:
I |
П |
|
V |
||
|
(кг/м3 ч),
I
П S
(кг/м2 ч)
В каталитических процессах рассчитывают интенсивность работы катализатора, для чего массу полученного за единицу времени целевого продукта относят к объему катализатора Vk:
I |
П |
|
V |
||
|
||
|
k |
(кг/м ч)
1.2.7. Материальный баланс ХТП.
Материальный баланс ХТП является следствием закона сохранения массы вещества (а точнее – следствием сохранения элементов при химических превращениях). Это означает, что масса веществ, поступивших на технологическую операцию - приход, равна массе полученных веществ - расходу. Материальный баланс должен соблюдаться для ХТП всех типов: синтеза, разделения, очистки целевых продуктов. Данные о материальном балансе позволяют дать оценку целесообразности осуществления процесса в заданных условиях. Эти данные нужны как при проектировании новых, так и при анализе работы существующих производств. По данным материального баланса рассчитывают технологические показатели
|
|
|
25 |
|
|
|
процесса: |
выход |
целевого |
продукта, |
|
степень |
|
превращения |
сырья, |
селективность |
процесса, |
|||
расходные |
коэффициенты |
по |
сырью |
и |
т.д. |
|
Материальный баланс является необходимым элементом при расчете энергетического и эксергетического балансов.
Материальный баланс сводят, пользуясь уравнениями основной и побочных реакций. Когда учитывают не все происходящие побочные реакции и полученные побочные продукты, а лишь наиболее важные из них, материальный баланс имеет приблизительный характер. Существуют три основные формы составления материального баланса. В виде системы уравнений, таблицы и поточной диаграммы.
Уравнение материального баланса в общем виде:
GAO + GBO + ... = GR + ...+ GD +...+ GA + GB + DG,
где |
GAO , GBO |
- массы |
|
исходных реагентов |
|
|
(сырья). |
|
|
GR |
- масса целевого |
|
продукта, |
|
|
GD |
- масса побочного |
|
продукта, |
|
|
GА , GВ |
- массы |
|
непрореагировавших |
|
|
веществ, |
|
|
DG - невязка баланса. |
|
Невязка баланса является следствием потерь
сырья |
и |
продуктов при проведении |
процесса, |
неточности |
эксперимента и расчета, |
а также |
|
принятых допущений.
Чаще всего материальный баланс процесса представляют в виде таблицы:
26
Приход |
|
|
Расход |
|
||
|
|
|
|
|
|
|
Наименование |
Масс. |
% |
Наименование |
Масс. |
% |
|
|
ед. |
масс. |
|
|
ед. |
масс. |
|
|
|
|
|
|
|
Реагент А |
... |
... |
Целевой |
|
... |
... |
|
... |
... |
продукт R |
|
... |
... |
Реагент В |
Побочный |
|
||||
|
|
|
продукт D |
|
... |
... |
|
|
|
Реагент А |
|
||
|
|
|
(остаток) |
|
... |
... |
|
|
|
Реагент В |
|
||
|
|
|
(остаток) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Невязка |
|
... |
... |
Всего |
... |
100 |
Всего |
|
... |
100 |
В таблицу материального баланса, кроме обязательных масс и массовых процентов введенных и получающихся веществ, включают еще и объемы веществ, находящихся в газовой фазе, приведенные к нормальным условиям. Массовые проценты в столбце “Расход” рассчитывают по отношению к сумме масс введенных реагентов в столбце “Приход”, т.е. массу всех введенных реагентов принимают за 100%. Может случиться, что из-за погрешностей эксперимента и допущений, принятых при расчете, масса полученных веществ окажется больше массы введенных. Тогда невязка баланса будет иметь отрицательное значение. Материальный баланс составляют на заданный базис. Обычно базисом является масса сырья или целевого продукта (кг, т) или продолжительность процесса (ч, сутки). В лабораторных исследованиях составляют баланс за время проведения опыта.
В дальнейшем производят пересчет на заданный базис, пользуясь коэффициентом пересчета. Коэффициент пересчета показывает, во сколько раз нужно изменить массы веществ, входящих в материальный баланс, при переходе на другой базис.

27
Так, если в материальном балансе, составленном за время проведения опыта, получили GR грамм целевого продукта, а заданный базис расчета - 1000 г целевого продукта, коэффициент пересчета равен
1000 / GR.
В названии таблицы материального баланса указывают, для какого процесса и реактора произведен расчет, а также принятый базис расчета.
Поточная диаграмма это блок-схема (рис.1.3). Материальные потоки изображают в виде полос, ширина которых пропорциональна массе в выбранном масштабе. Основным преимуществом данного способа изображения является его наглядность.
1 |
СИНТЕЗ |
|
|
|
АММИАКА |
|
2 |
|
КОНДЕНСАЦИЯ |
|
И СЕПАРАЦИЯ |
3 |
4 |
Рис.1.3. Поточная диаграмма колонны синтеза аммиака:
1- свежий газ;
2- циркулирующий газ;
3- жидкий аммиак и растворенные в нем газы;
4- отдувочные газы
1.2.8.Расходные коэффициенты по сырью. К
основным показателям ХТП относятся расходные коэффициенты, характеризующие затраты сырья, воды, топлива, электроэнергии, пара на единицу массы целевого продукта. В связи с большим вкладом затрат на реагенты (сырье) в себестоимость продуктов в химической технологии особое значение имеют расходные коэффициенты по реагентам. Различают теоретические и практические расходные
коэффициенты. Теоретический расходный коэффициент

28
стех рассчитывают, пользуясь стехиометрическим
уравнением, описывающим химическое превращение
(1.18):
|
|
|
GA |
|
M |
A |
a |
|
|
G |
0 |
M |
p |
||||
|
|
|
|
|||||
|
стех |
|
стех |
|
|
|||
|
|
|
P |
|
P |
|||
|
|
|
|
|
|
|
||
где GA0 и
G |
стех |
|
P |
||
|
- массы
реагента и продукта из уравнения реакции
MA и MP -
молекулярные массы реагента и продукта
а и р -
стехиометрические коэффициенты.
Теоретический расходный коэффициент характеризует минимальный расход сырья на получение единицы массы продукта.
Практический расходный коэффициент отражает реальный расход поступившего в процесс сырья на получение единицы массы продукта, т.е. его рассчитывают как отношение массы поступившего в
процесс сырья
GР:
GA0
к массе получившегося продукта
|
G |
A |
|
|
|||
|
|
|
0 |
|
G |
P |
|
|
|
|
|
Расходные коэффициенты рассчитывают по всем реагентам. Практические расходные коэффициенты всегда больше стехиометрических из-за неполноты превращения сырья, а также из-за расходования сырья на побочные реакции. Данные для расчета практических расходных коэффициентов берут из материального баланса процесса. Практический расходный коэффициент по реагенту можно найти,

29
зная теоретический расходный коэффициент и выход целевого продукта по этому реагенту:
A стехA P
P PA
где
P |
- выход |
A |
|
реагенту А единицы.
Рпо
вдолях
1.3. Технологические параметры ХТП
1.3.1. Время пребывания исходных веществ в реакционной зоне.
На выход целевого продукта и интенсивность работы аппарата влияют не только температура, давление, концентрации исходных веществ, но и длительность пребывания этих веществ в зоне реакции. В аппаратах периодического действия время пребывания реагентов - это интервал времени между загрузкой и выгрузкой аппарата. В аппаратах непрерывного действия время пребывания исходных веществ в реакционной зоне определяют следующим образом:
|
|
V |
|
|
|
|
V |
|
|
|
|
|
|
t , p |
|
|
|
где |
|
|
V - реакционный |
||
|
|
объем, м3 (полезный |
|||
|
|
объем аппарата), |
|||
|
|
|
Vt,p |
- |
расход |
|
|
исходных |
|
веществ, |
|
|
|
поступающих |
в |
||
|
|
реакционный |
|
||
|
|
аппарат |
|
при |
|

30
температуре и давлении в аппарате,
м /с.
Это уравнение позволяет получить истинное время пребывания только в идеальном случае, когда все частицы в потоке имеют одинаковую скорость и, следовательно, одинаковое время пребывания в реакционной зоне. В общем случае рассчитанное таким образом время пребывания является средней
величиной ср. |
|
|
|
|
|
Для |
каталитических |
процессов |
рассчитывают |
||
время |
соприкосновения |
исходных |
веществ |
с |
|
катализатором. |
Его |
называют |
временем |
||
контактирования. Время контактирования находят из отношения свободного объема катализатора Vсв к расходу исходных веществ Vt,p, проходящих через катализатор при условиях процесса.
|
V |
|
св |
||
|
||
|
V |
|
|
t ,p |
(1.35)
Свободный объем катализатора - это объем пустот между зернами и в сетках катализатора. Свободный объем Vсв рассчитывают как произведение объема катализатора Vk на долю свободного объема :
V |
V |
|
св |
k |
|
Иногда рассчитывают условное время контактирования, используя объём исходных реагентов, приведенный к нормальным условиям.
Vсв
у
Vну
При расчете времени контактирования во взвешенном слое катализатора свободный объем

31
находят как разность между объемом, занимаемым катализатором во взвешенном состоянии, Vвзв, и объемом твердых частиц катализатора Vk(1- ):
V |
V |
V |
( 1 ) |
св |
взв |
k |
|
Если катализатор выполняется в виде сетки, его свободный объем рассчитывают по формуле:
Vсв
3 m S d
где - доля свободного объема катализатора,
m |
- |
число сеток, |
|
S |
- |
рабочая |
|
площадь сетки, м2, |
|||
d |
- |
диаметр нити |
|
сетки, м, |
|
|
|
3 |
|
- |
числовой |
коэффициент, |
учитывающий |
||
увеличение |
|
толщины |
|
сетки |
при |
|
переплетении |
нитей. |
|
|
|
1 1,57 d |
n |
где d - диаметр нити сетки, см;
n - число плетений сетки на 1 см2.
В качестве примера рассмотрим расчет времени контактирования реагентов для синтеза дивинила.
Исходные данные:

32
В реактор поступает 40 г/ч 95%-го (масс.) этанола. Температура в реакторе 400ОС, давление - 740 мм рт.ст. Объем катализатора 60 мл, доля свободного объема катализатора - 0,6.
|
|
|
|
V |
св |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
t , p |
|
|
|
|
|
|
|
|
|
|
||
V |
V |
60 10 |
6 |
0,6 36 10 |
6 |
3 |
||
|
|
|||||||
св |
k |
|
|
|
|
|
|
м |
|
|
V |
V |
|
V |
|
|
|
|
|
t ,p |
1,t ,p |
|
2 ,t ,p |
|
|
|
|
|
|
где V1,t,p и V2,t,p |
- расходы |
||||
|
|
|
|
|
|
паров этанола и воды, |
||
|
|
|
|
|
|
поступающих в реактор |
||
|
|
|
|
|
|
при условиях |
|
|
|
|
|
|
|
|
процесса, |
м /с. |
|
Таким образом,
V |
|
|
( 40 0,95 / 46 40 0,05 / 18 ) 22,4 ( 273 400) 760 |
13,3 10 |
6 |
||
|
|
|
|
||||
t ,p |
3600 10 |
3 |
273 740 |
|
|||
|
|
|
|
||||
|
|
|
|
|
|
||
м3/с,
Окончательно,
где 46 и 18 - молекулярные массы этанола и воды.
|
36 10 |
6 |
2,7 |
|
||
|
|
|
сек |
|||
13,3 10 |
6 |
|||||
|
|
|||||
|
|
|
|
|||
1.3.2. Объемная скорость. Кроме времени пребывания исходных веществ в реакционной зоне для оценки условий проведения процесса рассчитывают объемную скорость. Объемная скорость W - это объем исходных веществ, поступающих в реакционный аппарат в единицу времени в фазовом состоянии, соответствующем условиям проведения процесса (для

33
газофазных процессов – в газообразном состоянии), отнесенный к единице реакционного объема.
Для нахождения объемной скорости расход исходных веществ берут как при условиях проведения процесса (температуре и давлении в реакторе), так и при нормальных условиях (условная объемная скорость):
Wt , p Vt , p (м /м3∙ч=ч-1)
V
или
Wн . у . VVн . у .
где V - объем реактора.
Объемная скорость и время пребывания исходных веществ в реакционной зоне связаны соотношением
W |
t , p |
|
|
1 |
|
|
||
|
В каталитических процессах вместо реакционного объема в расчете объемной скорости используют объем катализатора Vk:
W |
|
|
V |
|
t , p |
||
|
|
|
|
|
t , p |
|
V |
|
|
|
|
|
|
|
k |
Аналогично рассчитывают условную объемную скорость:
Wн . у . Vн . у .
V
k
34
35
Раздел 2
Технология неорганических веществ
36
2.1.Каталитическое окисление аммиака
2.1.1.Цель работы. Знакомство с основными закономерностями и обоснованием выбора условий
реализации сложного, необратимого, каталитического, гетерогенного процесса и расчет основных технологических показателей.
2.1.2.Введение
Внастоящее время практически единственным промышленным способом получения азотной кислоты является контактное окисление аммиака кислородом воздуха с последующим поглощением полученных оксидов водой. Стадия окисления аммиака во многом, определяет показатели всего производства азотной кислоты: от условий и качества ее проведения зависят расходные коэффициенты по аммиаку, платиновым металлам, энергии, т.е. основные
показатели, влияющие на экономику процесса. Процесс окисления аммиака - сложный и может с
одинаковой |
вероятностью |
протекать |
как |
с |
||
образованием |
оксида |
азота |
(II), |
так |
и |
|
молекулярного азота и оксида азота (I). В этом случае определяющими факторами являются активность
37
и селективность используемого катализатора и оптимизация технологических условий процесса.
2.1.3. Теоретические основы процесса
Химия процесса и равновесие.
Окисление аммиака кислородом воздуха до оксида азота (II) является первой стадией процесса получения азотной кислоты. Наряду с основной реакцией окисления аммиака до оксида азота (II) (2.1.1)(здесь и далее приведены тепловые эффекты реакции):
4NH3 + 5O2 = 4NO + 6H2O 946 кДж/моль (2.1.1)
происходит окисление аммиака до элементарного азота и оксида азота (I):
4NH3 |
+ 3O2 |
= 2N2 + 6H2O |
1328 кДж/моль |
(2.1.2) |
4NH3 |
+ 4O2 |
= 2N2O + 6H2O |
1156 кДж/моль |
(2.1.3) |
При определенных условиях возможна диссоциация аммиака
2NH3 = N2 + 3H2 – 91 кДж/моль (2.1.4)
а также последовательные реакции, приводящие к образованию элементарного азота (2.1.5 и 2.1.6):
2NO = N2 + O2 180 кДж/моль (2.1.5)
4NH3 + 6NO = 5N2 + 6H2O 1810 кДж/моль |
(2.1.6) |
38
Таким образом, окисление аммиака - процесс сложный/
Константы равновесия реакций (2.1.1-2.1.3) характеризуются очень большими величинами (значительно больше 102) и, следовательно, все эти
реакции |
необратимы. |
Реакция |
диссоциации |
аммиака |
(2.1.4) в интервале |
температур |
от -86 до |
500°С обратима, при температурах выше 500°С она почти нацело смещена в сторону продуктов разложения аммиака. Например, при 800°С и 0,1 МПа равновесная концентрация аммиака составляет 0,011%, а при 1 МПа – 0,12% объем.
Таким образом, в широком диапазоне изменения температуры исходное вещество (аммиак) нацело превращается в конечные продукты. Поскольку
окисление аммиака - процесс сложный, |
и |
кроме |
||
оксида азота (II) получаются побочные продукты: |
||||
азот и оксид азота (I), то |
выбор |
условий |
||
проведения |
процесса определяется |
необходимостью |
||
направить |
взаимодействие исходных |
веществ |
по |
пути |
образования оксида азота (II). С учетом практической необратимости рассматриваемых реакций, этого можно достичь только путем создания условий, при которых скорость основной реакции будет значительно превышать скорости побочных реакций. И чем значительней будет эта разность скоростей, тем выше будет практический выход оксида азота(II).
Кинетика процесса.
Некаталитическое окисление аммиака в газовой фазе при высоких температурах протекает не с образованием оксида азота (II) (2.1.1.), а с образованием азота (2.1.2). Для реализации реакции (2.1.1) необходим селективный катализатор, активно адсорбирующий кислород. В промышленности чаще всего применяют платино-родиевые сплавы (кроме платины до 10% родия, палладия, рутения,
39
осмия и др.) в виде сеток. Окисление аммиака на этом катализаторе протекает очень быстро, при времени контактирования порядка 10-4 с, а выход NO составляет примерно 98%. Неплатиновые катализаторы, состоящие из оксидов железа и хрома, дают выход оксида азота (II) около 96%, но скорость реакции примерно в 100 раз меньше. В промышленности часто используют комбинированный катализ с окислением вначале на платиновых сетках, а потом - на оксидном катализаторе.
Скорость гетерогенного каталитического процесса зависит от величины поверхности катализатора. Для увеличения поверхности и сокращения диффузионного пути молекул платиновый катализатор изготавливают в виде сеток из тончайших нитей диаметром 0,09 мм с числом ячеек -
1024 на см2 (ГОСТ 31930-74).
Окисление аммиака на платиновом катализаторе протекает в несколько стадий:
1)диффузия реагирующих веществ из газового объема к поверхности катализатора;
2)активированная адсорбция кислорода на активных центрах катализатора с образованием
поверхностного |
комплекса (катализатор-кислород), |
из которого |
затем образуется новый комплекс |
(катализатор - кислород - аммиак);
3)стадии превращения последнего комплекса с образованием оксида азота (II) и воды;
4)десорбция продуктов реакции с поверхности катализатора (NO и H2O обладают небольшой адсорбционной способностью при температурах процесса и легко удаляются с поверхности);
5)диффузия продуктов реакции в газовый
объем.
Химические превращения на поверхности
платинового катализатора способны |
протекать |
в |
|
100 |
раз быстрее, чем диффузия реагентов из объема |
||
к |
поверхности катализатора. |
Очевидно, |
что |
|
|
40 |
|
наблюдаемая |
скорость |
каталитического |
окисления |
аммиака будет определяться скоростью |
диффузии |
||
того реагента, который находится в недостатке. |
|||
Механизм |
процесса |
окисления аммиака на |
|
поверхности катализатора схематично представлен на
рис. 2.1.1. |
|
|
|
Оксид |
азота(II) |
образуется |
при |
взаимодействии молекул аммиака с кислородом, адсорбированным на активных центрах катализатора.
Реакция |
окисления |
|
аммиака |
до |
азота |
по |
реакции |
(2.1.2) |
в |
отсутствие |
катализатора |
||
(окисление в объеме) протекает со скоростью значительно меньшей, чем каталитическое окисление NH3 до NO на платиновом катализаторе. Разложение аммиака на N2 и H2 (2.1.4) на том же катализаторе в отсутствие кислорода протекает со скоростью, сравнимой со скоростью окисления аммиака до NO. Но в присутствии избытка кислорода скорость разложения аммиака на азот и водород мала даже при температурах около 1000°С. Реакции (2.1.2) и (2.1.4) ускоряются на активных центрах катализатора, свободных от кислорода, а также при соприкосновении аммиачно-воздушной смеси с разогретыми трубопроводами и стенками аппаратов. Каталитическое воздействие стенок трубопроводов и аппаратов начинается при температурах около 200оС и с повышением температуры возрастает. Поэтому для предотвращения образования азота в предкатализаторной зоне контактные аппараты, теплообменники и трубопроводы изготавливают из сплавов алюминия, никеля, хромоникелевых сплавов.
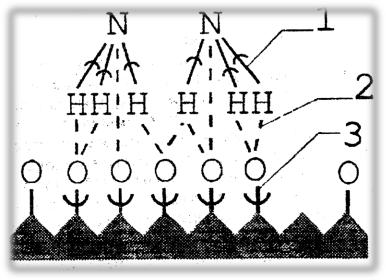
41
Рис.2.1.1 Схема окисления аммиака кислородом на поверхности платинового катализатора:
1– старые связи,
2– вновь образовавшиеся связи,
3– место разрыва связей.
Скорость диссоциации NO при температурах ниже 1000°С в отсутствие катализатора очень мала: в
условиях |
окисления |
аммиака |
диссоциация |
N0 |
|||
ускоряется, |
но |
все |
же |
константа |
скорости |
||
диссоциации |
NO |
в 180 |
раз |
меньше |
константы |
||
скорости окисления NH3 в NO, так как вероятность адсорбции NO в присутствии избытка кислорода очень мала. Скорость образования N2O в условиях получения оксида азота (II) незначительна, так как
выход |
оксида |
азота |
(I) |
составляет |
всего |
0,005 |
- 0,009% на аммиак. |
|
|
|
|
Из |
рассмотрения кинетики |
реакций ясно, что |
|||
доля поверхности катализатора, занятая химически адсорбированным кислородом, определяет соотношение
количеств NO и |
N2, получаемых на катализаторе. |
||||
Для |
повышения |
селективности |
катализатора |
||
необходимо |
обеспечивать |
наибольшее |
насыщение |
||
катализатора кислородом. |
|
|
|||
|
Степень |
занятости |
активных |
центров |
|
катализатора |
кислородом в |
значительной степени |
|||
42
зависит от температуры и концентрации кислорода в поступающей газовой смеси. Связывание кислорода с поверхностью катализатора в зависимости от температуры может происходить как за счет физической адсорбции, так и за счет хемосорбционных процессов. Физическая адсорбция и хемосорбция - процессы экзотермические, а значит, равновесное содержание сорбированного на катализаторе кислорода уменьшается с повышением температуры (рис.2.1.2). Физическая адсорбция даже при низких температурах протекает достаточно быстро и поэтому до значения t1 кривая представляет
собой |
равновесную кривую |
физической |
адсорбции |
газа. |
При t1 одновременно с |
физической |
адсорбцией |
начинает протекать с небольшой скоростью и хемосорбция. С повышением температуры скорость хемосорбции возрастает, и при температуре t2 количество адсорбированного газа приближается к равновесному.
При дальнейшем повышении температуры происходит разрыв связей между адсорбированным газом и активными центрами катализатора, что приводит к резкому снижению количества адсорбированного вещества. Это снижение обусловлено тем, что наряду с возрастанием
константы |
скорости |
сорбции |
с |
повышением |
температуры |
начинает |
сказываться |
смещение |
|
равновесия в сторону десорбции. Скорость десорбции растет быстрее, чем скорость сорбции. Таким образом, практическая кривая адсорбции имеет минимум и максимум.
2.1.4. Выбор оптимального технологического режима.
Выбор оптимальных условий для сложного необратимого каталитического процесса сводится к созданию такого технологического режима, который обеспечивал бы высокую скорость основной реакции.
43
Это в первую очередь определяется правильным подбором катализатора и условий, обеспечивающих его высокую селективность и активность.
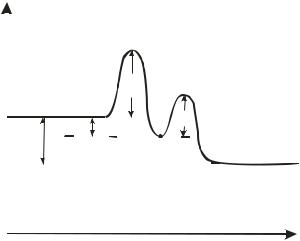
Температура. На платиновом катализаторе с изменением температуры практический выход оксида азота (II) изменяется по кривой с максимумом (рис.2.1.3). Такой характер кривой определяется влиянием температуры на возможность протекания побочных реакций и на их скорость.
При низких температурах, примерно до 500°С, когда количество адсорбированного кислорода сравнительно невелико, окисление аммиака протекает в основном с образованием элементарного азота (2.1.2), некоторого количества оксида азота(II) и, возможно, оксида азота(I).
Количество адсорбированного кислорода Количество адсорбированно го газа
1
 2
2
3
|
|
t |
1 |
t |
2 |
t, |
o |
C |
|
|
|
||||||
|
|
|
|
|
|
|
||
Рис.2.1.2 Зависимость количества адсорбированного |
||||||||
кислорода от |
температуры: |
|
|
|
|
|||
1 |
– равновесная кривая физической адсорбции, |
|||||||
2 |
и |
3 – |
|
равновесная |
|
и практическая кривые |
||
хемосорбции.
|
100 |
|
|
80 |
|
,% |
60 |
|
NO |
||
|
||
|
|
|
|
40 |
|
|
20 |
44
2
1
400 |
600 |
800 |
1000 |
|
|
t,oС |
|
Рис.2.1.3 Зависимость практического выхода оксида азота (II) от температуры при разных давлениях :
1 – 0,1 МПа,
2– 0,8 МПа.
Сповышением температуры до 700-800°С выход NO возрастает, так как увеличивается доля активных
центров катализатора, занятых кислородом (кривая 3, рис.2.1.2) и растет скорость диффузии исходных веществ к поверхности катализатора. При дальнейшем повышении температуры происходит десорбция кислорода, и резко возрастают скорости побочных каталитических реакций и реакций, протекающих в объеме. В результате снижается выход оксида азота(II) и возрастает выход элементарного азота. При выборе температуры окисления аммиака необходимо учитывать другой фактор, влияющий на экономические показатели процесса - потери дорогостоящей платины, которые возрастают с повышением температуры.
Необходимый температурный режим в реакторе может быть обеспечен теплом, выделяющимся при реакциях окисления аммиака, т.е. окисление аммиака
проводят автотермически. |
|
|
||
Состав |
исходной |
смеси. |
Для |
обеспечения |
высокого выхода оксида азота (II) |
необходимо |
|||
проводить |
процесс |
при |
избытке |
|
45
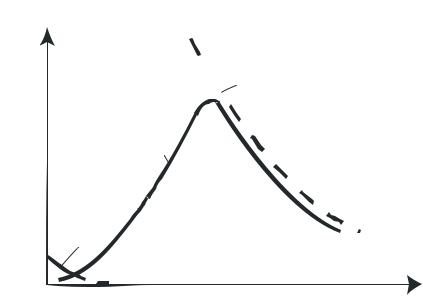
кислорода (рис. 2.1.4). При стехиометрическом отношении кислорода к аммиаку (см. реакцию (2.1.1)), равном 1,25, часть активных центров катализатора не заполняется кислородом, что способствует реакциям разложения аммиака, окисления его до N2 и, возможно, до N2O. В промышленности при использовании платино-родиевых сеток объемное отношение поддерживается в пределах
1,7 - 1,9.
Повышение отношения кислорода к аммиаку свыше двух незначительно сказывается на выходе оксида азота (II), но приводит к снижению концентрации оксида азота (II) в нитрозных газах за счет введения воздуха, что отрицательно сказывается на работе абсорбционного отделения, где происходит поглощение нитрозных газов водой с образованием азотной кислоты. При использовании неплатиновых катализаторов отношение кислорода к аммиаку должно быть более двух.
Аммиачно-воздушные смеси способны взрываться, причем с повышением температуры газовой смеси границы взрываемости аммиачно-воздушных смесей расширяются и взрыв происходит при более низкой концентрации аммиака. Например, при температуре 250°С пределы взрываемости аммиачно-воздушной смеси находятся при содержании аммиака в смеси от 14 до 30% объем., а при температуре 450 оС - от 12,3 до 33,9% объем. Практически применяемые аммиачно-воздушные смеси при концентрации в них аммиака 9.5-11,8% объем. не взрывоопасны.
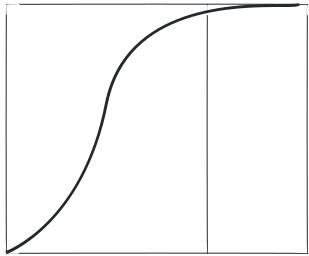
46
NO
100
80
60
40
20
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
Объемное отношение O2 : NH3
Рис.2.1.4 Зависимость практического выхода оксида азота (II) от объемного отношения кислорода к аммиаку.
Давление. Процесс окисления аммиака является стадией производства азотной кислоты, включающей еще стадии окисления оксида азота(II) в оксид азота(IV) и абсорбцию последнего водой. Проведение всех стадий под небольшим давлением имеет ряд
преимуществ: |
повышается |
производительность, |
||||
значительно |
возрастает |
скорость |
последующих |
|||
стадий |
в производстве |
азотной кислоты: |
реакции |
|||
2NO + O2 = 2NO2 |
и абсорбции нитрозных газов |
водой, |
||||
уменьшается объём аппаратов. |
|
|
|
|||
Повышение давления имеет большое значение для |
||||||
работы |
агрегатов большой |
единичной |
мощности. |
|||
Однако с повышением давления |
затрудняется процесс |
|||||
десорбции продуктов каталитического окисления с поверхности катализатора в объём. Для компенсации этого необходимо повышать температуру процесса. Чем выше давление, тем более высокая температура требуется для достижения одного и того же выхода оксида азота(II) (рис.2.1.3). Давление в процессе окисления аммиака связано с температурой.
Рекомендуются следующие сочетания температуры и давления:
47
Давление процесса, |
0,1 |
0,304-0,51 |
0,71-1,011 |
МПа |
|
|
|
|
|
|
|
Температура, °С |
780-800 |
850-870 |
880-920 |
|
|
|
|
Однако с повышением температуры увеличиваются потери платины. Потери платины из-за летучести образующихся на ее поверхности оксидов и ее эрозии
составляют при 900 - 950 С и 0,8 МПа 250 - 400 мг на 1 т 100% HNO3. Часть платины осаждается на стенках коммуникаций и может быть собрана и регенерирована (до 50 - 70% Pt). Потери платины могут быть уменьшены за счет добавок других металлов 8-ой группы (Pd, Rh, Ru).
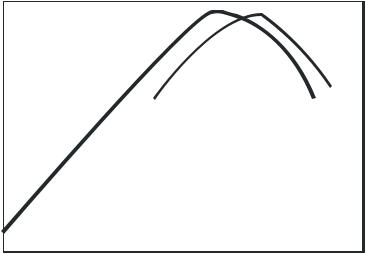
Время контактирования (рис.2.1.5). Реакция окисления аммиака происходит во внешнедиффузионной области, и поэтому увеличение объемной скорости оказывает положительное влияние на интенсивность процесса. С повышением, до определенного предела, объемной скорости поток газовой смеси становится более турбулентным, что увеличивает скорость диффузии исходных веществ к поверхности катализатора. Наряду с этим уменьшается время соприкосновения газовой смеси с горячими стенками аппаратов, что снижает возможность окисления
аммиака |
до азота. При дальнейшем росте объемной |
||
скорости |
(уменьшении времени контактирования |
|
) |
|
|||
возможен проскок аммиака, который за контактной зоной превращается в элементарный азот при окислении кислородом. Не исключена также возможность образования азота при взаимодействии аммиака с оксидом азота (II).
В заводских условиях в зависимости от качества катализатора и точности соблюдения
заданного технологического режима |
достигается |
|||
значительная |
селективность процесса, и выход |
|||
оксида азота (II) составляет 92 - 98%. При |
||||
оптимальных |
условиях |
проведения |
процесса |
и |

48
правильном подборе конструкционных материалов побочные реакции (2.1.3), (2.1.5), (2.1.6) не имеют существенного значения.
,% NO
90 |
|
|
|
|
70 |
|
|
|
|
50 |
|
|
|
|
30 |
|
|
|
|
10 |
2,5 |
5,0 |
|
7,5 |
|
|
|||
|
|
.10 |
4 |
сек |
|
|
|
Рис.2.1.5 Зависимость практического выхода оксида азота(II) от времени контактирования.
2.1.5. Схема лабораторной установки
Схема представлена на рис 2.1.6. Газообразный аммиак из баллона 1 через ротаметр 2 поступает в смеситель 3. Ротаметр 2 не калиброван и является лишь индикаторным прибором, регистрирующим заданный расход аммиака (h мм). Расход аммиака
регулируется вентилем А. Воздух подается с помощью воздуходувки 4, очищается от масла в фильтре 5, заполненном стеклянной ватой, затем поступает в смеситель 3. Расход воздуха замеряется ротаметром 6 и регулируется вентилем Б. Аммиачновоздушная смесь поступает в верхнюю часть контактного аппарата 7 и проходит через комбинированный катализатор (одну платиновую сетку
49
и слой оксидного катализатора). Полученные нитрозные газы по нижней трубке направляют на нейтрализацию.
Контактный аппарат состоит из трех частей: верхнего стального конуса, футерованного алюминием; средней цилиндрической части и нижнего конуса, изготовленного из хромоникелевой стали. С целью снижения потерь тепла аппарат снаружи покрыт теплоизоляцией. Между фланцами верхнего конуса и цилиндрической частью зажат фланец катализаторной корзины 8 для таблеток неплатинового катализатора. Над корзиной укреплена платиновая сетка. Для измерения температуры в зоне катализатора в качестве датчика используют термопару 9. В верхний конус контактного аппарата вмонтирована платиновая спираль 10, которая разогревается электрическим током от сети через ЛАТР: сила тока контролируется амперметром. Аппарат имеет смотровое стекло 11 для наблюдения за разогреванием катализатора. Трубка с краном В служит для отбора аммиачно-воздушной смеси, поступающей в контактный аппарат, трубка с краном Г - для отбора нитрозных газов. Трубка с краном Д необходима для слива слабой азотной кислоты, образующейся при частичной конденсации влажных нитрозных газов.
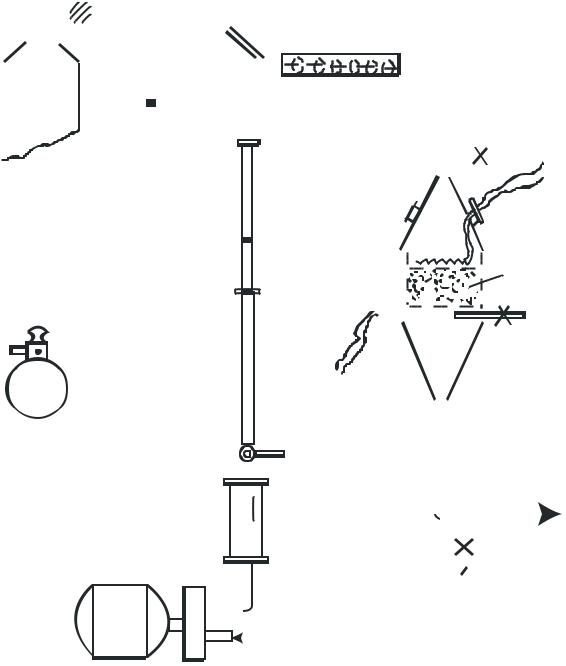
50
A
3
NH |
1 |
2 |
3 |
|
|
|
|
B |
6 |
11 |
10 |
|
|
|
|
7 |
8 |
|
9 |
Г |
|
|
12 Б
5 |
Д |
|
4 |
воздух |
|
Рис.2.1.6 Схема лабораторной установки для окисления аммиака: 1 – баллон; 2,6 – ротаметры; 3 – смеситель; 4 – воздуходувка; 5 – фильтр; 7 – контактный аппарат: 8 – катализаторная корзина; 9 – термопара; 10 – спираль; 11 – смотровое окно; 12 – колба для отбора пробы газа.
2.1.6. Порядок проведения опыта
51
1.Подготовка колб для отбора газовых проб.
1.1Круглодонные колбы с пришлифованными пробками должны быть вымыты. Горловины колб и шлифы очищают от остатков смазки фильтровальной бумагой, наносят на шлиф пробки и горловину
вакуумную смазку и тщательно притирают (шлифы после смазки и притирания должны быть совершенно прозрачными).
1.2.В колбу, предназначенную для анализа
аммиачно-воздушной смеси, наливают из бюретки
25 мл 0,1 н раствора серной кислоты и 3 капли индикатора метилового красного. В другую колбу,
предназначенную для анализа нитрозных газов,
наливают 25 мл 0,1 н раствора гидроксида натрия и добавляют 3 капли того же индикатора. Затем пробки на колбах вновь притирают.
1.3.Колбы помещают поочередно в защитное устройство из металлической сетки и откачивают воздух вакуумным насосом до момента закипания жидкости. После этого поворачивают пробку так, чтобы отверстие в ней не совпадало с отверстием в горлышке колбы.
1.4.Взвешивают колбы на электронных весах.
2.Техника проведения эксперимента.
2.1. Включают воздуходувку 4 и устанавливают вентилем Б заданный расход воздуха.
2.2. Осторожно поворачивая вентиль А, устанавливают заданный расход аммиака. Во избежание получения взрывчатой смеси содержание аммиака в аммиачно-воздушной смеси не должно превышать 11% объем. (не более 45 дел.(!)).
2.3. Для начала реакции необходимо разогреть катализатор, для чего включают платиновую спираль 10.
52
2.4. При достижении в контактном аппарате температуры 300°С выключают ток, проходящий через спираль. В дальнейшем температура в контактном аппарате будет поддерживаться за счет тепла выделяющегося при реакции.
После установления постоянной температуры в контактном аппарате отбирают пробы аммиачновоздушной смеси и смеси нитрозных газов. Эта операция выполняется двумя студентами следующим образом:
1. Проводят отдувку нитрозных газов для чего открывают кран Г и в течение нескольких секунд выпускают газ в выхлопную линию.
2.Присоединяют подготовленную колбу с кислотой к газоотборной трубке с краном В, а со щелочью к газоотборной трубке с краном Г.
3.Открывают краны В и Г.
4.Осторожно поворачивают пробки так, чтобы отверстия на них близко подошли к отросткам на горловинах колб.
5.Одновременно по счету «раз» дополнительным поворотом пробок обеспечивают поступление газа в колбы.
6.Через 3 - 4 с поворачивают пробки в
первоначальное |
положение, |
прекращая, |
таким |
образом, доступ газа в колбы, перекрывают |
краны В |
||
и Г, и отсоединяют колбы. |
|
|
|
7.Прекращают подачу аммиака, затем после
полного охлаждения контактного аппарата выключают воздуходувку.
8. Определяют концентрации аммиака в аммиачновоздушной смеси и оксида азота (II) в нитрозных газах (см. 6. Контроль процесса). Если нужно провести опыт при других условиях, то изменяют расход воздуха или аммиака и вновь отбирают пробы газовых смесей на анализ после установления
постоянной температуры в реакторе. |
|
||
Экспериментальные |
и |
расчетные |
данные |
записывают по прилагаемой форме. |
|
||
53
Экспериментальные и расчетные данные
Дата |
__._______.____ г. |
|
Расход воздуха при условиях |
|
|
лаборатории |
|
_____ л/мин |
Перепад давления в расходомере для |
|
|
воздуха |
|
_____ мм |
Расход аммиака при условиях |
|
|
лаборатории (расч. после анализа) |
_____ л/мин |
|
Перепад давления в расходомере для |
|
|
аммиака |
|
_____ мм |
Температура в контактном аппарате |
_____ °С |
|
Данные о катализаторах: |
|
|
платиновый: |
|
|
число сеток |
|
_____ |
рабочая площадь сетки |
|
_____ м2 |
диаметр нити сетки |
|
_____ мм |
число петель на 1 см2 |
|
_____ |
неплатиновый: |
|
|
объем катализатора |
|
_____ мл |
доля свободного объема |
|
_____ |
Температура в лаборатории |
|
_____ оС |
Барометрическое давление |
_____ |
мм. рт. ст. |
Время контактирования: |
|
|
для платинового катализатора |
|
_____ с |
для неплатинового катализатора |
_____ с |
|
Интенсивность платинового катализатора |
_____кг/ч·м3 |
|
Интенсивность неплатинового |
|
|
катализатора |
|
_____кг/ч·м3 |
Объемное отношение кислорода к аммиаку |
_____ |
|
Практический выход оксида азота (II) |
_____ % |
|
Контроль процесса
54
После отбора газовых проб колбы взвешивают. Для полноты поглощения круговыми движениями непрерывно перемешивают содержимое колб в течение 40 мин. Затем открывают пробки, смывают с них дистиллированной водой капли раствора и производят титрование. В колбе с пробой аммиачно-воздушной смеси оттитровывают избыток кислоты 0,1 н раствором щелочи. В колбе с пробой нитрозных газов оттитровывают избыток щелочи 0,1 н раствором кислоты.
Результаты анализа газовых фаз заносят в табл.2.1.1.
Таблица 2.1.1
Анализ газовых фаз
Определение |
Определение |
содержания NH3 |
содержания NO |
в исходном газе |
в нитрозных |
|
газах |
№ колбы
Масса колб, г: после отбора пробы до отбора пробы
Навеска, г |
|
|
|
|
Кол-во ратвора NaOH, мл |
|
|
|
|
исходное |
|
|
|
|
на обратное титрование |
|
|
|
|
Кол-во ратвора H2SO4, мл |
|
|
|
|
исходное |
|
|
|
|
на обратное титрование |
|
|
|
|
С |
|
= __ % масс. |
С |
= __ % масс. |
|
|
|
|
На основании полученных аналитических данных рассчитывают концентрацию аммиака в аммиачно-
55
воздушной смеси и оксида азота (II) в нитрозных газах:
C |
NH |
|
3 |
a |
N |
1 |
1 |
|
b N |
2 |
17 100 |
|
2 |
|
|
|
1000 g |
1 |
||
|
|
|
|
, % масс.
C |
NO |
|
a |
N |
2 |
2 |
|
b N |
1 |
30 100 |
|
1 |
|
|
|
1000 g |
2 |
||
|
|
|
|
, % масс.
где |
N1 и N 2 - нормальности кислоты и |
|
щелочи соответственно |
g |
1 |
и |
g |
2 |
- навески проб аммиачно- |
|
|
||||
|
воздушной смеси и нитрозных |
||||
|
газов, |
соответственно, г; |
|||
a |
1 |
|
и |
a |
2 |
- количества кислоты или |
|
щелочи, соответственно, взятые для поглощения, мл.
b1
и |
b |
2 |
- |
количества кислоты или |
|
щелочи, соответственно, пошедшие на обратное титрование, мл.
На основе полученных данных рассчитывают выход оксида азота(II) по аммиаку, который в предположении 100 % степени превращения аммиака совпадает с селективностью):
|
CNO |
MNH3 |
|
|
NONH3 |
MNO |
|
100 (%) |
|
CNH3 |
|
|||
|
|
|
||

56 |
|
где M NO и |
MNH3 |
массы оксида аммиака.
- молекулярные азота (II) и
Технологические расчеты
На основании полученных данных рассчитывают приближенный материальный баланс контактного аппарата. Определяют содержание аммиака и воздуха в аммиачно-воздушной смеси в объемных процентах. Для этого пользуются формулой:
С |
NH |
|
|
3 о б ъем. |
|
где
C |
NH |
3 |
100 |
|
||||||
|
|
|
||||||||
|
|
|
|
|
||||||
M |
|
|
|
|
||||||
NH |
3 |
|
|
|
|
(%) |
||||
C |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
NH |
|
|
|
C |
|
|
||||
|
|
|
в |
|
||||||
|
|
|
3 |
|
|
|
|
|
||
M |
|
|
|
|
M |
|
|
|||
NH |
3 |
|
|
в |
|
|||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
C |
NH |
, |
C |
в - |
концентрации |
|
|
3 |
|
|
|
аммиака |
и |
воздуха, % |
|||
масс., |
|
|
|
||
M |
NH |
, |
M |
в |
- |
|
|||||
|
|
3 |
|
|
|
молекулярные |
|
массы |
|||
аммиака и воздуха. |
|
||||
Эта формула верна, если в смеси нет ничего кроме аммиака и воздуха. По известному расходу воздуха и объемным концентрациям аммиака и воздуха по пропорции рассчитывают расход аммиака. Приводят расходы аммиака и воздуха к нормальным условиям. Затем определяют массовые количества введенных веществ, используя плотность газа при нормальных условиях.
По реакции (2.1.1) определяют количество полученного оксида азота (II), считая, что количество аммиака, израсходованного по этой
57
реакции, равно общему количеству аммиака, умноженному на выход оксида азота (II), выраженный в долях единицы.
Предполагаем, что остальной аммиак окисляется до азота по реакции (2.1.2) и при составлении приближенного материального баланса можно пренебречь образованием из аммиака других веществ.
Количество оставшегося в газовой смеси кислорода (графа: «расход») определяют как разность между введенным и израсходованным по реакциям (2.1.1) и (2.1.2).
Количество реакционной воды рассчитывают по уравнению (2.1.1) или (2.1.2), так как независимо от того, окисляется ли аммиак до оксида азота (II) или до азота, из четырех молей аммиака получается шесть молей воды.
2.1.7.Задание
1.Провести опыт при заданных условиях с записью всех данных по прилагаемой форме.
2.Сделать анализ газа до и после контактирования.
3.Рассчитать содержание аммиака и воздуха в аммиачно-воздушной смеси в объемных процентах и расход аммиака (л/мин) в лабораторных и нормальных условиях.
4.На основании экспериментальных данных рассчитать выход оксида азота (II), объемное отношение кислорода к аммиаку, время контактирования для платинового и неплатинового катализаторов, интенсивность платинового и неплатинового катализаторов.
5.Составить материальный баланс контактного аппарата (табл.2.1.2).
2.1.8.Техника безопасности
58
С целью исключения образования взрывоопасных смесей аммиака с воздухом система перед началом работы должна быть продута воздухом.
По этой же причине режим работы, заданный преподавателем, должен строго соблюдаться.
Эвакуирование воздуха из колб во избежание взрыва проводить с использованием специального устройства.
Таблица 2.1.2

59
Материальный баланс контактного аппарата для окисления аммиака
|
|
|
|
Базис расчета |
_______1 |
|||
|
|
|
|
|
|
|
|
|
Приход |
|
|
Расход |
|
|
|
||
|
|
|
|
|
|
|
|
|
Наименование |
л |
г |
% |
Наименование |
л |
|
г |
% |
|
н.у. |
|
масс |
|
н.у. |
|
масс |
|
|
|
|
|
|
|
|
|
|
Аммиак |
|
|
|
Оксид азота (II) |
|
|
|
|
|
|
|
|
Азот по реакции |
|
|
|
|
Воздух: |
|
|
|
|
|
|
|
|
|
|
|
|
Азот из воздуха |
|
|
|
|
В том числе: |
|
|
|
|
|
|
|
|
Кислород |
|
|
|
Кислород |
|
|
|
|
Азот |
|
|
|
|
|
|
|
|
|
|
|
|
Вода |
|
|
|
|
|
|
|
|
Невязка: |
|
|
|
|
|
|
|
|
|
|
|
|
|
Всего |
|
|
100 |
Всего |
|
|
|
100 |
|
|
|
|
|
|
|
|
|
1 - задаётся преподавателем.
