
Химия 1 курс 1 семестр
.doc

2 SO2 + O2 = 2SO3
![]()
![]()
При увеличение объема системы в 3 раза, давление каждого из компонентов уменьшится в 3 раза.
![]()
![]()
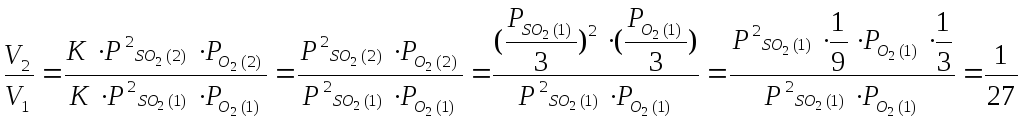
Т.е. скорость реакции уменьшится в 27 раз.
К – константа скорости, не зависит от концентрации реагирующих веществ, зависит от природы реакции и условий проведения реакции. К – удельная скорость реакции, она численно равна скорости реакции в тот момент, когда концентрации исходных веществ равны 1 моль/л.
Ответ: уменьшится в 27 раз.

А2 (г) + В2 (г) ↔ 2 АВ (г), γпрямой =2, γобратной = 3.
Смещение равновесия происходит по принципу Ле-Шателье.
При увеличении температуры в большей степени ускорится обратная реакция (γобратной = 3), следовательно, данная обратимая реакция экзотермическая ( теплота выделяется):
А2 (г) + В2 (г) ↔ 2 АВ (г) + Q
При увеличении давления в 2 раза смещения равновесия не произойдет, так как в реакции участвуют газообразные вещества, объем которых в ходе реакции не меняется ( 1+1 → 2), поэтому на смещение равновесия будет влиять лишь температура. Т.к. реакция экзотермическая, то увеличение температуры смещает равновесие в сторону обратной реакции ( разложение продукта с образованием исходных веществ).
![]()
С H2SO4 = n H2SO4 / V раствора
n H2SO4 = m H2SO4 / M H2SO4 = 24.5 г / 98 г/моль = 0,25 моль
С H2SO4 = n H2SO4 / V раствора = 0,25 моль / (250 / 1000) л = 1 моль/л или 1М
N H2SO4 = n экв H2SO4 / V раствора
n экв H2SO4 = 2 · n H2SO4 = 2 ·0,25 = 0,5 моль
N H2SO4 = n экв H2SO4 / V раствора = 0,5 моль / 0,25 л = 2 моль/л или 2Н
Ответ : 1М, 2Н.

СH3COOH ↔ H++СH3COO-
Kд
=
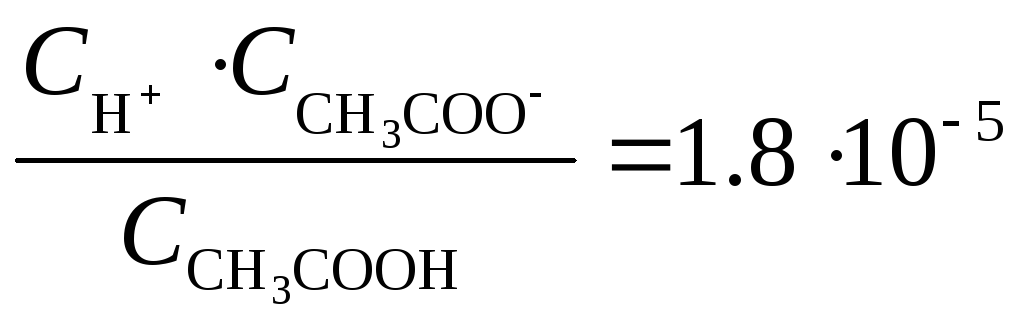
![]() =
10-4 моль/л
=
10-4 моль/л
![]() =
10-4 моль/л
=
10-4 моль/л
![]()
С исходная СН3СООН = С СН3СООН +С продиссоциир СН3СООН =
= С СН3СООН + С Н+ = 5,56 ·10-4 + 10-4 = 6,56 ·10-4 моль/л
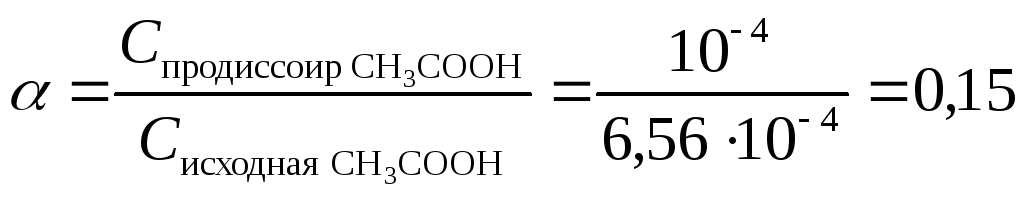
Ответ: 6,56 ·10-4 моль/л , 0,15 ( 15 %).

СH3COOH ↔ H++СH3COO-
Kд
=
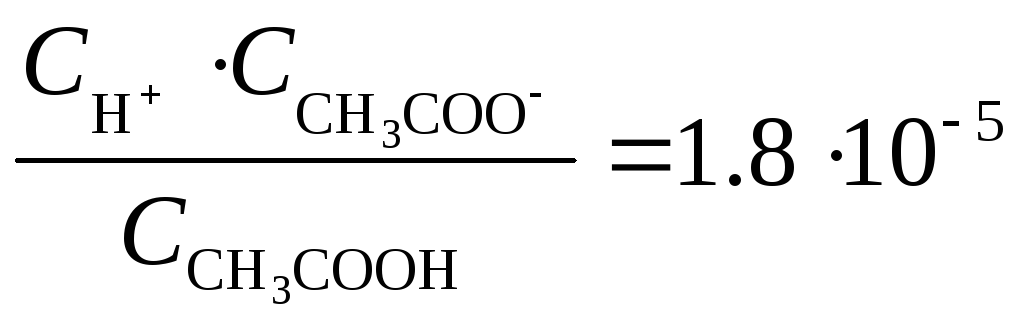
рН = – lg C H+
C H+ = 10–pH = 10–2.87 = 0.0013489 = 1.35 · 10-3 моль/л
С СН3СОО– = С Н+ = 1.35 · 10-3 моль/л
![]()
С исходная СН3СООН = С СН3СООН +С продиссоциир СН3СООН =
= С СН3СООН + С Н+ = 0,101 + 1.35 · 10-3 = 0,10235 моль/л
V раствора = 1 л
n СН3СООН = C исходная СН3СООН · V раствора = 0.10235 моль
m СН3СООН = n СН3СООН ·M СН3СООН = 0.10235 ·60 = 6.15 г

Получение: NaOH + HNO2 = NaNO2 + H2O (молекулярная форма)
Na+ + OH– + HNO2 = Na + + NO2- + H2O
OH– + HNO2 = NO2- + H2O
Гидролиз:
NaNO2 – соль слабой кислоты и сильного основания, подвергается гидролизу по аниону.
NaNO2 → Na+ + NO2- (сильный электролит, диссоциирует полностью).
H2O ↔H++OH- (слабый электролит, диссоциирует обратимо).
NO2- + H2O ↔ HNO2 + OH–
NaNO2+ H2O ↔ HNO2 + NaOH
Расчет рН 0,01Н раствора NaNO2.
![]()
Кг – константа гидролиза.
![]()
![]() -
степень гидролиза,
-
степень гидролиза,
![]() -
молярная концентрация соли NaNO2
(
равна 0,01 М, т.к. N
соли = 0,01 Н)
-
молярная концентрация соли NaNO2
(
равна 0,01 М, т.к. N
соли = 0,01 Н)
![]()
![]() моль/л
моль/л
pOH = -lg C OH– = -lg 5·10-7 = 6.3
pH = 14 – pOH = 14 – 6.3 = 7.7
Ответ: 7,7

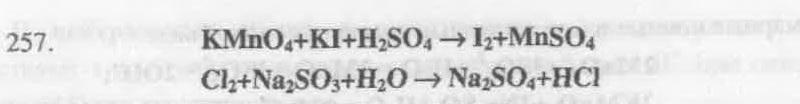
2 KMn+7O4 + 10 KI–1 + 8 H2SO4 = 5 I20 + 2Mn+2SO4 + 2 MnSO4 + 6K2SO4 + 8 H2O
2I– –2 e = I2 полуреакция окисления,
MnO4– + 5e + 8 H+ = Mn2+ + 4 H2O полуреакция восстановления
I– (KI ) – восстановитель, окисляется.
Mn+7 (KMnO4 ) – окислитель, восстанавливается.
Сl20+ Na2S+4O3 + H2O = Na2S+6O4 + 2 HCl–1
SO32– –2e + H2O = SO42– + 2 H+ полуреакция окисления,
Сl2 +2 e = 2 Cl– полуреакция восстановления
S+4 (Na2SO3 ) – восстановитель, окисляется.
Сl20 – окислитель, восстанавливается.
![]()
2 ZnS (кр) +3 О2 (г)= 2 ZnO (кр) + 2 SO2 (г)
p = 101 кПа, Т = 998 К, по уравнению Кирхгофа:
![]()
![]() –– стандартная
энтальпия реакции при 998 К и 101кПа
–– стандартная
энтальпия реакции при 998 К и 101кПа
![]() –– стандартная
энтальпия реакции при 298 К и 101кПа
–– стандартная
энтальпия реакции при 298 К и 101кПа
![]() –– изменение
стандартной теплоемкости в ходе реакции
–– изменение
стандартной теплоемкости в ходе реакции
![]()
2 ZnS (кр) +3 О2 (г)= 2 ZnO (кр) + 2 SO2 (г)
ΔfH0298 , кДж/моль –205.4 0 –350.6 –296.9
Ср0, Дж/моль·К 45.52 29.35 40.25 39.9
∆rH0298-стандартная энтальпия реакции, равна разности сумм энтальпий продуктов и исходных веществ с учетом коэффициентов.
∆rH0298= 2·∆fH0298 (ZnO (кр)) + 2·∆fH0298(SO2 (г)) – 2·∆fH0298(ZnS (кр)) – 3·∆fH0298(О2 (г)) =
= 2·( – 350.6) + 2 · (–296.9) – 2 · (– 205.4) – 0 = –884.2 кДж
![]() –– изменение
стандартной теплоемкости
с учетом коэффициентов
–– изменение
стандартной теплоемкости
с учетом коэффициентов
![]() = 2·
Ср 0298
(ZnO
(кр)) + 2· Ср
0298
(SO2
(г)) – 2· Ср
0298
(ZnS
(кр)) – 3·
Ср 0298
(О2
(г)) =
= 2·
Ср 0298
(ZnO
(кр)) + 2· Ср
0298
(SO2
(г)) – 2· Ср
0298
(ZnS
(кр)) – 3·
Ср 0298
(О2
(г)) =
= 2· 40.25 + 2 · 39.9 – 2 · 45.52 – 3 · 29.35 = – 18.79 Дж/К
![]() =
=
= – 884.2·1000 + (– 18.79) 700 = –897353 Дж = – 897.353 кДж
Тепловой эффект
Q = –![]() =
897.353
кДж
=
897.353
кДж
Ответ: 897.353 кДж
![]()
½ Cl2 (г) + ½ Н2 (г) = НСl (г)
Стандартные условия : Т = 298 К, Р = 101 кПа
½ Cl2 (г) + ½ Н2 (г) = НСl (г)
S0298, Дж/моль·К 222,9 130,52 186,8
∆rS0298= S0298 (НСl (г)) – ½ ·S0298 (Cl2 (г)) – ½ · S0298 (Н2 (г)) =
= 186,8 – ½ ·22,9 – ½ · 130,52 = 10,09 Дж/К
Ответ: 10,09 Дж/К

Fe2O3 (кр) + 3Н2 (г) = 2Fe (кр) + 3Н2О (г)
Стандартные условия: p = 101 кПа, Т = 298 К.
Термодинамическая вероятность протекания определяется значением изменения энергии Гиббса реакции:
![]()
Fe2O3 (кр) + 3Н2 (г) = 2Fe (кр) + 3Н2О (г)
∆H0298 , кДж/моль –822,2 0 0 –241,82
S0298, Дж/моль·К 87,4 130,52 27,15 188,72
∆H0298= 2 · ∆fH0298 (Fe (кр)) + 3 · ∆fH0298 (Н2О(г)) – ∆fH0298(Fe2O3 (кр)) – 3 · ∆fH0298(Н2 (г)) =
= 2 · 0 + 3 · (–241,82) – (– 822,2) – 3 · 0 = 96,74 кДж
∆S0298= 2 · S0298 (Fe (кр)) + 3 · S0298 (Н2О(г)) – S0298 (Fe2O3 (кр)) – 3 · S0298 (Н2 (г)) =
= 2 · 27,15 + 3 · 188,72 – 87,4 – 3 · 130,52 = 141,5 Дж/К
![]() кДж
кДж
![]()
Это значит, что данная реакция термодинамически невозможна при стандартных условиях.
При равновесии
![]()
Считаем, что энтальпия и энтропия реакции не зависят от температуры, тогда:
![]()
![]()
![]()
Т.е. термодинамическое равновесие наступит при температуре 684 К.
Ответ: 684 К

Электродами первого рода являются:
1. Электроды, состоящие из элементарного вещества, находящегося в контакте с раствором, содержащим его собственные ионы.
а) Металлический электрод – металл, погруженный в раствор своей соли M|Mn+, например, цинковый и медный электроды:
Zn |Zn2+ Zn – 2e = Zn2+
Cu |Cu2+ Cu – 2e = Cu2+
Металлический электрод обратим по отношению к катиону. Его электродный потенциал:
![]()
б) Газовый электрод в качестве одного из компонентов электродной пары содержит газ (H2, Cl2 и др.), адсорбированный на химически инертном проводнике первого рода (обычно платина, покрытая платиновой чернью). При контакте адсорбированного газа с раствором собственных ионов устанавливается равновесие. Для хлорного и водородного электродов это равновесие можно представить уравнениями:
|
|
|
|
|
|
|
|
Соответствующие им уравнения Нернста имеют вид:
|
|
|
|
|
|
|
|
Очевидно, что их электродный потенциал зависит от давления и активности (концентрации) ионов в растворе.
2. Редокс-электроды состоят из электрохимически инертного проводника (платины, графита и т. д.), погруженного в раствор, в котором находятся окисленная и восстановленная формы потенциалопределяющего вещества. Такой инертный проводник способствует передаче электронов от восстановителя к окислителю через внешнюю цепь. Примерами таких электродов могут служить редокс-электроды с ионами в различных степенях окисления: (Pt) Sn4+, Sn2+, (Pt) Fe3+, Fe2+.
|
|
|
|
|
|
|
|
||
Кислородный электрод по устройству аналогичен водородному – представляет собой платиновую пластинку, покрытую платиновой чернью, погруженную в раствор основания, через который пропускается кислород.
О2 + Н2О + 4е ↔ 4 ОН–
![]()
Потенциал кислородного электрода в растворе КОН и NH4OH одинаковой концентрации ( 0,001 моль/л) не будут одинаковы, т.к. рН в названных растворах различны.
КОН = К+ + ОН– (сильный электролит)
С ОН– = С КОН = 0,001 моль/л
рОН = – lg С ОН– = – lg 0.001 = 3
pH = 14–3 = 11
![]() B
B
NH4OH ↔ NH4+ + ОН– (сильный электролит)
Kд
=
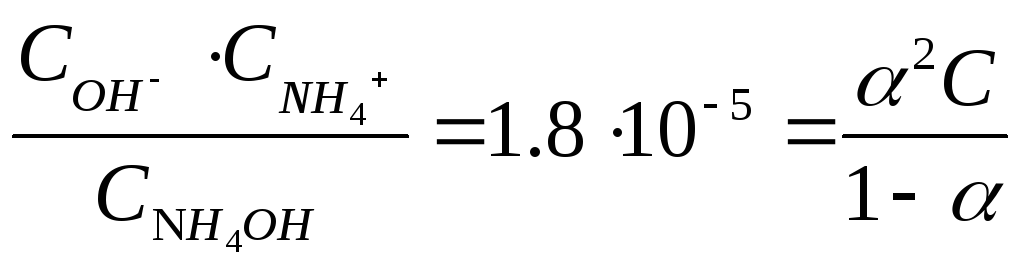
α <<1
![]()
C ОН– = C NH4OH · α = 0.001 · 0.13 = 1.3 · 10-4 моль/л
рОН = – lg С ОН– = – lg 1.3 · 10-4 = 3.9
pH = 14–3.9 = 10.1
![]() B
B

CuCl2 =Cu2+ +2Cl–(сильный электролит)
К катоду движутся: Cu2+, Н2О.
К аноду движутся: Cl– , Н2О.
При электролизе протекают следующие процессы:
К (+) Сu2+ + 2е = Cu
А (–) 2Сl – 2e = Cl2
Суммарно: CuCl2 = Cu + Cl2
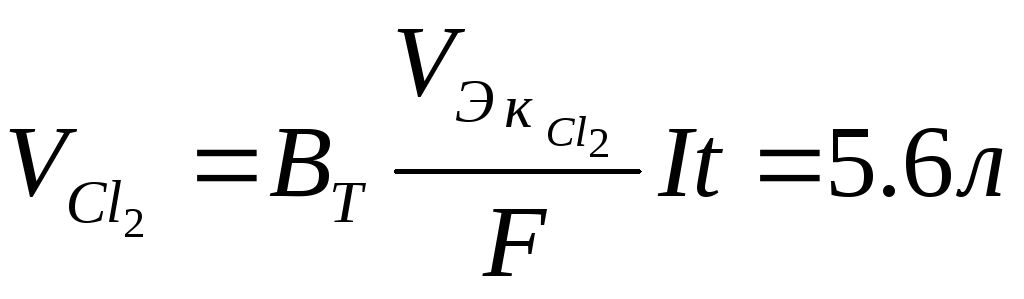
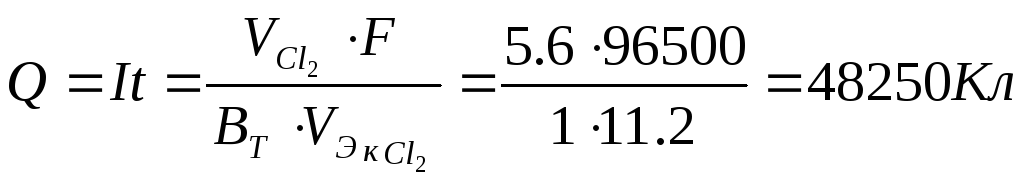
 г
( столько разложилось)
г
( столько разложилось)
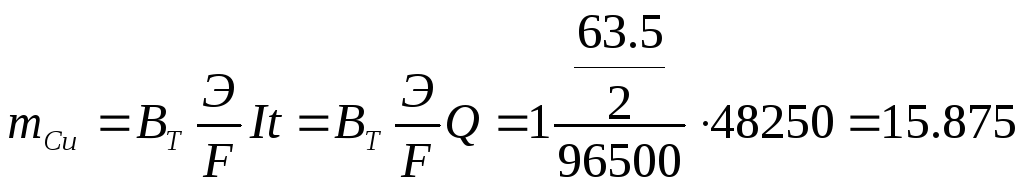 (столько
образовалось)
(столько
образовалось)
Ответ: масса катода увеличилась на 15,875 г, через раствор прошло 48250Кл электричества, разложилось 33,625 г хлорида меди.

Атмосферная коррозия:
А (– ) Fe – 2e = Fe2+ анодная реакция
K( +) 2 H2O + O2 + 4e = 4OH– катодная реакция
Суммарно: 2 Fe + 2 H2O + O2 = 2 Fe2+ + 4OH–
Далее идут вторичные процессы:
Fe2+ + 2OH– = Fe(OH)2
2 Fe(OH)2 + O2 = 4 FeO (OH) + 2 H2O
m Fe(OH)2 = 0.125 г
n Fe(OH)2 = m Fe(OH)2 / M Fe(OH)2 = 0.125 / 90 = 0.00139 моль
m Fe = n Fe · М Fe= 0,00139 · 56 = 0,07784 г
n Fe = n Fe(OH)2 = 0.00139 моль
n O2 = n Fe / 2 = 0.000695 моль
V O2 = n O2 · Vm = 0.000695 · 22.4 = 0.016 л
![]() ,
,
![]()
Ответ: 0,016 л, 275,7 Кл.

Катодные процессы используют для получения покрытий на изделиях (покрываемое изделие – катод, на него осаждают положительно заряженные ионы металлов из растворов их соединений при пропускании электрического тока). Количественно эти процессы описываются законом Фарадея с учетом побочных процессов, которые сводятся к выделению на поверхности покрываемого металла водорода, качественно – типом и составом электролита, режимом электролиза.
Примеры – цинкование, кадмирование, хромирование железа.
Цинкование железа – процесс нанесения на сталь цинка, в результате чего образуется пара Fe-Zn, препятствующая коррозии.
Схема:
K (–) Fe | Zn2+| Zn (+) A
(–) Zn + 2e = Zn
(+) Zn – 2e = Zn2+
Обезжиривание –– удаление с изделий жирных загрязнений и оксидов. Жиры, по своей химической природе делятся на: омыляемые и неомыляемые, практически нерастворимы в воде и для их удаления с поверхности металла применяются различные способы в зависимости от природы жиров.
Электрохимическое обезжиривание проводят в щелочных растворах примерно того же состава, что и химическое. В состав щелочных обезжиривающих растворов входят едкая щелочь, фосфаты, силикаты, кальцинированная сода. Минеральные жиры не разрушаются в щелочных растворах, но образуют под их воздействием водные эмульсии, что облегчает дальнейшее удаление с поверхности металла. Сила сцепления жиров с поверхностью металла довольна большая. Поэтому в щелочные обезжиривающие растворы добавляют специальные добавки-эмульгаторы: жидкое стекло, стеарин, смачивающие поверхностно-активные добавки, которые понижают поверхностное натяжение на границе двух фаз. Одним из очень важных условий, гарантирующих полное удаление с поверхности изделий омыляемых и неомыляемых жиров, является повышенная температура щелочных растворов. Мыла, получающиеся в результате обезжиривания, растворяются в горячих щелочах значительно лучше, чем в холодных. Рекомендуемая температура щелочных растворов от 60-90 0С. Движение моющего щелочного раствора относительно поверхности деталей во много раз ускоряет моющее действие. Поэтому, перемешивание раствора, струйная его подача на детали, ультразвуковое колебание раствора следует применять как для ускорения процесса, так и для улучшения очистки. Электрохимическое обезжиривание применяют после полировки, предварительной химической или механической очистки и после монтажа изделий для удаления последних остатков жировых загрязнений перед декапированием или перед покрытием. Благодаря быстроте процесса и высокому качеству очистки, электролитическое обезжиривание является наиболее целесообразным видом обезжиривания для всех изделий. Очистка изделий при электрохимическом обезжиривании происходит в процессе электролиза – пропускания постоянного тока через электролит, когда сами изделия играют роль катода или анода. В первом случае на поверхности обезжириваемых деталей бурно выделяются пузырьки водорода, во втором – кислорода. При этом они в течение первых же секунд разрывают и удаляют пленку жировых загрязнений. Роль щелочного раствора является вспомогательной и заключается в образовании эмульсии с частицами масла, а также омылении жиров животного и растительного происхождения. В отличие от химического обезжиривания в крепких растворах щелочей скорость электрообезжиривания почти не зависит от температуры и концентрации электролита и определяется плотностью тока. В качестве электродов завешивают листы никелированного железа или нержавеющей стали. Переключение на анод имеет своей целью дополнительную очистку кислородом и частичное устранение вредного воздействия водорода.
Для получения хороших результатов обезжиривания необходимо соблюдение следующих правил:
-
не допускается длительная передержка процесса, так как это приводит к насыщению изделий водородом, т.е. к созданию водородной хрупкости и потемнению поверхности;
-
детали из меди и ее сплавов, а также из драгоценных сплавов обезжиривают только на катоде
-
перед обезжириванием должны быть стравлены гальванические покрытия / цинк, олово /, загрязняющие электролит при их растворении;
-
с поверхности электролита должна удаляться пена жиров и масел в процессе работы или загрязненный раствор должен заменяться новым.

К металлам подгруппы железа относятся: железо Fe, никель Ni, кобальт Co.
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твердость и хрупкость. Обладает ярко выраженными магнитными свойствами. Для железа характерен полиморфизм, он имеет четыре кристаллические модификации (α-Fe , β-Fe, γ-Fe , δ-Fe). Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо тугоплавко, относится к металлам средней активности. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2O → 4Fe(OH)3
Накалённая железная проволока горит в кислороде, образуя окалину - оксид железа (II,III):
3Fe + 2O2 → Fe3O4
При высокой температуре (700–9000C) железо реагирует с парами воды:
3Fe + 4H2O → Fe3O4 + 4H2
Железо реагирует с неметаллами при нагревании:
2Fe + 3Br2 → 2FeBr3
Fe + S →FeS
Железо легко растворяется в соляной и разбавленной серной кислотах:
Fe
+ 2HCl
![]() FeCl2
+ H2↑
FeCl2
+ H2↑
Fe
+ H2SO4(разб.)
![]() FeSO4
+ H2↑
FeSO4
+ H2↑
В концентрированных кислотах–окислителях железо растворяется только при нагревании
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2↑ + 6H2O
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2↑ + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов. Сталь — важнейший конструкционный материал для машиностроения, транспорта, строительства и прочих отраслей народного хозяйства. Стали с высокими упругими свойствами находят широкое применение в машино- и приборостроении. В машиностроении их используют для изготовления рессор, амортизаторов, силовых пружин различного назначения, в приборостроении — для многочисленных упругих элементов: мембран, пружин, пластин реле, сильфонов, растяжек, подвесок. Пружины, рессоры машин и упругие элементы приборов характеризуются многообразием форм, размеров, различными условиями работы. Особенность их работы состоит в том, что при больших статических, циклических или ударных нагрузках в них не допускается остаточная деформация. В связи с этим все пружинные сплавы кроме механических свойств, характерных для всех конструкционных материалов (прочности, пластичности, вязкости, выносливости), должны обладать высоким сопротивлением малым пластическим деформациям. В условиях кратковременного статического нагружения сопротивление малым пластическим деформациям характеризуется пределом упругости, при длительном статическом или циклическом нагружении — релаксационной стойкостью.
Металлический никель Ni имеет серебристый цвет с желтоватым оттенком, очень твёрд, вязкий и ковкий, хорошо полируется, притягивается магнитом, проявляя магнитные свойства при температурах ниже 340 °C. Никель характеризуется высокой коррозионной стойкостью — устойчив на воздухе, в воде, в щелочах, в ряде кислот. Химическая стойкость обусловлена его склонностью к пассивированию — образованию на его поверхности плотной оксидной плёнки, обладающей защитным действием. Никель активно растворяется в азотной кислоте:
3 Ni + 8 HNO3 = 3 Ni(NO3)2 + 2 NO + 4 H2O
С оксидом углерода CO никель легко образует летучий и весьма ядовитый карбонил:
Ni + 4 CO = Ni(CO)4.
Тонкодисперсный порошок никеля пирофорный (самовоспламеняется на воздухе).
Ni + ½ O2 = NiO
Никелирование — создание никелевого покрытия на поверхности другого металла с целью предохранения его от коррозии. Проводится гальваническим способом с использованием электролитов, содержащих сульфат никеля(II), хлорид натрия, гидроксид бора, поверхностно-активные и глянцующие вещества, и растворимых никелевых анодов. Толщина получаемого никелевого слоя составляет 12 — 36 мкм. Устойчивость блеска поверхности может быть обеспечена последующим хромированием (толщина слоя хрома 0,3 мкм). Используется для защиты стальных изделий.
Кобальт — твердый металл, существующий в двух модификациях. При температурах от комнатной до 427 °C устойчива α-модификация. При температурах от 427 °C до температуры плавления (1494 °C) устойчива β-модификация кобальта (решётка кубическая гранецентрированная). Кобальт— ферромагнетик. Желтоватый оттенок ему придает тонкий слой оксидов. При обычной температуре компактный кобальт стоек против действия воды и воздуха. Мелко раздробленный кобальт на воздухе самовоспламеняется, превращаясь в СоО:
Со + ½ О2 = СоО
Компактный кобальт начинает окисляться на воздухе выше 300 °С; при красном калении он разлагает водяной пар:
Со + Н2О = СоО + Н2.
С галогенами кобальт легко соединяется при нагревании, образуя галогениды СоHal2:
Co + Hal2 = СоHal2
В разбавленных соляной и серной кислотах кобальт медленно растворяется с выделением водорода:
Со + 2 HCl = CoCl2 + H2
Co + H2SO4 = CoSO4 + H2
Разбавленная азотная кислота растворяет кобальт с выделением оксидов азота и образованием нитрата Co(NO3)2.
3 Со + 8 HNO3 = 3 Со(NO3)2 + 2 NO + 4 H2O
Концентрированная HNO3 пассивирует.
Легирование кобальтом стали повышает её жаропрочность, улучшает механические свойства. Из сплавов с применением кобальта создают обрабатывающий инструмент: свёрла, резцы, и.т.п.




