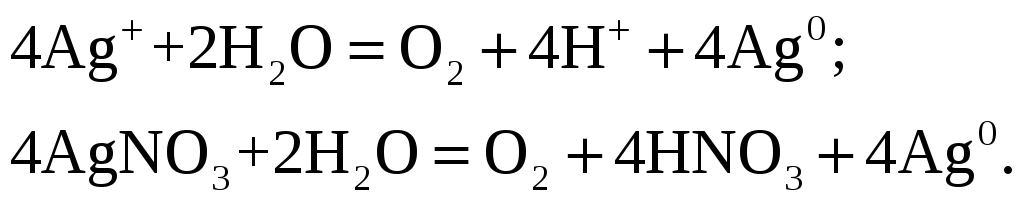контрольная работа №1 - вариант 32 - 1й семестр
.doc
Задание 8. Железо массой 7 г вытесняет из кислоты HCl 3,2 Н2, измеренного при t = 39 ºC и Р = 760 мм рт. ст. Какова валентность железа в этой реакции? Определить эквивалентные массы его оксида и гидроксида.
|
Дано:
mFe = 7 г; V = 3,2 л; t = 39 ºC; P = 760 мм рт. ст. = = 101325 Па |
Решение:
Реакция будет протекать следующим образом:
Определим объём водорода при нормальных условиях |
|
ВFe – ? Э – ? |
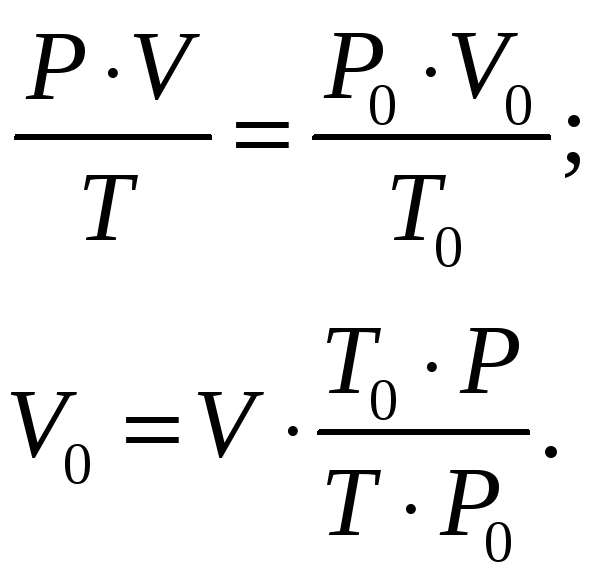
Здесь P0 = 101325 Па, Т0 = 273 К.
![]()
По закону эквивалентов:
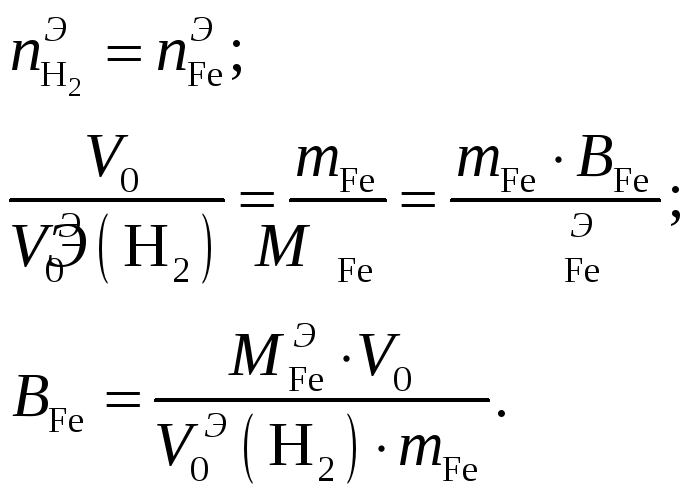
Эквивалентный
объём водорода
![]() л, эквивалентная масса железа
л, эквивалентная масса железа
![]() г/моль.
г/моль.
![]() .
.
реакция имеет вид:
![]() .
.
Формула оксида железа (II) – FeO, гидроксида – Fe(OH)2.
Эквивалентная масса оксида:
![]() .
.
Молярная
масса оксида –
![]() г/моль.
г/моль.
![]()
Эквивалентная масса гидроксида:
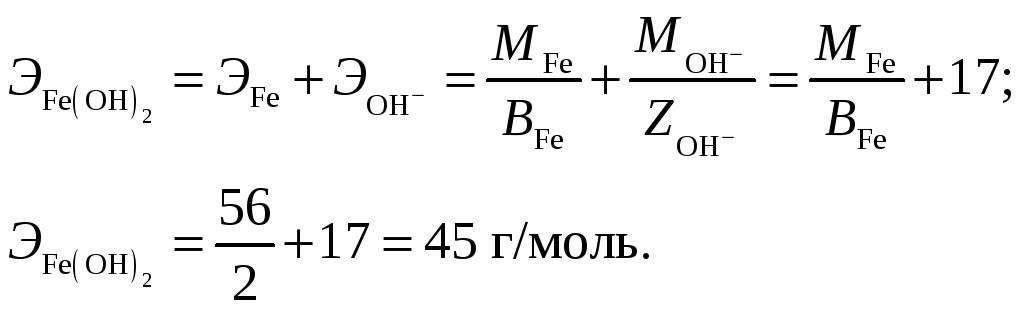
Ответ: Валентность железа, которое при массе 7 г при реакции с кислотой HCl выделяет 3,2 л водорода, измеренного при t = 39 ºC и Р = 760 мм рт. ст., составляет 2. Эквивалентная масса оксида железа (II) FeO составляет 36 г/моль, гидроксида Fe(OH)2 – 45 г/моль.
Задание 104. Скорость реакции С2Н4 (г) + Н2 = С2Н6 (г) увеличилась в 9 раз. Исходя их ЗДМ рассчитайте, во сколько раз увеличилась концентрация реагирующих веществ по сравнению с первоначальной. Каков физический смысл константы скорости реакции и от каких факторов зависит её численное значение?
|
Дано:
|
Решение:
Скорость данной химической реакции иметь вид
|
|
|
![]() .
.
На 1 моль/л С2Н4 приходится 1 моль Н2, и обозначить их через х, то получим
![]() .
.
После увеличения концентраций:
![]() .
.
Тогда
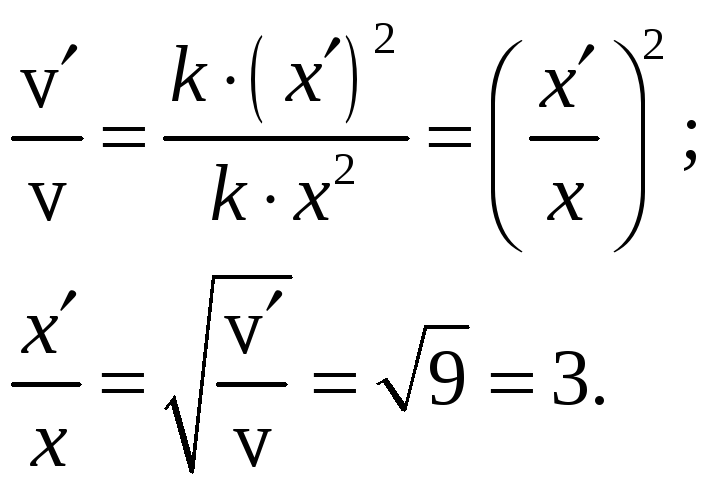
.
Ответ: При увеличении скорость реакции в 9 раз концентрация каждого реагирующего вещества в реакции С2Н4 (г) + Н2 = С2Н6 (г) увеличилась в 3 раза.
Задание
130. Константа равновесия гетерогенной
реакции
![]() при некоторой температуре равна 0,5.
Найдите равновесные концентрации СО и
СО2,
если начальные составляли
при некоторой температуре равна 0,5.
Найдите равновесные концентрации СО и
СО2,
если начальные составляли
![]() ,
,
![]() .
Как повлияет повышение давления на
равновесие системы и численное значение
константы равновесия?
.
Как повлияет повышение давления на
равновесие системы и численное значение
константы равновесия?
|
Дано:
kС = 0,5;
|
Решение:
Константа равновесия применительно к данной реакции имеет вид
из
1 моль СО получается 1 моль СО2,
и обозначим
|
|
|
![]() .
.
общее количество СО и СО2 в ходе реакции будет неизменно
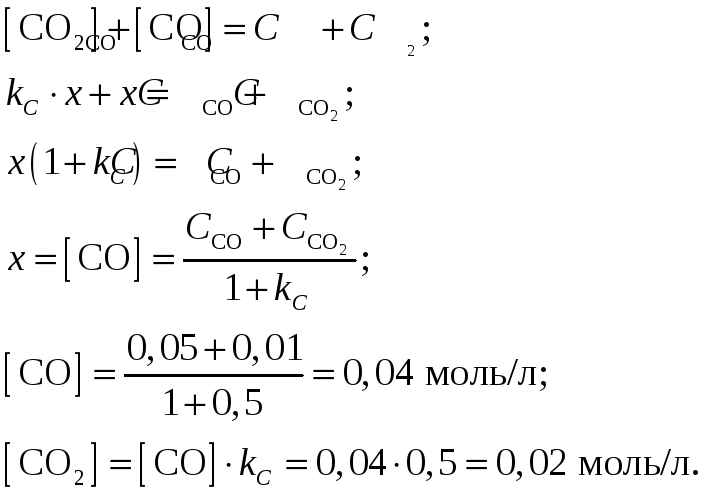
Ответ:
Равновесные концентрации угарного газа
СО и углекислого газа СО2
при константе равновесия гетерогенной
реакции вида
![]() равной 0,5 и начальными концентрациями
равной 0,5 и начальными концентрациями
![]() и
и
![]() составят
соответственно 0,04 моль/л и 0,02 моль/л.
составят
соответственно 0,04 моль/л и 0,02 моль/л.
Задание 185. Определить степень диссоциации и концентрацию ионов в растворе, в 1 л которого содержится 3,5 г NH4OH (Kд = 1,8·10–5). Запишите уравнение диссоциации. Как изменятся значения α и Kд при уменьшении его концентрации? Ответ обоснуйте.
|
Дано:
V = 1 л; m(NH4OH) = 3,5 г; Kд = 1,8·10–5 |
Решение:
Уравнение диссоциации будет иметь вид
По закону разбавления Освальда
|
|
α – ?
|
Молярная
концентрация гидроксида аммония составит
при его молярной массе, равной
![]() г/моль
г/моль
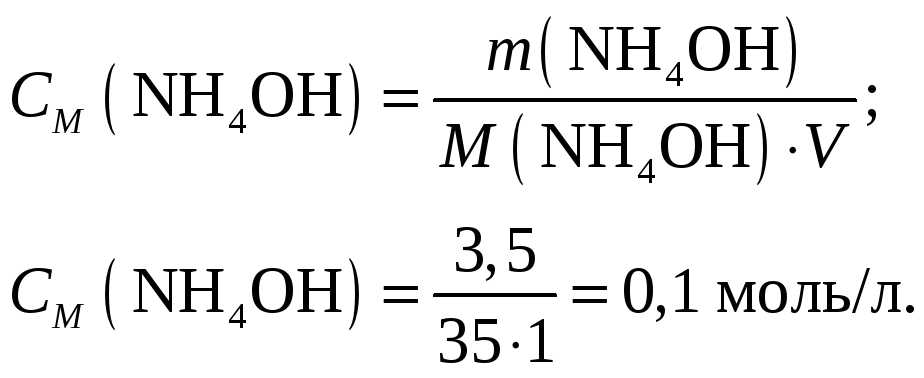
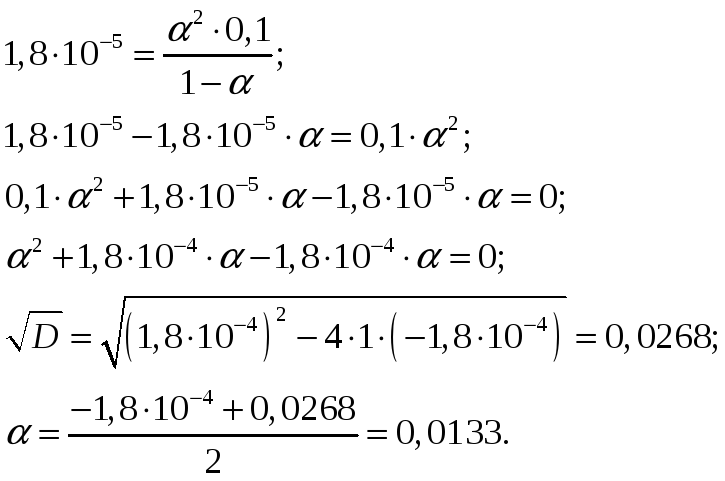
Концентрации ионов NH4+ и OH– будут равны между собой и составят
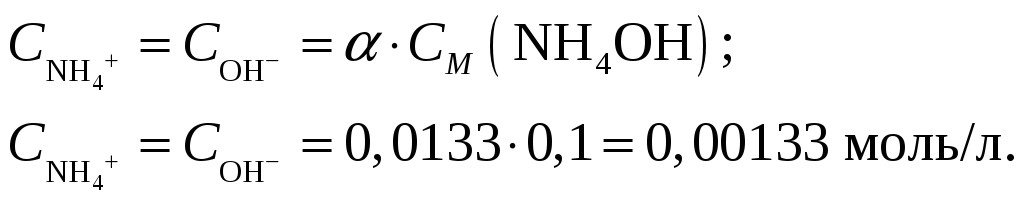
Ответ: Степень диссоциации ионов в растворе, 1 л которого содержит 3,5 г NH4OH (Kд = 1,8·10–5) составляет 0,0133. Концентрация ионов NH4+ и OH– равны и составляют 0,00133 моль/л. При уменьшении концентрации константа диссоциации не измениться, а степень диссоциации возрастёт.
Задание 218. Определить молярную концентрацию раствора гидроксида аммония NH4OH, если рН = 11,13. Запишите уравнение диссоциации и выражение для константы диссоциации.
|
Дано:
рН = 11,13 |
Решение:
Уравнение диссоциации будет иметь вид
|
|
|
Константа диссоциации будет иметь вид
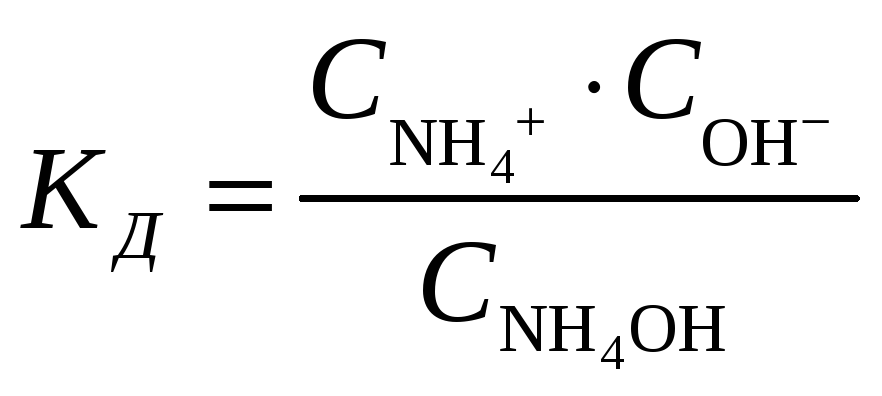 .
.
Концентрация иона ОН– находится по выражению
![]()
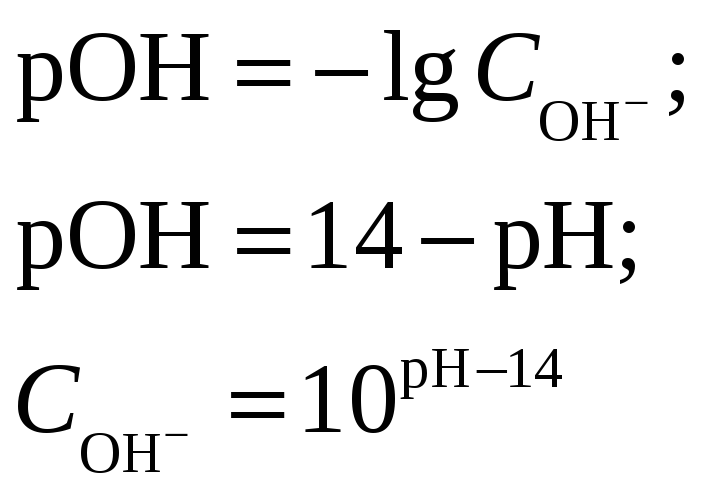
Приравняем
обе части и выразим
![]()

Ответ: Молярная концентрация гидроксида аммония NH4OH при рН = 11,13 составит 0,1 моль/л.
Задание
8/2. Вычислить тепловой эффект реакции
![]() ,
протекающей при постоянном давлении
(Р
= const)
и Т
= 600 К. В интервале 298… 1000 К Ср
≠ f(T).
,
протекающей при постоянном давлении
(Р
= const)
и Т
= 600 К. В интервале 298… 1000 К Ср
≠ f(T).
|
Дано:
Т = 600 К |
Решение:
Тепловой эффект реакции при постоянной давлении и при температуре Т находится по выражению |
|
|
![]()
Тепловой эффект при Т = 298 К определим по формуле
![]() .
.
![]() .
.
Из приложения 1 учебно-методического пособия имеем
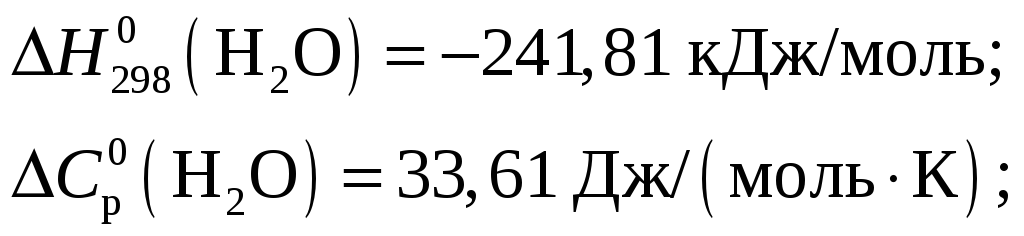
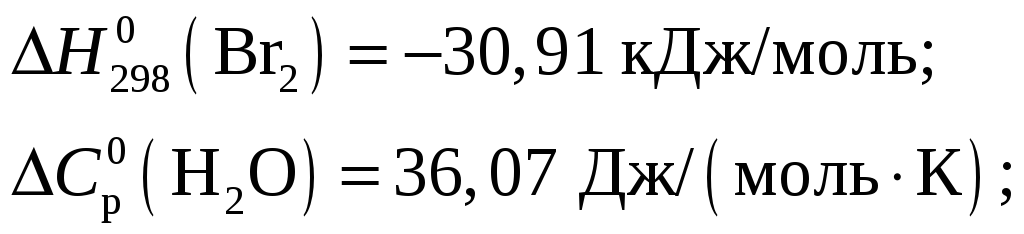

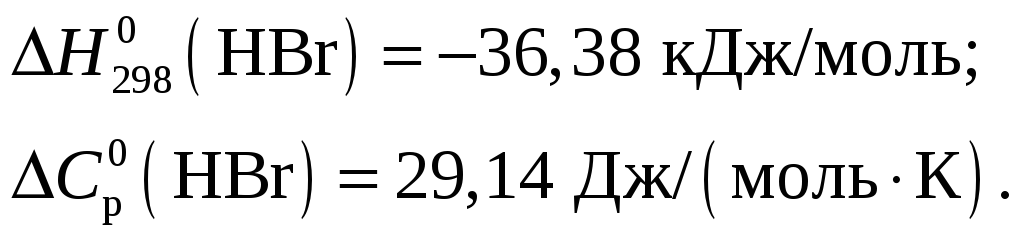
Тогда тепловой эффект при Т = 298 К реакции составит
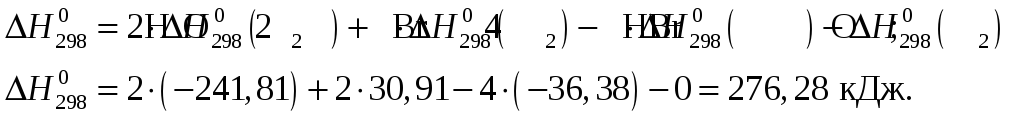
Изменение теплоёмкости составит
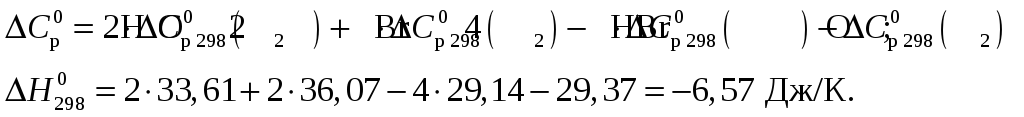
Тепловой эффект при Т = 600 К реакции составит
![]()
Ответ:
Тепловой эффект реакции
![]() ,
протекающей при постоянном давлении и
Т
= 600 К, составит –278,26 кДж.
,
протекающей при постоянном давлении и
Т
= 600 К, составит –278,26 кДж.
Задание
27/2. Рассчитайте стандартное значение
энтропии Fe2O3,
используя стандартные энтропии веществ,
если известно, что стандартное изменение
энтропии для всей реакции
![]() равно – 213,8 Дж/К.
равно – 213,8 Дж/К.
|
Дано:
|
Решение:
Изменение энтропии реакции определяется по выражению
|
|
|
Применительно к данной реакции
![]()
Откуда искомая энтропия Fe2O3
![]() .
.
Из приложения 1 учебно-методического пособия имеем
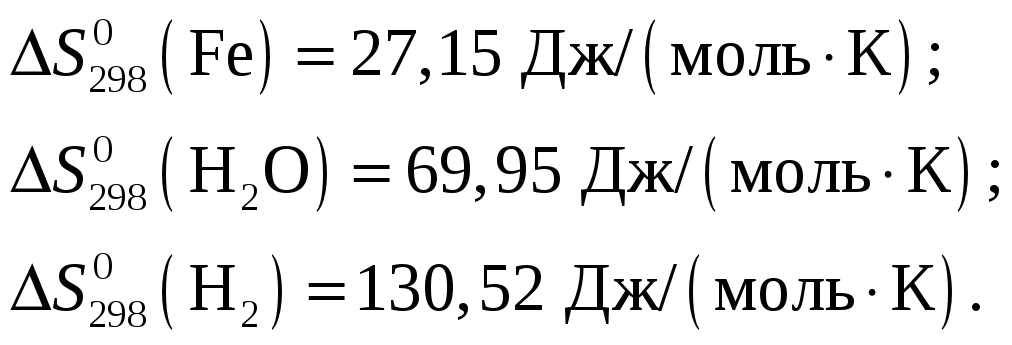
![]()
Ответ:
Стандартное значение энтропии Fe2O3,
полученное исходя из того, что стандартное
изменение энтропии для всей реакции
![]() равно – 213,8 Дж/К, составляет 86,39 Дж/(моль·К).
равно – 213,8 Дж/К, составляет 86,39 Дж/(моль·К).
Задание
53/2. Возможно ли самопроизвольное
протекание реакции
![]() при стандартных условиях. Определите
температуру равновесия в данной системе.
при стандартных условиях. Определите
температуру равновесия в данной системе.
|
Дано:
|
Решение:
Самопроизвольное протекание реакции возможно при отрицательном изменении энергии Гиббса, т.е.
|
|
Т – ? |
Рассчитаем стандартное изменение энтальпии и энтропии реакции
![]()
![]() .
.
Применительно к данной реакции
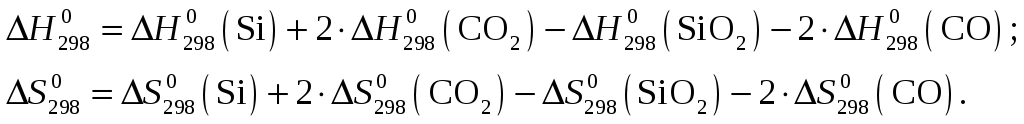
Из приложения 1 учебно-методического пособия имеем

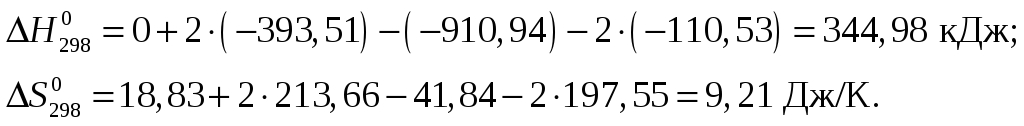
Изменение энергии Гиббса
![]()
Протекание реакции при стандартных условиях невозможно.
Рассчитаем температуру равновесия
![]()
![]()
Ответ:
Самопроизвольное протекание реакции
![]() при стандартных условиях невозможно,
т.к.
при стандартных условиях невозможно,
т.к.
![]() .
Температура равновесия составляет
37457 К.
.
Температура равновесия составляет
37457 К.
Задание
88/2. Составьте схему гальванического
элемента, в котором самопроизвольно
протекает реакция
![]() .
Определите концентрацию раствора
.
Определите концентрацию раствора
![]() ,
если железный электрод – стандартный,
а ЭДС элемента равна 80 мВ. Запишите и
рассчитайте Кр.
,
если железный электрод – стандартный,
а ЭДС элемента равна 80 мВ. Запишите и
рассчитайте Кр.
|
Дано:
ε = 80мВ = 0,08 В |
Решение:
В данном элементе на электродах будут проходить следующие реакции
На
катоде –
На
аноде –
|
|
Кр – ? |
![]()
Суммарное уравнение токообразующей реакции
![]() .
.
Таким
образом, из 1 моль
![]() образуется 1 моль
образуется 1 моль
![]() .
.
Из таблицы 2 учебно-методического пособия имеем
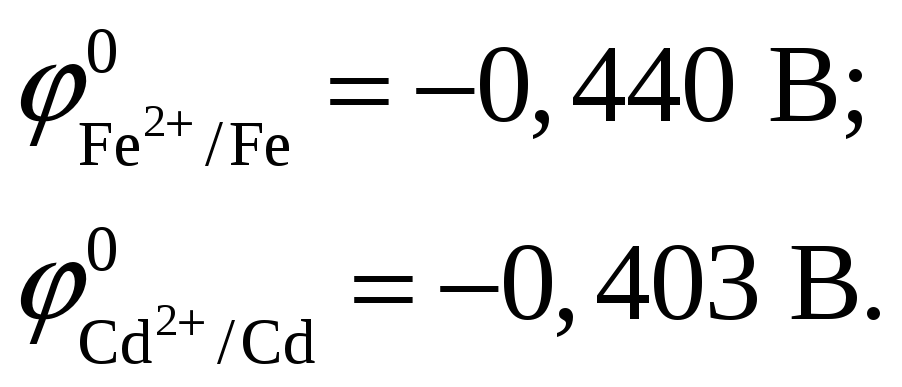
ЭДС, создаваемая элементом:
![]()
С другой стороны по уравнению Нернста
![]() .
.
Подставляя, получим, что концентрация иона равна
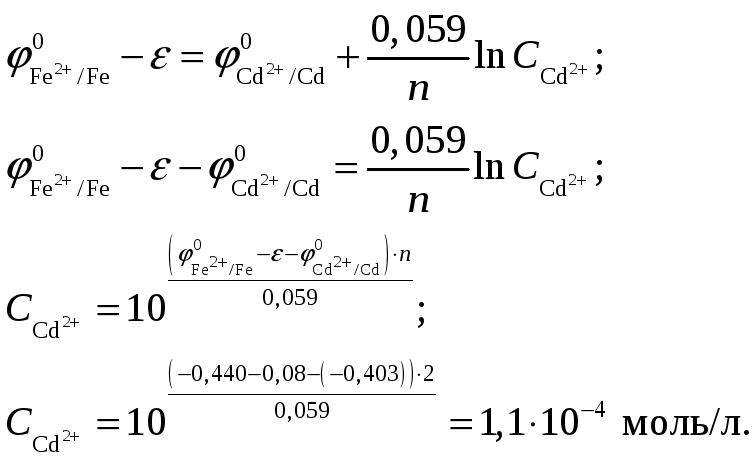
Так как концентрация иона будет равна концентрации сульфата кадмия, то
![]()
Константа равновесия
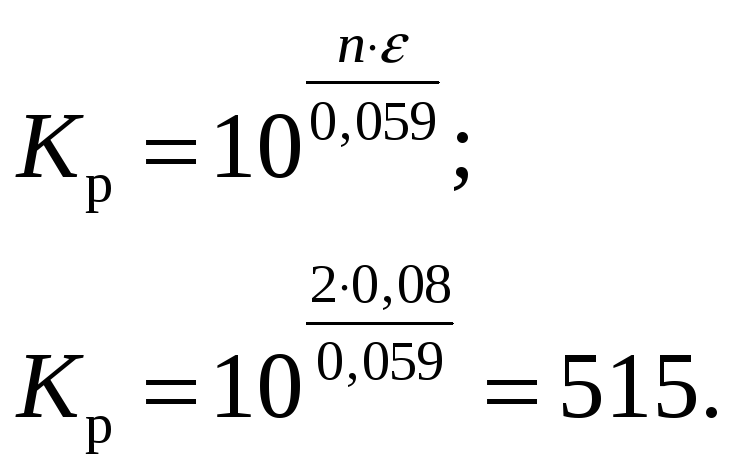
Ответ:
Концентрация раствора
![]() в гальваническом элементе с ЭДС, равной
80 мВ, в котором самопроизвольно протекает
реакция
в гальваническом элементе с ЭДС, равной
80 мВ, в котором самопроизвольно протекает
реакция
![]() ,
составляет 1,1·10–4
моль/л. Константа равновесия реакции
составляет 515.
,
составляет 1,1·10–4
моль/л. Константа равновесия реакции
составляет 515.
Задание 108/2. Составьте схему электролиза 1 М раствора AgNO3 на инертных электродах и рассчитать выход по току (Вт), если за 25 мин при силе тока 3 А масса катода увеличилась на 4,8 г. Какое вещество и сколько по массе и объёму (н. у.) выделилось на аноде? Ответ подтвердите, записав уравнение электродных реакций и суммарное уравнение электролиза. Определите электрохимический эквивалент металла.
|
Дано:
= 0,1 моль/л; τ = 25 мин = 1500 с; I = 3 А; mпр = 4,8 г; F = 96500 Кл/моль |
Решение:
На электродах будут проходить следующие процессы
На
катоде –
На
аноде (рН < 7) –
Суммарный процесс
Выход по току |
|
Вт – ? m – ? V – ? kAg – ? |
![]()
Теоретическая масса выделившегося серебра
![]() .
.
Совместно получим
![]()
Эквивалентная масса серебра
![]()
![]()
Электрохимический эквивалент серебра
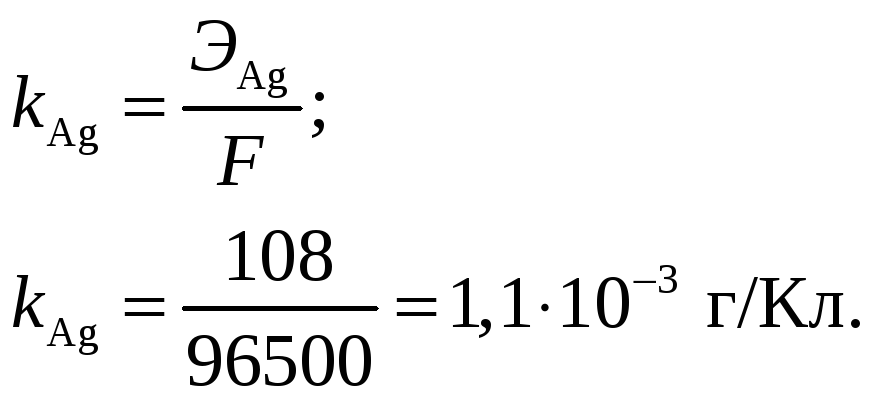
На аноде выделяется кислород. Его масса
![]() .
.
Эквивалентная масса кислорода
![]()
![]()
Объём выделившегося кислорода
![]() .
.
Эквивалентный объём кислорода
![]()
![]()
Ответ: Выход по току при электролизе 1 М раствора AgNO3 на инертных электродах, если за 25 мин при силе тока 3 А масса катода увеличилась на 4,8 г, составляет 0,95. Электрохимический эквивалент серебра составляет 1,1·10–3 г/Кл. На аноде будет выделяться кислород массой 0,35 г и объёмом 0,25 л.
Задание 131/2. Определите термодинамическую возможность коррозии медной платы с серебряными выводами с водородной и кислородной деполяризацией в кислой среде (рН = 3). Составьте схемы образующихся микрогальванических элементов и уравнения соответствующих процессов.
|
Дано:
рН = 3 |
Решение:
Рассмотрим водородную деполяризацию. Анодом будет являться медь, а катодом – серебро, т.к.
|
|
|
Процессы:
на
аноде –
![]() ,
,
![]() ;
;
на
катоде (рН < 7) –
![]() ,
,
![]()
![]() .
.
Так
как
![]() ,
то процесс протекать не будет.
,
то процесс протекать не будет.
Кислородная деполяризация.
Процессы:
на
аноде –
![]() ,
,
![]() ;.
;.
на
катоде (рН < 7) –
![]() ,
,
![]()
Суммарный процесс
![]() .
.
Ответ:
При водородной деполяризации медной
платы с серебряными выводами коррозия
проходить не будет, так как
![]() .
При кислородной деполяризации будет
коррозировать медная плата, а на
серебряных выводах будет выделяться
вода с поглощением кислорода из воздуха.
.
При кислородной деполяризации будет
коррозировать медная плата, а на
серебряных выводах будет выделяться
вода с поглощением кислорода из воздуха.
Задание 156/2. Как электролитически создать катодное покрытие на оловянном изделии? Приведите схему, уравнения соответствующих процессов. Чем объясняется ненадёжность катодных покрытий?
Решение:
Для
того, чтобы создать на олове
![]() катодное покрытие, необходимо нанести
на него более электроположительный
металл, например, медь
катодное покрытие, необходимо нанести
на него более электроположительный
металл, например, медь
![]() .
.
При
нарушении покрытия во влажном воздухе
будут протекать такие процессы (![]() ):
):
на
аноде –
![]() ;
;
на
катоде –
![]() .
.
Суммарный процесс:

.
Надёжными катодные покрытия являются только при условии отсутствия в них сквозных пор, трещин и других дефектов, так как они механически препятствуют проникновению агрессивной среды к основному металлу.