
Химия-03 / himia_2
.pdf
mail to denny@studhelp.info
1
Контрольная работа № 2
4. По стандартным энтальпиям образования веществ вычислите тепловой эффект реакции СаО(кр)+3С(кр) = СаС2(кр)+СО(г), протекающей при стандартных условиях.
Стандартные энтальпии образования веществ: |
|
|
|
|
|
||||
HCaO0 = −635.09 кДж/моль |
|
|
|
|
|
|
|||
HC0 = 0 кДж/моль |
|
|
|
|
|
fo |
|||
H 0 |
= −62.7 |
кДж/моль |
|
|
|
|
|
||
CaC2 |
|
|
|
|
|
|
|
|
|
HCO0 |
= −110.53 кДж/моль |
|
|
|
|
n |
|||
Согласно закону Гесса |
|
|
|
|
|||||
|
|
|
. |
|
|||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
P |
|
|
|
где n´ и n´´– стехиометрические коэффициенты, стоящие в уравнении реакцииi |
|
||||||||
Найдем тепловой эффект реакции: |
|
L |
|
|
|
||||
|
|
|
|
|
|
||||
H2980 |
= HCa0 |
С + HCO0 − HCaO0 |
E |
|
|
|
|
||
H2980 |
|
|
|
|
|
|
|
||
= –62.7 + (–110.53) – (–635.09) = 461.86 (кДж/моль) |
|
|
|
|
|
||||
Ответ: 461.86 кДж/моль |
DH |
|
|
|
|
|
|||
|
|
|
|
|
|
||||
34. Учитывая, что энтальпия парообразования воды 43,89 кДж/моль, рассчитайте изменение
энтропии при превращении 5 кг Н2О(ж) в пар. |
|
|
||||||||||
|
|
|
|
|
|
|
U |
|
|
|||
Соотношение между значениями энтальпии и энтропии при фазовых превращениях для |
||||||||||||
одного моля вещества равно: |
|
|
|
|
|
|
||||||
SФП = |
HФП |
, |
|
|
T |
|
|
|
|
|
||
|
T |
|
|
|
|
|
|
|
|
|
|
|
где Т– температура фазового превращения, |
К (температура кипения воды – 100+273 = |
|||||||||||
373 К). |
|
. |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
w |
|
|
|
|
|
m = 5000 |
= 277.8 (моль) Н О: |
||||
Рассчитаем изменение энтропии для n = |
||||||||||||
|
|
|
S |
|
M |
18 |
2 |
|||||
SФП = n |
HФП = 277.8 |
43.89 |
= 32.69 (кДж/К) |
|
|
|||||||
373 |
|
|
||||||||||
w |
T |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Ответ: 32.69 кДж/К |
|
|
|
|
|
|
|
|
|
|||
53. Возможноw |
ли самопроизвольное протекание реакции |
|||||||||||
SiО2(кр)+2СО(г) = Si(кр)+2СО2(г)
при стандартных условиях? Определите температуру наступления равновесия в данной системе.
Самопроизвольное протекание процессов при постоянстве температуры и давления возможно в таком направлении, при котором энергия Гиббса уменьшается G <0.
www.studhelp.info
mail to denny@studhelp.info
2
Энергию Гиббса при стандартных условиях можно найти, зная изменение энтальпии и энтропии для реакции:
DG298 = DH298 -TDS298
Согласно закону Гесса:
DH298 = DHSi + 2DHCO2 - 2DHCO - DHSiO2 DS298 = DSSi + 2DSCO 2 - 2DSCO - DSSiO2
DH298 = 0 + 2(-393.51) - 2(-110.53) - (-910.94) = 344.98 (кДж/моль)
DS298 =18.83 + 2×213.66 - 2×197.55 - 41.84 = 9.21 (Дж/моль∙К)
DG298 = 344980 - 298×9.21 = 342235.42 (Дж/моль) или 342.24 кДж/моль
Таким образом, при стандартных условиях самопроизвольное протекание реакции
невозможно. |
|
|
|
|
|
|
|
|
|
fo |
Температуру наступления |
равновесия G =0 в данной |
|
|
|
|
|||||
системе определим, пренебрегая |
||||||||||
зависимостью DH298 |
и DS298 |
от температуры: |
|
|
|
|
n |
|||
|
|
|
i |
|
||||||
G298 = H298 − T S298 = 0; |
|
|
|
|
|
|
. |
|
||
|
|
|
|
|
P |
|
|
|||
DH298 = TDS298; T = |
DH298 |
= |
344980 |
= 37457(K) |
|
|
|
|
||
9.21 |
|
|
|
|
||||||
|
DS298 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
L |
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
Ответ: самопроизвольное протекание реакции невозможно; равновесие в системе наступает |
||||||||||
при 37457 К |
|
|
|
DH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
83. Составьте схемы двух гальванических элементов, в одном из которых стандартный никелевый электрод — анод, в другом — катод. Запишите уравнения анодно-катодных
процессов и суммарные уравнения токообразующих реакций. Рассчитайте для первого |
|
случая ε , А′м, Кр. |
U |
|
|
В гальваническом элементе анодом является электрод с меньшим стандартным электродным
потенциалом, чем у катода. Воспользовавшись рядом напряжений металлов, определим |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
элементы, у которых стандартный потенциал меньше и больше, чем у никеля: |
|||||||||||||||||||||||||
ϕ0 2 |
|
|
|
|
|
. |
T |
|
|
|
|
|
|
|
|
|
|
||||||||
Ni |
+ / Ni |
|
|
|
|
|
w |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
ϕ0 2 |
+ / Zn |
= -0.763 B; |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Zn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
ϕ0 2 |
|
|
|
= +0.337 B |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
w |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Cu + / Cu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
В случае пары «никель–медь» никель является анодом; в паре «никель–цинк» – катодом. |
|||||||||||||||||||||||||
Схемы гальванических элементов: |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
(-)Ni |
|
Ni2+ |
|
|
|
Cu2+ |
|
Cu(+) |
(-)Zn |
|
Zn2+ |
|
|
|
Ni2+ |
|
Ni(+) |
||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
Уравнения анодно-катодных процессов: |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
(-) |
Ni - 2e ® Ni2+ |
|
(-)Zn - 2e ® Zn2+ |
||||||||||||||||||||||
w |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
2+ |
+ 2e ® Cu |
|
(+) Ni |
2+ |
+ 2e ® Ni |
|||||||||||||||||||
(+) Cu |
|
|
|
|
|
||||||||||||||||||||
Суммарные уравнения токообразующих реакций: |
|||||||||||||||||||||||||
Ni + Cu2+ ® Ni2+ + Cu |
Zn + Ni2+ ® Zn2+ + Ni |
||||||||||||||||||||||||
www.studhelp.info
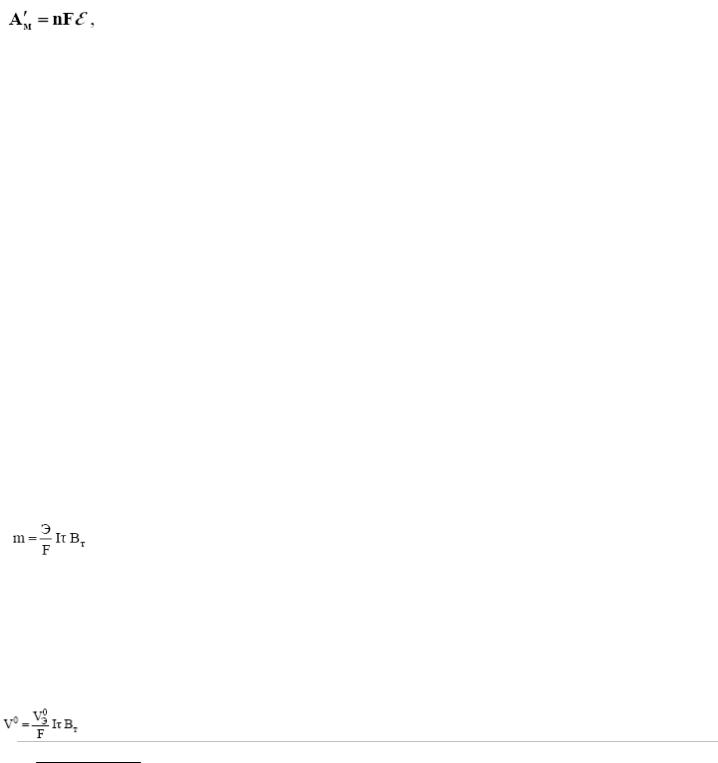
mail to denny@studhelp.info
3
Рассчитаем для первого случая ε , А′м, Кр.
1) Если электроды погружены в растворы своих солей с одинаковой концентрацией, то ЭДС элемента равно:
ε =ϕК -ϕА = ϕCu0 2+ / Cu -ϕNi0 2+ / Ni = 0.337 - (-0.250) = 0.587 (В) |
|
|
|
|
||||||
2) |
Полезная работа гальванического элемента |
|
|
|
|
|||||
А |
′ = 2×96490×0.587 =113279 (Кл× В) |
|
|
fo |
||||||
М |
|
|
|
|
|
|
||||
3) |
Константа равновесия реакции связана с ЭДС следующим соотношением. |
|
|
|||||||
lg Kp = |
nε |
= |
2 ×0.587 |
=19.9; Kp |
= 7.9 ×1019 |
|
n |
|
||
|
|
|
|
|||||||
|
0.059 |
0.059 |
|
|
|
|
||||
|
|
|
i |
|
|
|||||
|
|
|
|
|
|
|
|
|
||
Ответ: 0.587 В; 113279 Кл∙В; Кр=7.9∙1019 |
. |
|
|
|||||||
|
|
|
|
|
|
|
P |
|
|
|
115. Какое количество электричества следует пропустить через 1 М раствор ZnSO4 |
(pH=5), |
|||||||||
(н.у.) выделится на аноде? Составьте схему электролизаLна графитовых электродах и запишите уравнения анодно–катодных процессов.
чтобы масса катода увеличилась на 65 г, если ВТ = 80%? Какое вещество и какой его объем
При электролизе раствора ZnSO4 на катоде осаждается цинк, а на аноде образуется кислород. Схема электролиза:
K (–) C |
|
|
ZnSO4, H2O (pH=5) |
|
|
E |
|||||||||
|
|
|
|
||||||||||||
|
|
|
|
C A (+) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Zn2+, H2O |
|
|
|
|
|
|
|
|
|
SO42–, H2O |
|||||
K (–): |
|
|
Zn2+ + 2 ē → Zn 0 |
|
|
DH |
|||||||||
A (+): |
|
|
2H2O – 4 ē = O2 |
+ 4H+ |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
2 ZnSO4 + 2 H2O → 2 Zn + O2 |
+ 2 H2SO4 |
||||||||||
Согласно закону Фарадея |
|
|
U |
|
|
|
|
|
|||||||
T |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Отсюда |
|
количествоSэлектричества равно |
Q = Iτ = |
m × F |
, где m – масса цинка, |
||||||||||
|
|
||||||||||||||
|
|
|
. |
|
|
|
|
|
|
|
|
Э × BT |
|||
выделившегося на катоде (m = 65 г), ЭZn = МZn/2. |
|||||||||||||||
|
|
65×96490 |
|
|
|
|
|
|
|
|
|
|
|
||
Q = Iτ = |
|
w |
= 241225 (Кл) |
|
|
|
|
|
|
|
|
||||
65 / 2×0.8 |
|
|
|
|
|
|
|
|
|||||||
wПриwпропускании через раствор количества электричества, равного 241225 Кл на аноде выделяется кислород объемом
V 0 = 5.6×241225×0.8 =11.2 (л) 96490
Ответ: 241225 Кл; 11.2 л
www.studhelp.info
mail to denny@studhelp.info
4
138. Цинк находится в контакте с никелем в условиях влажной атмосферы (H2O, O2).
Составьте уравнения процессов гальванокоррозии и рассчитайте, на сколько уменьшится масса анода и чему будет равна сила тока, если за 1 мин. 20 с восстановилось 0,034 л O2
(н.у.).
Цинк, находясь в контакте с никелем в условиях влажной атмосферы, образует
гальванический элемент. |
Судя по |
стандартным потенциалам цинка и никеля |
|||||||||
(ϕNi0 2+ / Ni = -0.250 B; ϕZn0 2+ / Zn |
= -0.763 B ), |
анодом будет являться цинк. Тогда схема |
|||||||||
гальванического элемента следующая: |
|
fo |
|||||||||
|
|
||||||||||
(-)Zn |
|
Zn2+ |
|
|
|
Ni2+ |
|
Ni(+) |
|
n |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||
В условиях влажной атмосферы (H2O, O2) на электродах происходят следующие процессы: |
|||||||||||
(-)Zn - 2e ® Zn2+ |
|
i |
|
||||||||
+ |
|
. |
|
||||||||
(+) 2 H2O – 4 ē = O2 + 4 H |
|
|
|
||||||||
Используя закон Фарадея, рассчитаем силу тока, необходимую для восстановления 0,034 л
О2 за 1 мин. 20 с (60+20=80 с) (примем выход по току 100 %): |
P |
||||||||||||
I = |
V × F |
= |
0.034×96490 |
= 7.3 (А) |
|
||||||||
VЭ ×τ |
|
22.4 |
4 |
×80 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
L |
||
При такой силе тока в раствор перейдет |
|||||||||||||
|
|
|
|
|
|
652 × |
|
|
|
||||
mZn = |
MЭ |
× I ×τ |
7.3×80 |
|
E |
|
|||||||
|
|
|
|
= |
|
|
|
|
= 0.2 (г) цинка, |
|
|||
|
|
F |
|
|
96490 |
|
|||||||
|
|
|
|
|
|
|
|
|
|||||
следовательно, маса анода уменьшится на 0.2 г. |
|
||||||||||||
|
|
||||||||||||
Ответ: на 0.2 г; 7.3 А |
|
|
|
|
|||||||||
152. Щелочные серебряно-цинковые аккумуляторыDH: схема, уравнения процессов разрядки и зарядки. Основные характеристики, преимущества, недостатки, применение.
Серебряно-цинковый аккумулятор – это вторичный электрохимический источник тока, в |
|
|
U |
котором анодом является оксид серебра, в виде спрессованного порошка, электролитом – |
|
раствор химически чистого гидроксида калия ( ρ =1,4), катод – смесь оксида цинка и |
|
цинковой пыли |
T |
Серебряно-цинковый.Sаккумулятор отличается очень малым внутренним сопротивлением и большой удельной энергоёмкостью (150 Вт·ч/кг, 650 Вт·ч/дм³). ЭДС – 1,85 В (рабочее напряжение 1,55 В).
Одной изwважнейших особенностей серебряно-цинкового аккумулятора является способность (при надлежащей конструкции) отдавать в нагрузку токи колоссальной силы (до
w50 Аwна 1 А·час емкости). Эти аккумуляторы механически прочны. У них малый ток саморазряда, что обеспечивает возможность длительного хранения аккумуляторов в заряженном состоянии; высокая удельная энергия, которая примерно в три-четыре раза превышает удельную энергию свинцовых аккумуляторов. Среди аккумуляторов промышленной группы Щелочные серебряно-цинковые аккумуляторы являются самыми экологически чистыми.
Применяется в авиации, космосе, военной технике, часах и др.
Из недостатков следует отметить высокую стоимость; меньшее по сравнению с другими аккумуляторами количество циклов заряда/разрядa; длительное время заряда.
Электрохимическая схема серебряно-цинкового аккумулятора имеет вид:
www.studhelp.info

mail to denny@studhelp.info
5
(–) Zn | KOH | AgO, Ag (+)
При зарядке аккумулятора (восстановление на электроде активных веществ) на аноде
происходит окисление серебра:
(–) 2 Ag + 2 OH– – 2 е → Ag2O + H2O
с последующим окислением до иона двухвалентного серебра: Ag2O + 2 OH– – 2 е → 2 AgO + H2O
Суммарная реакция: 2 Ag + 4 OH– – 4 е → 2 AgO + 2 H2O
На катоде происходит процесс восстановления: |
|
|
fo |
(+) 2 Zn(OH)2 + 4 e → 2 Zn + 4 OH– |
|
|
|
После того, как потенциал серебряного электрода достигнет величины |
потенциала |
||
|
|
n |
|
выделения кислорода, главной реакцией становится реакция образования кислорода: |
|||
4 OH– – 4 e → 2 H2O + O2 |
P |
|
|
Напряжение аккумулятора при этом снова возрастает и за время менее одного часа достигает |
|||
величины 2,1 В. Продолжение заряда аккумулятора не только бесполезноi, но и вредно, т.к., |
|||
во первых, аккумулятор уже не воспринимает емкости, а, во вторых., выделяющийся на |
|||
|
L |
|
тем самым |
серебряных электродах кислород окисляет целлофановую сепарацию и |
|||
уменьшает её прочность. Кроме того, в результате наступающего электролиза цинкатного электролита на цинковых электродах начнется выделение цинка в виде дендритов, которые могут легко прокалывать сепарацию. Поэтому систематический перезаряд серебряноцинкового аккумулятора резко снижает срок его службы.
При работе аккумулятора в режиме разряда протекают следующие электрохимические |
|
процессы: |
E |
|
|
На аноде внутренней цепи происходит реакция окисления металлического цинка: |
|
(–) 2 Zn + 4 OH– – 4 e → ZnO + H2O + Zn(OH)2 |
|
На катоде внутренней цепи протекает реакция: |
|
(+) 2AgO + 2e + H2O → Ag2O + 2OH–, |
DH |
т.е. происходит реакция восстановления иона двухвалентного серебра до одновалентного |
|
иона и далее до чистого серебра по схеме: |
|
|
U |
Ag2O + 2 e + H2O → 2 Ag + 2 OH– |
|
|
T |
Суммарное уравнение имеет вид: |
|
2 AgO + H2O + 2 Zn → 2 Ag + ZnO + Zn(OH)2 |
|
При заряде эта реакцияSидет в прямом направлении, а при разряде – в обратном. |
|
. |
|
w |
|
166.wКремний, основные физические свойства, электронная формула и химическая связь. Напишите уравнения реакций взаимодействия кремния со сложными окислителями.
wКремний – кристаллическое вещество; типичный полупроводник. Температура плавления – 1417 ºС; кипения – 2600 ºС. У кремния кубическая гранецентрированная кристаллическая решетка типа алмаза с периодом а = 5.431 Å, плотностью 2,33 г/см3. При очень высоких
давлениях получена новая (по-видимому, гексагональная) модификация с плотностью 2,55 г/см3. Из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твердость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Кремний прозрачен к инфракрасному излучению, начиная с длины волны 1.1 мкм.
www.studhelp.info
mail to denny@studhelp.info
6
Электронная формула кремния – 1s22s22p63s23p2. На внешнем энергетическом уровне находится 4 электрона. В возбужденном состоянии – 1 s-электрон и 3 р-электрона; происходит sр3-гибридизация. Тип связи – ковалентная. Координационное число равно 4. Соединения кремния имеют форму тетраэдра.
Использование кремния при изготовлении полупроводников предполагает очистку кремния путем травления.
Наиболее широко используемой смесью для травления кремния является смесь плавиковой и
азотной кислот (в этом случае раствор быстро разогревается до температуры кипения и |
||
скорость реакции многократно возростает). |
fo |
|
|
||
Si+2HNO3=SiO2+NO+NO2+H2O; |
|
|
SiO2+4HF=SiF4+2H2O; |
n |
|
3SiF4+3H2O=2H2SiF6+↓H2SiO3 |
||
|
||
Также для травления можно использовать водные растворы щелочей (реакция идет при
температуре выше 60 ºС) |
|
|
|
P |
||||
Si+2KOH+H2O=K2SiO3+2H2↑ |
|
|
|
i |
||||
K2SiO3+2H2O↔H2SiO3+2KOH |
|
L |
. |
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
E |
|
|
|
|
|
|
|
|
DH |
|
|
|
|
|
|
|
U |
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
w |
|
|
|
|
|
|
|
w |
|
|
|
|
|
|
|
w |
|
|
|
|
|
|
|
|
www.studhelp.info
