
- •Тема:
- •Понятие электрохимической системы
- •Система, состоящая из металла, погруженного в раствор электролита, называется электродом, то есть электроды
- •КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
- •К электродам первого рода относятся электроды, в уравнение Нернста которых под знаком логарифма
- •Электроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же
- •в)электроды сурьмяные ОН- lSb2O3lSb применяются в качестве
- •Наиболее распространенные электроды сравнения, используемые для электрохимических измерений в водных средах
- •ВОДОРОДНЫЙ ЭЛЕКТРОД
- •водородный электрод:
- •ХЛОРСЕРЕБРЯННЫЙ ЭЛЕКТРОД
- •КОНСТРУКЦИИ ХСЭ ЭЛЕКТРОДА
- •ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ
- •ЭВП-08 электрод вспомогательный промышленный
- •Электрод сравнения типа ЭСр-1
- •Каломельный электрод (КЭ)— электрод, использующийся в качестве электрода сравнения в гальванических элементах. Ртутный
- •Конструкции ртутного электрода
- •В инверсионных определениях часто применяются стационарный ртутный электрод (висящая ртутная капля) и пленочные
- •Приставка Автосамплер АС-2D
- •ЭЛЕКТРОДЫ ИЗМЕРИТЕЛЬНЫЕ
- •Ионоселективные электроды (ИСЭ), чувствительные к катионам и анионам, представляют собой электрохимические системы, в
- •КОНСТРУКЦИИ ИОНСЕЛЕКТИВНЫХ ЭЛЕКТРОДОВ
- •ЭЛИС-212/3,0 Na электрод ионоселективный Предназначен для измерений активности ионов натрия в водных растворах,
- •Измерительные электроды стеклянные
- •Микросурьмяные электроды
- •Технические характеристики электродов(измерительных полуэлементов) ПИб и ПИт
- •КОНСТРУКЦИЯ СТЕКЛЯННОГО МИКРОСУРЬМЯНОГО ЭЛЕКТРОДА
- •ХИНГИДРОННЫЙ ЭЛЕКТРОД
- •ИЗМЕРИТЕЛЬНЫЕ ДАТЧИКИ
Тема:
ЭЛЕКТРОХИМИЧЕСКАЯ СИСТЕМА
План:
1.Понятие электрохимической системы
2.Классификация электродов
3.Электроды сравнения
4.Измерительные электроды
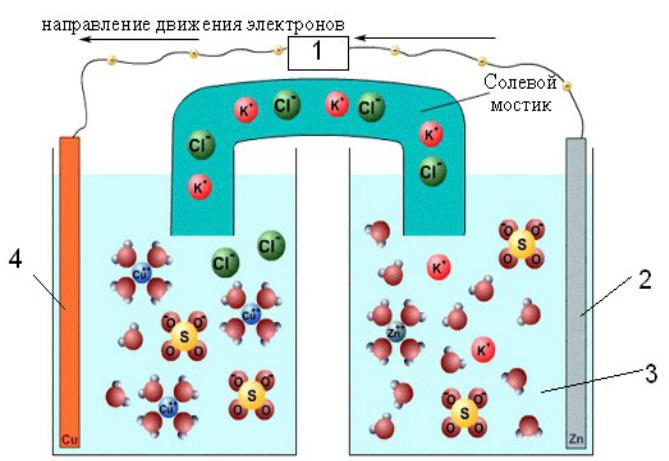
Понятие электрохимической системы
1 – источник тока;
2 – анод;
3 – электролит;
4 - катод

Система, состоящая из металла, погруженного в раствор электролита, называется электродом, то есть электроды в электрохимии – это системы из двух токопроводящих тел: проводников 1 и 2 рода.
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях.
уравнение Нернста для электродного процесса:
В этом уравнении – ЭДС реакции, n – число электронов, участвующих в электронной реакции, F – число Фарадея
Активность твердого вещества ( аМ ) принимается равной единице, поэтому в случае рассматриваемого нами металлического электрода уравнение Нернста упрощается:

КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
По типу потенциалопределяющей реакции (окислительно-восстановительного электродного процесса) электроды делят на электроды первого рода, второго рода (электроды с электрохимической реакцией) и ионоселективные (без электрохимической реакции)
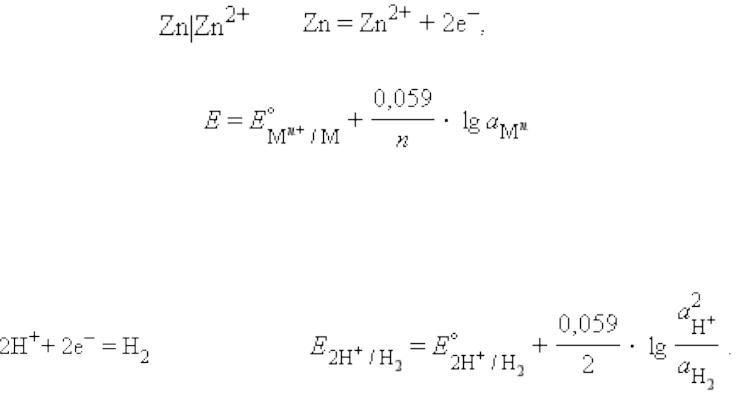
К электродам первого рода относятся электроды, в уравнение Нернста которых под знаком логарифма входят активности веществ, участвующих в электродной реакции. Потенциал таких электродов меняется с изменением концентрации реагентов.
Электродами первого рода являются:
1. Электроды, состоящие из элементарного вещества, находящегося в контакте с раствором, содержащим его собственные ионы.
а) Металлический электрод – металл, погруженный в раствор своей соли M|Mе+, например, цинковый электрод:
Металлический электрод обратим по отношению к катиону. Его электродный потенциал
б) Газовый электрод в качестве одного из компонентов электродной пары содержит газ (H2, Cl2 и др.), адсорбированный на химически инертном
проводнике первого рода (обычно платина, покрытая платиновой чернью). При контакте адсорбированного газа с раствором собственных ионов устанавливается равновесие.

Электроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же металла. При погружении в раствор соли одноименного аниона его потенциал будет определяться активностью иона в растворе.
а) Хлорсеребряный электрод (ХСЭ) Ag, AgCl|Cl– представляет собой серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный раствор KCl. Потенциалопределяющими являются ионы хлора, а электродный процесс может быть представлен уравнением
б) Каломельный электрод (КЭ) Hg, Hg2Cl2|Cl– – это ртуть, находящаяся в контакте с пастой из смеси ртути и каломели Hg2Cl2, которая, в свою очередь, соприкасается с насыщенным раствором KCl.
в)электроды сурьмяные ОН- lSb2O3lSb применяются в качестве
измерительных электродов в pH-метрах различных типов. Стеклянный микросурьмяный электрод представляет собой сурьмяную нить, впаянную в стеклянный капилляр или запрессованную во фторопласт.
потенциал сурьмянокисного индикаторного электрода определяется
уравнением
Е =0,264 - 0,0536 рН.
г) Ртутнооксидный электрод Hg/HgO, NaOH (1 M)рекомендуется использовать в растворах с рН>7.Устроен аналогично каломельному
электроду. Е 0,925 0,050lg аОН 0,0982 0,059рН
д) Ртутносульфатный электрод Hg/Hg2SO4,H2SO4 (0.5 M) или
Hg/Hg2SO4,K2SO4 (нас.). Целесообразно применять в растворах,
содержащих серную кислоту и сульфаты.
Е 0,6156 0,0296lg aSO42
Окислительно-восстановительные электроды
Хингидронный электрод (ХГЭ) используют для измерения рН во всех растворах, где применим водородный электрод, в растворах алкалоидов, насыщенных кислот, в присутствии разбавленных растворов азотной кислоты и ее солей.
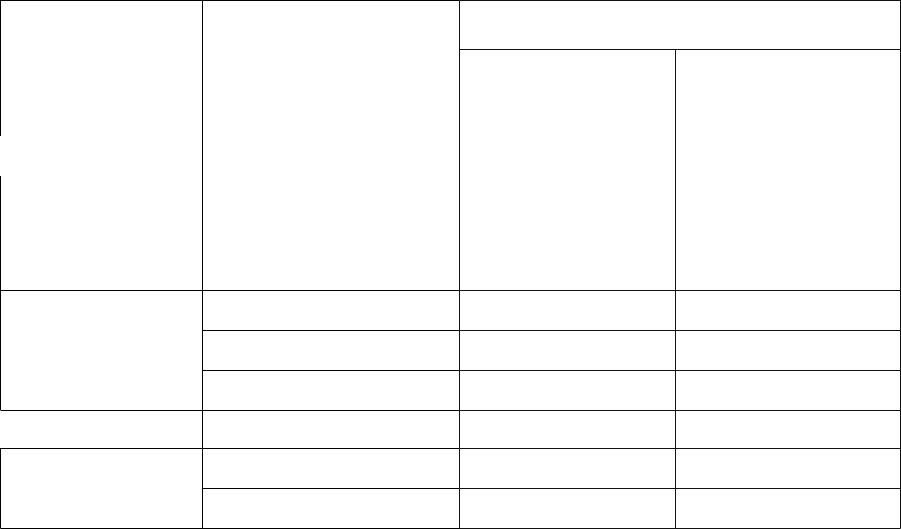
Наиболее распространенные электроды сравнения, используемые для электрохимических измерений в водных средах
Электрод
сравнения
 Водородный
Водородный
Хлорсеребряный
Каломельный
 Ртутнооксидный Ртутносульфатный
Ртутнооксидный Ртутносульфатный
Потенциал (при 250C)
Обозначение |
отн.водородного |
|
электрода |
|
сравнения |
(Pt)/H2, H+(a=1) |
0 |
Ag/AgCl, KCl (0.1 M) |
0.2881 |
Ag/AgCl, KCl (3.5 M) |
0.205 |
Ag/AgCl, KCl (нас.) |
0.1988 |
Hg/Hg2Cl2, KCl (0.1M) |
0.3337 |
Hg/Hg2Cl2, KCl (3.5M) |
0.250 |
Hg/Hg2Cl2, KCl (нас.) |
0.2412 |
Hg/HgO, NaOH (1 M) |
0.14 |
Hg/Hg2SO4,H2SO4 (0.5 M) |
0.682 |
Hg/Hg2SO4,K2SO4 (нас.) |
0.65 |
отн. каломельного электрода сравнения
-0.2412 0.047 -0.036 -0.042 0.0925 0.009
0
-0.101 0.441 0.41
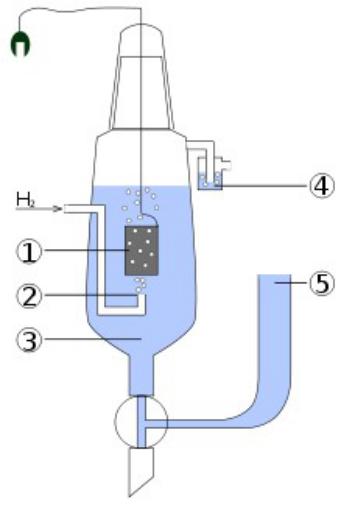
ВОДОРОДНЫЙ ЭЛЕКТРОД
Водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах.
Схема стандартного водородного электрода:
1.Платиновый электрод. 2.Подводимый газообразный водород.
3.Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.
4.Водяной затвор, препятствующий попаданию кислорода воздуха.
5.Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
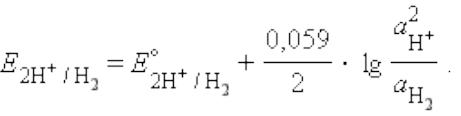
водородный электрод:
платина, опущенная в раствор содержащий ионы водорода
H + (раствор кислоты), через который пропускается газообразный водород
Потенциал пластины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции.
на поверхности платины обратимо протекает реакция: 2Н+ + 2e− = H2
Уравнение Нернста:
