
Раздел 5 (Кинетика)
.doc
РАЗДЕЛ 5. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
К простым реакциям относятся необратимые химические реакции, не связанные с образованием промежуточных продуктов и параллельным образованием нескольких веществ. k
Н еобратимая
реакция первого порядка – реакция типа
А В. Мгновенная скорость такой реакции
w
пропорциональна концентрации вещества
А и обозначается
еобратимая
реакция первого порядка – реакция типа
А В. Мгновенная скорость такой реакции
w
пропорциональна концентрации вещества
А и обозначается
![]() :
:
![]() ,
,
где k – константа скорости реакции.
Кинетическое уравнение для реакций первого порядка
![]()
где
![]() -
константа скорости реакции первого
порядка;
-
константа скорости реакции первого
порядка;
![]() -
концентрация исходного вещества в
момент времени t
от начала реакции.
-
концентрация исходного вещества в
момент времени t
от начала реакции.
Размерность
константы скорости
![]() находится
делением размерности скорости
находится
делением размерности скорости
![]() моль/(л.с) на
размерность концентрации с
моль/л, поэтому размерность составляет
моль/(л.с) на
размерность концентрации с
моль/л, поэтому размерность составляет
![]() (или мин
(или мин![]() ).
Величина
).
Величина
![]() не зависит от
способа выражения концентрации.
не зависит от
способа выражения концентрации.
Время, за которое
исходная концентрация
![]() уменьшается
в 2 раза, называется временем полупревращения,
а для радиоактивных процессов – временем
полураспада и обозначается
уменьшается
в 2 раза, называется временем полупревращения,
а для радиоактивных процессов – временем
полураспада и обозначается
![]() .
.
Для реакции первого порядка время полупревращения является величиной, не зависящей от концентрации и связанной с константой скорости соотношением:
![]() .
.
Существует еще одна постоянная, характеризующая скорость реакций первого порядка. Эта величина называется средним временем жизни молекулы
![]() .
.
k k
Необратимые реакции
второго порядка – реакции типа а) А + А
![]() Р или б) А + В
Р или б) А + В![]() Р
Р
Мгновенные скорости реакций определяются по уравнениям:
а)
![]() б)
б)
![]()
Концентрации реагирующих веществ к моменту времени определяются по уравнениям:
а)
![]() б)
б)
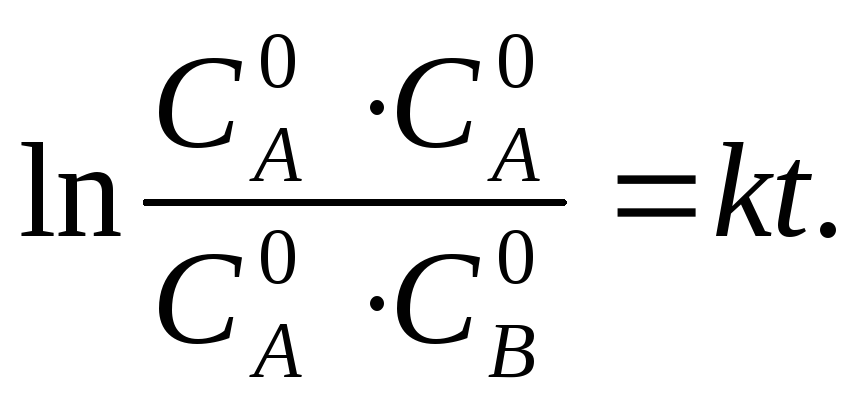
Период полупревращения
![]() для реакций
второго порядка:
для реакций
второго порядка:
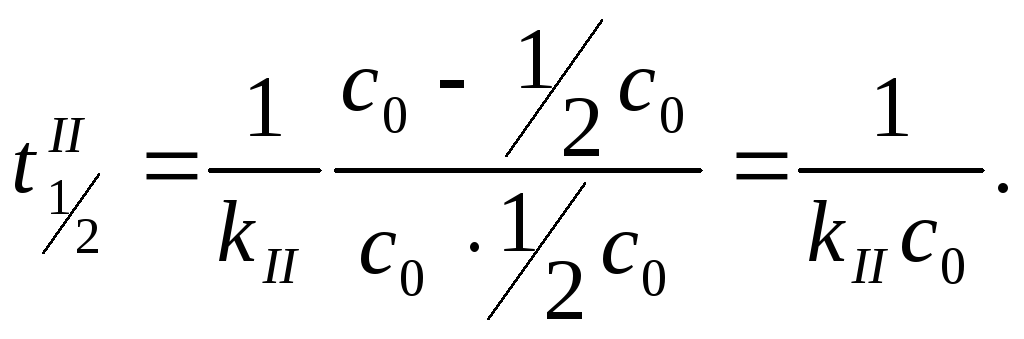
Период полупревращения для реакций второго порядка обратно пропорционален начальной концентрации реагирующих веществ. Чем больше начальная концентрация, тем за меньшее время израсходуется ее половина.
Необратимые реакции
п-го
порядка – реакции типа аА
+ bB
+ cC
+ …
![]() продукты реакции, где (а+b+c+…=
n).
продукты реакции, где (а+b+c+…=
n).
Наибольший интерес
представляет случай взаимодействия
одинаковых молекул: пА
![]() продукты
реакции. Для этого случая кинетические
уравнения таковы:
продукты
реакции. Для этого случая кинетические
уравнения таковы:

где
![]() - по-прежнему начальная концентрация
вещества А.
- по-прежнему начальная концентрация
вещества А.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ
ХИМИЧЕСКОЙ РЕАКЦИИ
Для значительного
числа химических реакций выполняется
эмпирическое правило Вант-Гоффа, согласно
которому повышение температуры на
![]() приводит к повышению скоростей реакции
от двух до четырех раз, т.е.
приводит к повышению скоростей реакции
от двух до четырех раз, т.е.
![]() или
или
![]()
Полуэмпирическая зависимость константы скорости химической реакции от температуры устанавливается уравнением Аррениуса:
![]() ,
,
Уравнение в этой форме более удобно для расчета энергии активации.
Примеры решения задач
Пример 1. Константа скорости реакции дегидрирования метиламина
![]()
равна
![]() при 913 К. за какое время концентрация
метиламина уменьшается в 2 раза? Чему
равно среднее время жизни молекулы
метиламина?
при 913 К. за какое время концентрация
метиламина уменьшается в 2 раза? Чему
равно среднее время жизни молекулы
метиламина?
Решение. Время, за которое концентрация метиламина уменьшается в 2 раза, вычисляем по формуле:
![]() (с)
(с)
Находим среднее время жизни молекулы метиламина:
![]() (с)
(с)
Пример 2. Реакция самоокисления-самовосстановления ионов гипобромида с образованием броматов и бромидов в щелочной среде
![]()
описывается
кинетическим уравнением реакции 2-го
порядка с константой скорости, равной
![]() .
Исходная концентрация гипобромида
равна 0,1
.
Исходная концентрация гипобромида
равна 0,1
![]() .
За какое время прореагирует 30% исходного
количества гипобромид-ионов?
.
За какое время прореагирует 30% исходного
количества гипобромид-ионов?
Решение. В соответствии с уравнением
![]()
для нахождения
времени необходимо предварительно
определить действующую концентрацию
гипобромид-ионов
![]() .
По условию задачи
.
По условию задачи
![]() .
Следовательно,
.
Следовательно,
![]()
![]() (с).
(с).
Пример 3.
Температурный
коэффициент реакции равен 3,5. Константа
скорости этой же реакции при 15![]() равна 0,2
равна 0,2
![]() .
Какова константа скорости реакции при
40
.
Какова константа скорости реакции при
40![]() ?
?
Решение. В соответствии с уравнением Вант-Гоффа имеем:
![]()
![]()
![]() .
.
Пример 4. Константа скорости реакции при 300 К равна 0,02, а при 350 К – 0,6. Какова энергия активации этой реакции? Чему равен предэкспоненциальный коэффициент в уравнении Аррениуса?
Решение. Для
двух температур
![]() и
и
![]() ,
которым соответствуют константы скорости
,
которым соответствуют константы скорости
![]() и
и
![]() ,
в соответствии с уравнением Аррениуса
можно получить систему уравнений:
,
в соответствии с уравнением Аррениуса
можно получить систему уравнений:
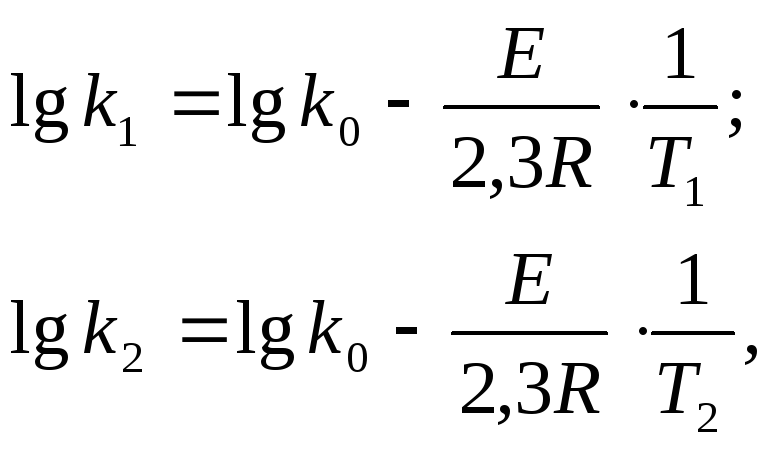
из которой следует:
![]()
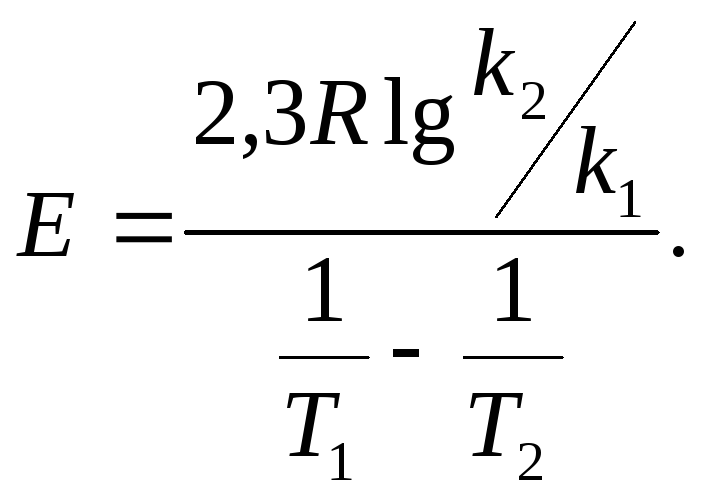
Приняв, что
![]() =300
К,
=300
К,
![]() =350
К и
=350
К и
![]() =0,02,
=0,02,
![]() =0,6,
определяем энергию активации:
=0,6,
определяем энергию активации:
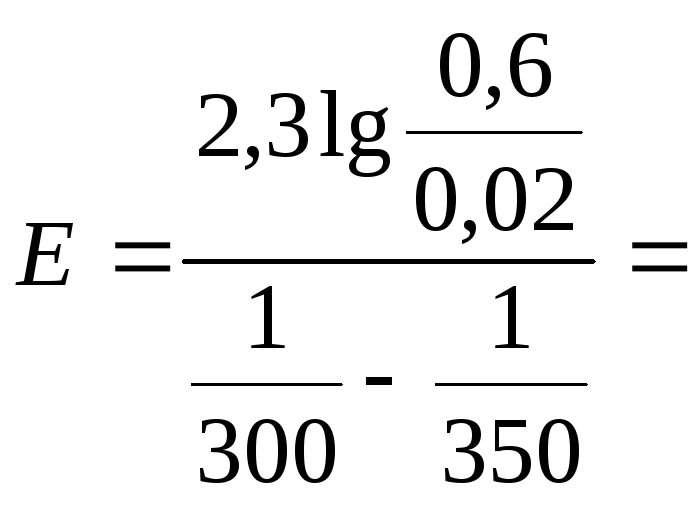 59 400=59,4
(кДж/моль)
59 400=59,4
(кДж/моль)
Находим предэкспоненциальный коэффициент:
![]()
Задачи
1. Скорость
реакции второго порядка равна 4,5![]() моль/л.с при концентрации одного реагента
1,5
моль/л.с при концентрации одного реагента
1,5![]() и другого 2,5
и другого 2,5![]() моль/л. Рассчитайте константу скорости
в
моль/л. Рассчитайте константу скорости
в
![]() .
.
2. Реакция
термического разложения этана является
реакцией 1-го порядка. При 823 К константа
скорости этой реакции равна 2,5![]() ,
а при 903 К – 141,5
,
а при 903 К – 141,5![]() .
Рассчитайте период полупревращения
для этой реакции при 873 К.
.
Рассчитайте период полупревращения
для этой реакции при 873 К.
3. В результате взаимодействия формальдегида с перекисью водорода образуется муравьиная кислота (реакция 2-го порядка):
![]()
Если смешать равные
объемы 1 М растворов
![]() и НСНО,
то через 2 ч при 333 К концентрация
муравьиной кислоты становится равной
0,214 моль/л. Вычислите константу скорости
реакции и определите, через сколько
времени прореагирует 90% исходных веществ.
и НСНО,
то через 2 ч при 333 К концентрация
муравьиной кислоты становится равной
0,214 моль/л. Вычислите константу скорости
реакции и определите, через сколько
времени прореагирует 90% исходных веществ.
4. Константа
скорости реакции при 298 К и 323 К
соответственно равна 0,0093 и 0,0806 мин![]() .
Определите энергию активации этой
реакции.
.
Определите энергию активации этой
реакции.
5. Реакция А+В=С 2-го порядка. Если исходные концентрации равны, то за 500 с реакция проходит на 20%. За какое время она пройдет на 60%?
6. Разложение некоторого вещества является реакцией 2-го порядка с энергией активации 23,1 кДж/моль. При 300 К разложение этого вещества проходит со скоростью 95% в 1 ч. Вычислите температуру, при которой это вещество разлагается со скоростью 77,5% в 1 мин.
7. Две
реакции одинакового порядка имеют
одинаковые предэкспоненциальные
множители, но их энергии активации
различаются:
![]() =83,196
кДж/моль. Рассчитайте отношение их
констант скоростей
=83,196
кДж/моль. Рассчитайте отношение их
констант скоростей
![]() при 434 К.
при 434 К.
8. Реакция
разложения аммиака на горячей вольфрамовой
проволоке протекает при 129 К по уравнению
![]() . За скоростью реакции следили по
повышению общего давления
. За скоростью реакции следили по
повышению общего давления
![]() .
С течением времени давление в системе
при постоянном объеме и температуре
повышалось следующим образом:
.
С течением времени давление в системе
при постоянном объеме и температуре
повышалось следующим образом:
![]() ,с………………..
100 200 400 600 800
,с………………..
100 200 400 600 800
![]() ,
Па
,
Па![]() ……..
14,66 29,33 59,70 89,60 117,21
……..
14,66 29,33 59,70 89,60 117,21
Начальное давление
в системе равнялось 266,6![]() Па. Определите порядок реакции и
рассчитайте константу скорости (вместо
концентраций можно брать давления).
Па. Определите порядок реакции и
рассчитайте константу скорости (вместо
концентраций можно брать давления).
9. Реакция первого порядка проходит на 30% за 35 мин. Какова скорость реакции (моль/л.ч) при концентрации реагирующего вещества 0,01 моль/л?
10. При одной и той же концентрации реагирующих веществ скорость реакции при 303 К вдвое выше, чем при 293 К. Вычислите величину производной dlnk/dT при 300 К.
11. Константа
скорости реакции рацемизации
правовращающего изомера соединения
![]() в уксусной кислоте (реакция катализируется
азотной кислотой) равна 4,94
в уксусной кислоте (реакция катализируется
азотной кислотой) равна 4,94![]() .
Вычислите время, за которое прореагирует
16% исходного количества вещества.
.
Вычислите время, за которое прореагирует
16% исходного количества вещества.
12. Бекмановская перегруппировка

![]()
![]()
![]()
в растворителях
протекает как реакция первого порядка.
Если реакция проводится при 99![]() в тетрахлорметане, то константа скорости
этой реакции равна 1,3
в тетрахлорметане, то константа скорости
этой реакции равна 1,3![]() .
В бензоле эта реакция протекает в 10 раз
быстрее. Вычислите время, за которое
превращается 45% исходного вещества в
тетрахлорметане. Какая доля вещества
за это же время превратится в бензоле?
.
В бензоле эта реакция протекает в 10 раз
быстрее. Вычислите время, за которое
превращается 45% исходного вещества в
тетрахлорметане. Какая доля вещества
за это же время превратится в бензоле?
13. Распад
оксида азота (I)
![]() при 900
при 900![]() характеризуется
данными, приведенными в таблице.
характеризуется
данными, приведенными в таблице.
|
Время, с |
900 |
1800 |
3180 |
3900 |
4800 |
6000 |
7200 |
|
Степень превращения, % |
16,5 |
32 |
50 |
57 |
65 |
73 |
78 |
Определите среднее значение константы скорости и времени полупревращения.
14. Константа
скорости реакции получения сложного
эфира по реакции обмена между йодистым
этилом и а-оксипропионатом
серебра
![]()
![]()
проводимой в
вводно-спиртовой смеси при 25![]() ,
равна
,
равна
![]() .
Для проведения этой реакции концентрации
йодистого этила и а-оксипропионата
серебра берут одинаковыми. Какой исходной
концентрации участников реакции
соответствует время половинного
превращения, равное 400 с?
.
Для проведения этой реакции концентрации
йодистого этила и а-оксипропионата
серебра берут одинаковыми. Какой исходной
концентрации участников реакции
соответствует время половинного
превращения, равное 400 с?
15. Хлорирование бензола, проводимое в ледяной уксусной кислоте:
![]() ,
,
является реакцией
второго порядка с константой скорости
![]() .
Исходные концентрации: бензола -
.
Исходные концентрации: бензола -
![]()
![]() и хлора -
и хлора -
![]() =0,05
=0,05
![]() .
Определите, за какое время образуется
половина возможного при этих условиях
количества хлорбензола.
.
Определите, за какое время образуется
половина возможного при этих условиях
количества хлорбензола.
16. Для определений порядка реакции взаимодействия хлорид-ионов с хлорноватистой кислотой
![]()
протекающей в воде, брали равными концентрации реагентов и определяли время, за которое концентрация ионов хлора уменьшается в 2 раза. Результаты измерений таковы:
|
Исходные
концентрации,
|
0,1 |
0,05 |
0,03 |
0,02 |
|
Время уменьшения концентрации в 2 раза, с |
1,50 |
2,98 |
5,0 |
7,4 |
17. Катализатор снижает энергию активации с 60 кДж/моль. Определите, как влияет на температурный коэффициент реакции при 300 К введение катализатора.
18. Разность энергий активации реакций равна 8 кДж/моль. При 400 К выход вещества В составляет 25%. Каким окажется выход вещества при 500 К?
19. Как
изменится скорость прямой реакции
![]() ,
если увеличить давление в три раза?
,
если увеличить давление в три раза?
20. В сосуде имеется 0,025 г радона. Период полураспада равен 3,82 дня. Какое количество радона (%) останется в сосуде через 14 дней?
21. Какой
должна быть энергия активации, чтобы
скорость реакции увеличилась в 3 раза
при возрастании температуры от 45![]() до 55
до 55![]() .
.
22. Температурный
коэффициент реакции первого порядка
равен 3. За какое время разложится
половина вещества при 50![]() ,
если при 30
,
если при 30![]() половина вещества разлагается за 90
минут?
половина вещества разлагается за 90
минут?
23. При
25 и 40![]() константы скорости реакции разложения
хлорноватистокислого натрия в растворе
равны соответственно 0,0093 и 0,0342. Вычислить
значение константы скорости этой реакции
при 50
константы скорости реакции разложения
хлорноватистокислого натрия в растворе
равны соответственно 0,0093 и 0,0342. Вычислить
значение константы скорости этой реакции
при 50![]() .
.
24. Во
сколько раз увеличится время, необходимое
для завершения реакции, если понизить
температуру на 45![]() ?
Температурный коэффициент скорости
реакции принять равным 3.
?
Температурный коэффициент скорости
реакции принять равным 3.
25. Зависимость константы скорости реакции
![]()
от температуры
при малых глубинах конверсии описывается
уравнением:
![]() =14,678-15800/Т
. Определите время пребывания реакционной
массы в реакторе при 800
=14,678-15800/Т
. Определите время пребывания реакционной
массы в реакторе при 800![]() ,
если процесс подчиняется кинетическому
уравнению реакции первого порядка, а
оптимальная степень конверсии составляет
50%.
,
если процесс подчиняется кинетическому
уравнению реакции первого порядка, а
оптимальная степень конверсии составляет
50%.
26. Кинетика реакции:
![]()
изучалась по выделению кислорода во времени. Получили следующие результаты:
Замер 1 2 3 4 5 6 7 8 9 10
![]() ,
мин 6 9 12 14 18 22
24 26 30
,
мин 6 9 12 14 18 22
24 26 30
![]()
![]() см
см![]() 19,3 26,0 32,6 36,0 41,3 45,0 46,5 48,3
50,4 58,3
19,3 26,0 32,6 36,0 41,3 45,0 46,5 48,3
50,4 58,3
Определите порядок, период полураспада и константу скорости этой реакции.
27. Кинетика реакции образования фосгена:
![]()
изучалась путем
наблюдения за изменением концентрации
СО
и
![]() в смеси эквивалентного исходного
состава. По нижеприведенным результатам
эксперимента определите порядок, период
полураспада и константу скорости это
реакции.
в смеси эквивалентного исходного
состава. По нижеприведенным результатам
эксперимента определите порядок, период
полураспада и константу скорости это
реакции.
Замер 1 2 3 4 5 6
![]() ,
мин 0 12 18 24 30
42
,
мин 0 12 18 24 30
42
![]() ,
М 18,7 17,9 17,6 17,3 17,0 16,4
,
М 18,7 17,9 17,6 17,3 17,0 16,4
28. Кинетика скорости реакции:
![]()
при 525![]() рав
0,48 с
рав
0,48 с![]() ,
а при 665
,
а при 665![]() 1,9 с
1,9 с![]() .
Какова энергия активации этой реакции?
.
Какова энергия активации этой реакции?
29. Энергия активации реакции:
![]()
равна 21 кДж/проб.
Определите, как изменится интенсивность
производства этилбензола при внедрении
новой технологии, основанной на проведении
процесса при 160-200![]() по сравнению с существующей технологией,
основанной на ведения процесса при
по сравнению с существующей технологией,
основанной на ведения процесса при
![]() 100
100![]() .
.
30. Скорость
химической реакции удваивается при
увеличении температуры на 10![]() .
При каком значении энергии активации
это утверждается в интервале 295-305
.
При каком значении энергии активации
это утверждается в интервале 295-305![]() .
.
31. В
реакции первого порядка энергия активации
Е=104,5 кДж/моль и в уравнении
![]() .
При какой температуре период полураспада
равен: а) 1 мин, б) 30 дням?
.
При какой температуре период полураспада
равен: а) 1 мин, б) 30 дням?
Вопросы.
1. Как связана скорость реакции взаимодействия водорода с кислородом выраженная по водороду, со скоростями этой реакции, выраженными по другим компонентам?
2. Напишите уравнение зависимости константы скорости реакции от температуры в дифференциальной форме.
3. Как изменяется концентрация продукта реакции со временем, если реакция имеет нулевой порядок?
4.
Какой вид имеет график зависимости
логарифма константы скорости реакции
от![]() ?
?
5. Как зависит от исходных концентраций реагирующих веществ период полупревращения для реакции 2-го порядка?
6. Что называется молекулярностью химической реакции?
7. Как зависит от исходной концентрации реагирующего вещества период полупревращения для реакции 1-го порядка?
8. Какая из односторонних реакций заканчивается быстрее при одинаковых исходных концентрациях и одинаковых константах скорости: реакция 1-го, 2-го или 3-го порядка?
9. Что называется порядком химической реакции?
10. Имеет ли размерность и какую константа скорости реакции?
11. Напишите выражение для константы скорости реакции 1-го порядка.
12. Как графически определить значение константы скорости реакции 2-го порядка при равных исходных концентрациях реагирующих веществ?
13. Укажите размерность константы скорости реакции 2-го порядка.
14. Выведите выражение для периода полупревращения исходных веществ по реакции 3-го порядка, если исходные концентрации реагирующих веществ одинаковы.
15. В каких случаях скорость реакции определяется изменением концентрации реагирующих веществ в единицу времени?
16. Представьте график зависимости скорости реакции от температуры, если энергия активации – величина положительная.
17.
Сопоставьте константы скоростей двух
реакций 1-го порядка
![]() и
и
![]() ,
если период полупревращения первой
реакции в пять раз больше, чем второй.
,
если период полупревращения первой
реакции в пять раз больше, чем второй.
18. Какие экспериментальные данные необходимы для определения порядка реакции?
19. Какие из следующих факторов влияют на скорость химической реакции: природа реагирующих веществ, концентрация реагирующих веществ, катализатор, растворитель, температура?
20. Графическим выражением какой зависимости является кинетическая кривая?
21. Какой минимум экспериментальных данных необходим для расчета энергии активации реакции?
22. Классификация химических реакций.
23. Зависимость скорости химических реакций от различных температур.
24. Закон действующих масс. Молекулярность и порядок реакции.
25. Уравнение кинетики реакции первого, второго и нулевого порядка. Период полупревращения (полураспада). Определение порядка реакции.
26. Температурный коэффициент скорости реакции. Ускоренные методы определения сроков годности лекарственных веществ.
27. Энергия активации. Уравнение Аррениуса.
28. Теория активных соударений. Понятие о теории переходного состояния.
29. Сложные реакции (параллельные, последовательные, сопряженные, обратимые).
30. Цепные реакции и их характеристика.
31. Фотохимические реакции. Квантовый выход. Закон Эйнштейна.
32. Гетерогенные реакции. Кинетическая и диффузионная области гетерогенных реакций. гетерогенные реакции в фармации.
33. Гомогенный анализ. Механизм действия. Кислотно-основный катализ.
34. Гетерогенный катализ. Теории (мультиплетная Баландина А.А. и теория ансамблей И.И.Кобозева).
35. Ингибиторы, торможение химических реакций. Механизм этого процесса.
36. Использование положений и выводов химической кинетики в фармации.
37. Каковы различия между молекулярностью и порядком реакции? В каких случаях они не совпадают, выражаются дробными числами?
