
Reshenia_zadach
.docx40.

39. По одну сторону мембраны (внутри клетки) помещен раствор белка с концентрацией PtCl, равной 0,1 моль/л, по другую – раствор с концентрацией хлорида натрия 0,2 моль/л. Рассчитайте концентрацию хлорид ионов по обе стороны мембраны при условии равновесия.
Решение:
Избирательная проницаемость клеточных мембран обуславливает особое перераспределение электролитов по разные еѐ стороны, известное под названием равновесие Доннана. Молекулы белка через мембрану не проходят.
1. Обозначим количество ионов хлора (в пересчете на 1 л раствора), которое перейдет через мембрану внутрь клетки по закону Доннана, х моль, столько же переходит и ионов натрия.
|
|
|
|
|
|
|
|
2. По уравнению Доннана: |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
||
где x – количество ионов, перешедших внутрь при контакте мембраны с межклеточной жидкостью; снар – концентрация иона во внеклеточной жидкости; свнутр – концентрация иона во внутриклеточной жидкости.
3.с(Cl–)нар =с(NaCl)=0,2 моль/л;с(Cl–)внутр=с(PtCl)= 0,1 моль/л.
4.Количество ионов Cl–,которое перейдет через мембрану в клетку:
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
||
|
|
|
|
Таким образом, количество ионов хлора, перешедших в клетку равно
0,08 моль/л.
5.Находим количество ионов хлора, которые остались снаружи и перешли внутрь клетки:
с(Cl–)нар = 0,2 – 0,08 = 0,12 моль/л;с(Cl–)внутр = 0,1 + 0,08 = 0,18 моль/л.
Ответ: в состоянии равновесия концентрация ионов(Cl–) составляет снаружи 0,12 моль/л, внутри 0,18 моль/л.
38. Для расчёта осмотического давления растворов ВМС используется уравнение Галлера

Выражаем M и подставляем данные из условия задачи:
M = 4,176 *8,314 · (25 + 273) / (120,9 - 4,1762) = 100 кг/моль.
Молярная масса полистирола 100 кг/моль.
37. Гемоглобин (pI= 6,68) поместили в буферный раствор с концентрацией ионов водорода 1,5∙10-6 моль/л. Определите направление движения молекул гемоглобина при электрофорезе. Известно, что в эритроцитах рН = 7,25. Какай заряд имеют молекулы гемоглобина при этом значении рН?
Находим рН буферного раствора: -lg[H+]=6,18, рН раствора ниже изоэлектрической точки белка. Следовательно белок будет заряжен положительно и при электрофорезе молекулы будут перемещаться к катоду.
При рН=7,25 молекулы гемоглобина будут заряжены отрицательно, потому что рН раствора будет выше. Чем изоэлектрическая точка.
36. К какому электроду будут передвигаться частицы белка (pI 4,0) при электрофорезе в ацетатном буфере, приготовленном из 100 мл раствора с концентрацией ацетата натрия 0,1 моль/л и 25 мл раствора с концентрацией уксусной кислоты 0,2 моль/л?
Найдем рН раствора:
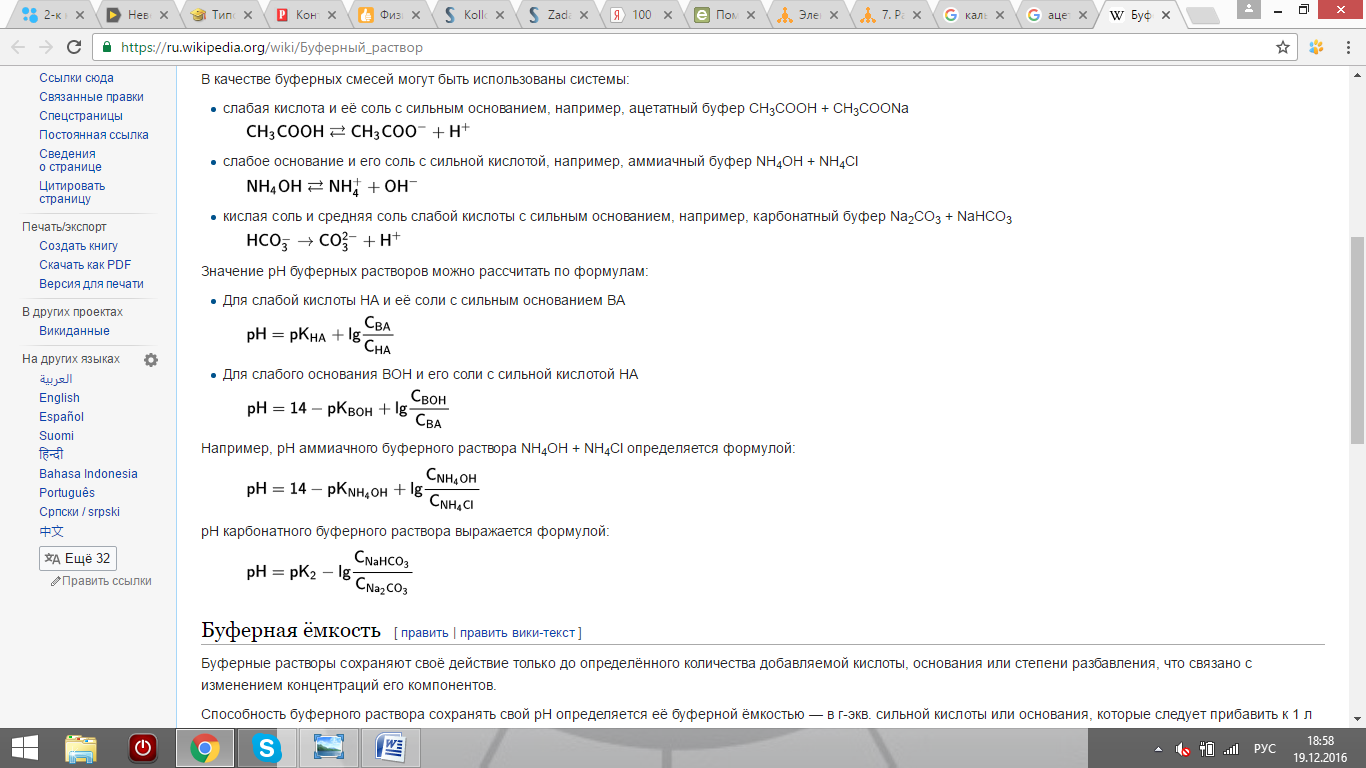
Концентрация соли =0,1*0,1=0,01моль/л
Концентрация кислоты = 0,025*0,2=0,005моль/л.
Подставляем в формулу: рН=lg(1,74*10(-5))+lg(0,01/0,005)=5,54
Изоэлектрическая точка ниже рН раствора, значит, белок заряжен отрицательно и при электрофорезе будет перемещаться к аноду.
35. Какой минимальный объём (NH4)2S с концентрацией 0,001 моль/л следует добавить к 15 мл раствора МnCl2 с концентрацией 0,003 моль/л для того, чтобы получить золь с отрицательным зарядом частиц? Решение: (NH4)2S + МnCl2 → 2NH4Cl + МnS↓ В результате реакции получим гидрозоль сульфида марганца (II). Если реакция проводится в избытке (NH4)2S, то ядро (кристаллик МnS) будет адсорбировать анионы серы, поэтому кристалл приобретет отрицательный заряд, а если в избытке МnCl2 - то катионы марганца, тогда кристалл будет с положительным зарядом. Отношение реагентов в реакции 1:1. Для полной реакции с 15 мл раствора МnCl2 0,003 М нужны: V = 15 х 0,003 / 0,001 = 45 мл (NH4)2S При данном объеме не будет заряда, т.к. нет избытка ионов, способных достраивать кристалл. Но если взять больше 45 мл (NH4)2S, то получим золь с отриц. зарядом частиц.
34.
33.Решение:
Обозначим
искомый объем электролита-коягулянта
через «Х», тогда:
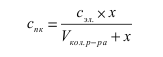
Определим
концентрацию электролита, вызвавшего
коагуляцию, по формуле:
![]()
С=(8*1,07*10)/261,97=0,327 моль/л
Определяем объем электролита, т.е. находим «Х»:
0,65*10-3=0,327*Х/(2+Х); Х=0,00398 л=3,98 мл.
Ответ: объем раствора дихромата натрия равен 3,98 мл.
32. Решение:
Определяем массу сульфата магния, вызвавшего коагуляцию, и его количество:
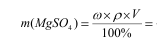 (10%*1,109г/мл*0,78
мл)/100%=0,0865г.
(10%*1,109г/мл*0,78
мл)/100%=0,0865г.
Количество молей сульфата равно:
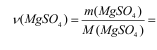 0,0865/120,366=7,186*10-4
моль.
0,0865/120,366=7,186*10-4
моль.
![]() 7,186*10-4
моль.
7,186*10-4
моль.
Определяем порог коагуляции по формуле:
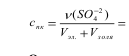 7,186*10-4
моль/(5л +0,78*10-3л)=1,437*10-4моль/л
7,186*10-4
моль/(5л +0,78*10-3л)=1,437*10-4моль/л
Ответ: порог коагуляции равен 1,437*10-4моль/л.
31. Решение:
По результатам титрования находим равновесную концентрацию уксусной кислоты:
С=(25*0,02моль/л)/15=0,033 моль/л
Определяем адсорбцию по разности концентраций исходного и равновесного растворов уксусной кислоты (адсорбата):

Г=((0,18-0,033)*0,07)/3=0,00343 моль/г
Ответ: величина адсорбции уксусной кислоты составила 0,00343 моль/г.
30. Величина и тип адсорбции определяются по уравнению
Гиббса:

Г=-((70,2-73,05)*10^-3)/(2*8.134*293)=5.8*10^-7 величина адсорбции положительная
29. Приближенно находим поверхностную активность пентанола в интервале концентраций с1– с2, где с1 = 0 (т.е. чистый растворитель), с2 = 0,05 моль/л;
σ1– коэффициент поверхностного натяжения воды, справочная величина:

g=-((58,3*10^-3 – 71.96*10^-3))/(0.05-0)=1,3809Н*л/(моль*м)

![]() 1,3809/3,2=
0,4315 Н*л/(моль*м)
1,3809/3,2=
0,4315 Н*л/(моль*м)
Так как концентрация раствора бутанола 0,02 моль/л является серединой интервала, в котором рассчитывалась поверхностная активность, величина адсорбции из этого раствора рассчитывается по уравнению Гиббса:
![]() (0,02*0,4315)/(8,314*298)=3,48*10^-6
моль/м2
(0,02*0,4315)/(8,314*298)=3,48*10^-6
моль/м2
Ответ: Г=3,48*10^-6 моль/м2
28. Определяем степень диссоциации:
![]() (1,34*10-5/0,2)0,5=0,008185.
(1,34*10-5/0,2)0,5=0,008185.

ʌ=0,008185*385,6*10-4=3,156*10-4 См*м2/моль.

![]() 3,156*10-4*0,2*1000=6,312*10-2См*м-1.
3,156*10-4*0,2*1000=6,312*10-2См*м-1.
Ответ: 6,312*10-2См*м-1.
27. Определяем молярную концентрацию NaОН в растворе:
C=масса щелочи/ (молярная масса щелочи* объем раствора, л) =0, 8г/(40*0,5)=0,04 моль/л.
Определяем удельную электрическую проводимость раствора щелочи:
К=Кячейки/Rраствора=80/156=0,51 См/м.
Рассчитываем молярную электрическую проводимость раствора:
![]() 0,51/(0,04*1000)=0,01275
См*м2/моль.
0,51/(0,04*1000)=0,01275
См*м2/моль.
Ответ: 0,01275 См*м2/моль.
26. Решение:
По справочнику определяем: k(0,1М KСl) = 2,480 См ⋅ м–1.
Определяем константу ячейки:
k = κ(KСl) ⋅ R(KCl) = 2,48 ⋅ 30,55 = 75,764м–1.
Определяем κ плазмы крови:
 =75,764/43,4=1,746
См*м-1.
=75,764/43,4=1,746
См*м-1.
Ответ: 1,746 См*м-1.
25. Решение:
φ(Cu2+/Cu)=0,35+(0,059/2)lg0,002=0,27035 В;
φ(Zn2+/Zn)=-0,76+(0,059/2)lg0,002= - 0,8396 В;
Е=0,27035-(- 0,8396)=1,11 В.
Ответ: ЭДС не изменится.
24.
23.
22.
21.
20. Решение:
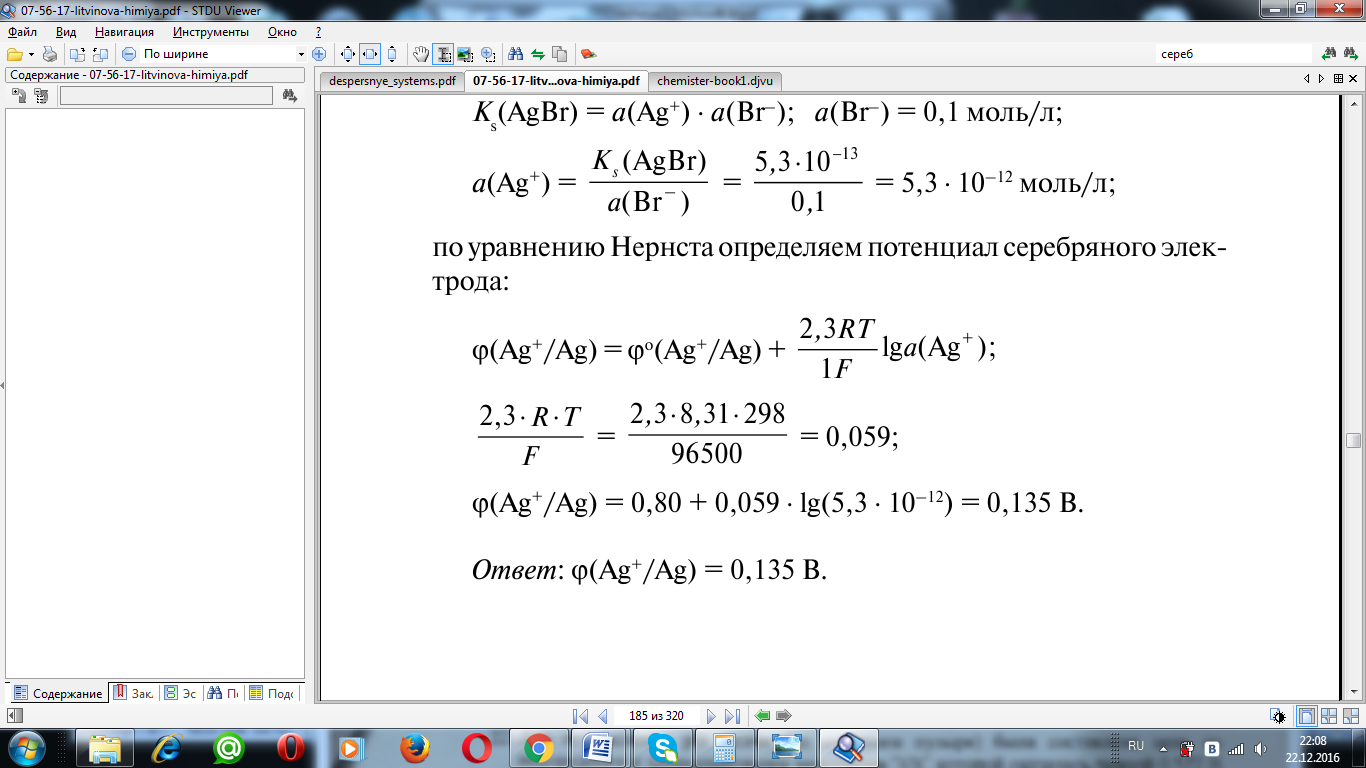
a=γ*c
φ=0,799+((2,3*8,314*298)/96500)lg(0.734*0.1)=0.732 В
Ответ: 0,732 В.
19.
Решение. Уравнение реакции, при протекании которой образуется оса-
док, имеет следующий вид:
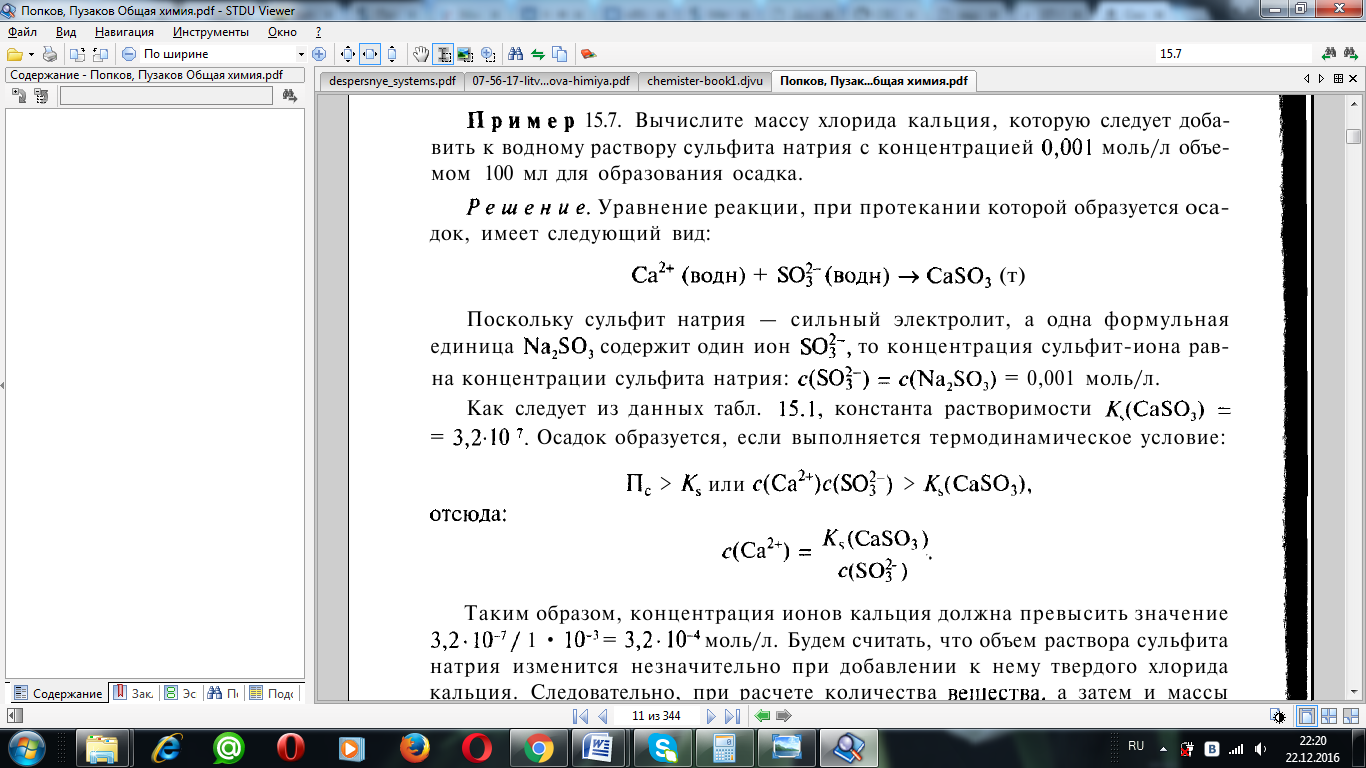
Из табличных данных константа растворимости CaSO3=3.2*107
Осадок образуется, если выполняется термодинамическое условие:
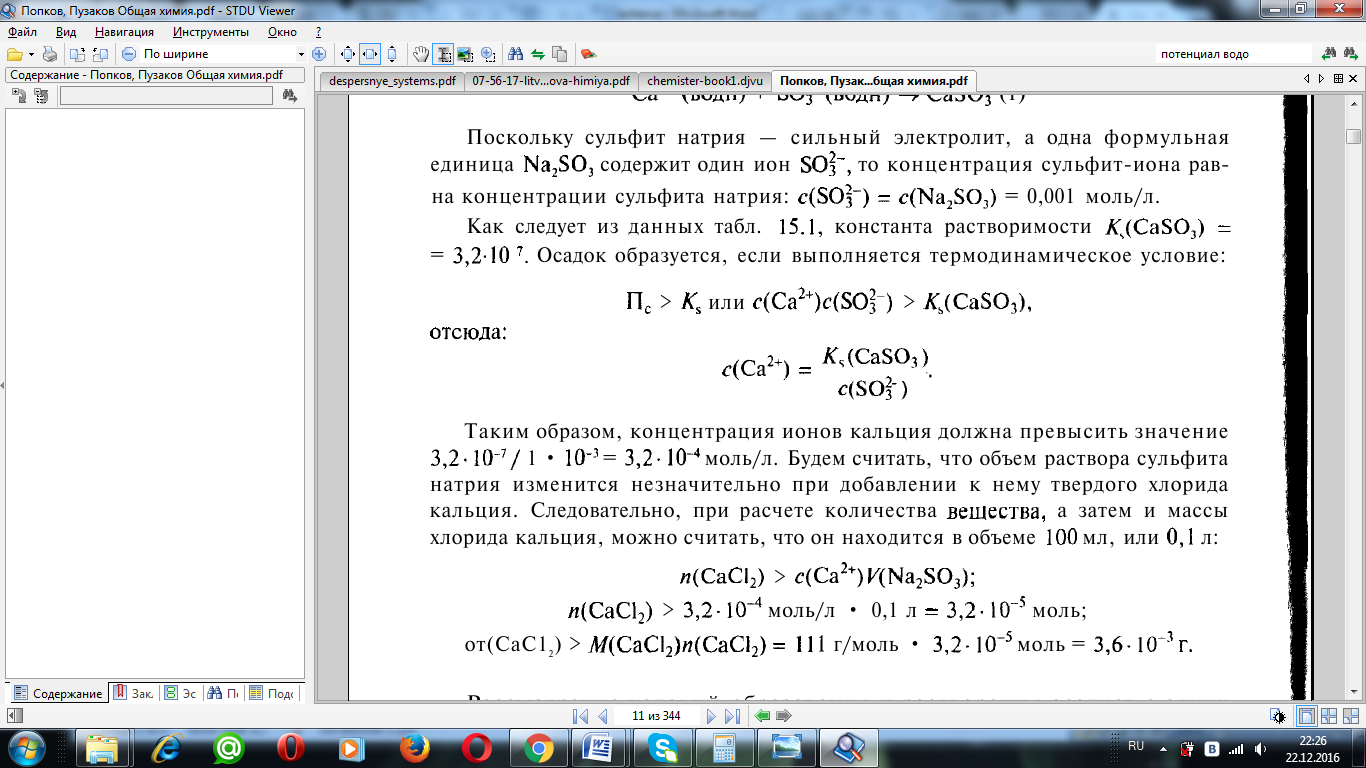
Таким образом, концентрация ионов кальция должна превысить значение 3,2*10-7/ 1 * 10-3 = 3,2-10-4 моль/л. Будем считать, что объем раствора сульфита натрия изменится незначительно при добавлении к нему твердого хлорида кальция. Следовательно, при расчете количества вещества, а затем и массы хлорида кальция, можно считать, что он находится в объеме 10 мл, или 0,01 л:
![]() =3.2*10-4*0.01
л
=3,2*10-6
моль
=3.2*10-4*0.01
л
=3,2*10-6
моль
Масса хлорида кальция = молярная масса хлорида кальция 111 г/моль * количество молей хлорида кальция 3,2*10-6 моль=3,55*10-4 г
Ответ: 3,55*10-4 г.
18. Произведение растворимости карбоната кальция из таблицы Кs =3,5*10-9 .
Ks = s2, где s – молярная концентрация насыщенного раствора,
S=(3,5*10-9)0.5=6.16*10-5
m(CaCO3)=6.16*10-5*100 г/моль*2,5 л=0,015 г.
Ответ: 0,015г.
17.
16. Ответ: не обладает, т.к. даны одинаковые объемы и концентрации щелочи и кислоты, которые взаимодействуют 1:1 с образованием соли и воды.
10. в воде дистиллированной:
Ks=5.3*10-13
S= (Ks)1/2=7.28*10-7моль/л
В 0,02 М бромиде калия:
если к насыщенному раствору малорастворимого электролита добавить раствор другого электролита, содержащий одноименный ион, то, согласно принципу Ле-Шателье, Vкрист.>Vраствор, поэтому растворимость уменьшается. При добавлении к раствору AgBr раствора KBr равновесие процесса диссоциации AgBr смещается влево, растворимость AgBr уменьшается. Так как Ks(AgBr) = [Ag+] ⋅ [Br–] – величина постоянная при данной температуре, то при увеличении концентрации аниона Cl– концентрация ионов Ag+ уменьшается, т.е. достигается полнота его осаждения.В 0,02 М растворе KBr: [Ag+] = s, [Br–] = 0,01 + s; Ks(AgBr) = [Ag+][Br–] = s(0,01 + s) = 5.3 ⋅ 10–13.
Поскольку концентрация Br– в растворе KBrнамного больше концентрации Br– в растворе AgBr, то можно допустить, что 0,01+ s ≈ 0,01, тогда Ks = 0,01s = 5.3 ⋅ 10–13, отсюда s = 5.3 ⋅ 10-11 моль/л.
Ответ: растворимость AgBr в 0,02 М растворе KBr уменьшается и равна 5.3 ⋅ 10-11 моль/л. В дистиллированной воде равна 7.28*10-7моль/л.
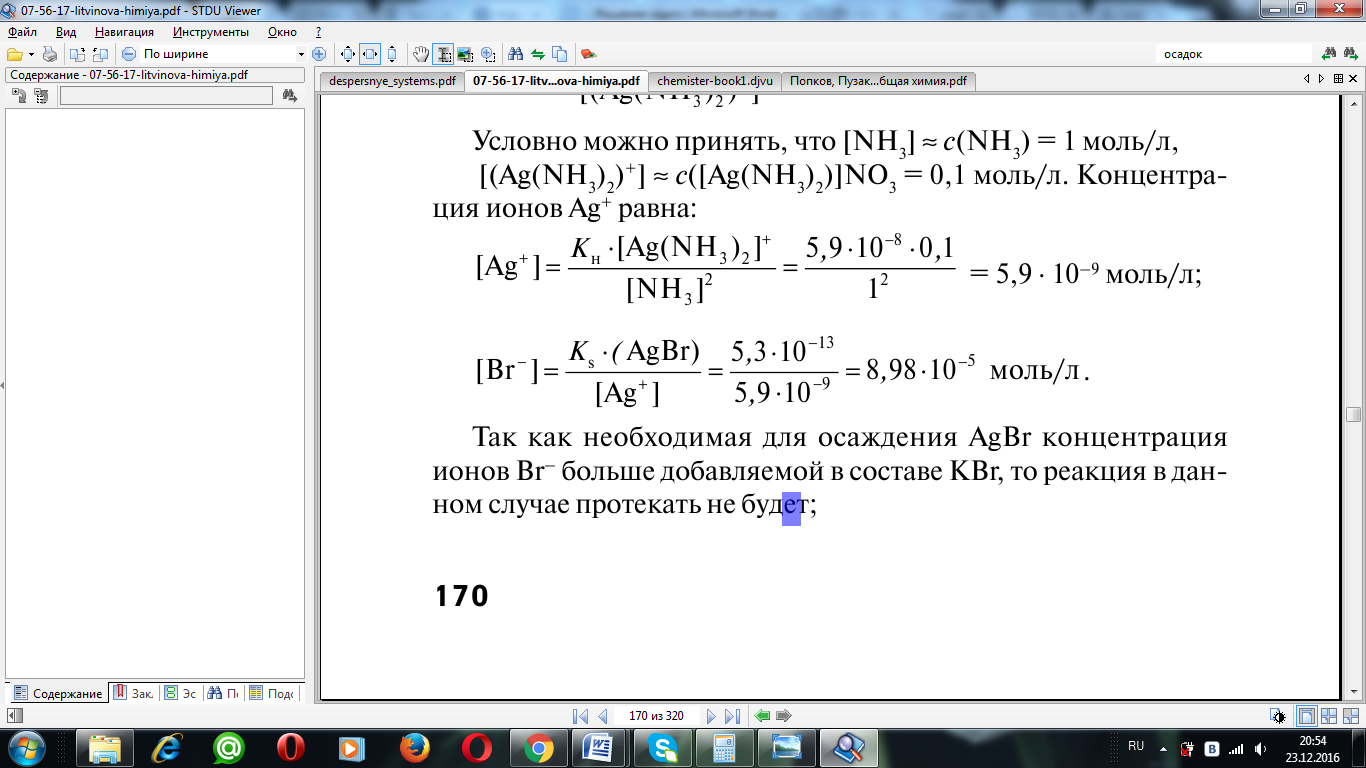
9. Решение. Для решения вопроса о возможности разрушения комплексного иона за счет связывания комплексообразователя в малорастворимую соль необходимо оценить значения равновесных концентраций ионов в рассматриваемой системе.
а) Kн[Ag(NH3)2]+ = 5,9 ⋅ 10–8; Ks(AgBr) = 5,3 ⋅ 10–13;

Условно можно принять, что [NH3] ≈ c(NH3) = 1,5 моль/л,
[(Ag(NH3)2)+] ≈ с([Ag(NH3)2)]NO3 = 0,26 моль/л.
Концентрация ионов Ag+ равна:
![]() =
(5,9 ⋅
10–8
*0,26)/(1,5)2
=6,817*10-9
моль/л;
=
(5,9 ⋅
10–8
*0,26)/(1,5)2
=6,817*10-9
моль/л;
 =5,3*10-13/6,817*10-9=7,71*10-5
моль/л.
=5,3*10-13/6,817*10-9=7,71*10-5
моль/л.
Так как необходимая для осаждения AgBr концентрация Br–меньше добавляемой в составе KI, то реакция в данном случае будет протекать и комплексный ион разрушается.
6. Решение. Бромид аммония гидролизован по катиону в растворе:
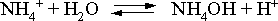
Согласно соотношению:
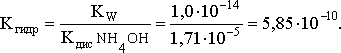

Из этих двух выражений и вычисляем рН 0,001 М раствора NH4Br:
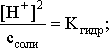
![]() 5,85*10-10*0,001=5,85*10-13
5,85*10-10*0,001=5,85*10-13
pH = – lg 5,85×10–13 =12,23.
Степень диссоциации h=(10-14/1.71*10-5*0,1)1/2=7,65*10-6
5. K HNO2 =4*10-4
h=(10-14/4*10-4*0,1)1/2=1.58*10-5
Кгидр = 2,5*10-11
рН= 5,80
4. В результате гидролиза образуются ОН–ионы, т.е. среда в растворе — щелочная. Концентрация ОН–ионов определяется по формуле:
с(ОН–) = h ⋅ с(NaHCO3), где h – степень гидролиза соли, а с(NaHCO3) – молярная концентрация NaHCO3 в растворе;
С(NaHCO3)=m/(M*V)=6г/(84 г/моль*0,3л)=0,238моль/л
С(ОН-)= (0,015%/100%)*0,238=3,57*10-5 моль/л
р(ОН) = -lg(ОН-)=-lg(3.57*10-5)=4.45
рН+рОН=14
рН=14-рОН=14-4,55=9,55
3. Решение:
Концентрация KOH в разбавленном растворе равна:
|
|
с2(KOH)= |
с1 (KOH)V1 |
= |
0,2 моль/л 150 мл |
= 0,086 моль/л. |
|
|
V2 |
350 мл |
|||
|
|
|
|
|
||
|
|
|
|
|
а(ОН-)=γ*с
рНисх=14-рОН
рОН исх=- lgγ*Сисх =- lg0,2*0,68=0,87
рН исх=14-0,87=13,13
рОНполуч=-lg0,086*0,9=1,11
следовательно, рН получ=14-1,11=12,89
ΔрН=13,13-12,89=0,24 ед.рН
Ответ: при разбавлении раствора его рН изменился на 0,24 ед.
-
Решение:
По закону разведения Оствальда степень ионизации слабых электролитов равна: Kb = α2 с; отсюда α=(Кb/с)1/2
где Kb = константа ионизации слабого основания, с – молярная концентрация аммиака в растворе;
ω*ρ*10
|
С= |
|
|
|
= |
8*0,92*10 |
|
|
|
=2,102 моль/л |
||
|
M (NH3 Н2O) |
|
|
35 |
|
|
||||||
|
|
|
|
|
|
|
||||||
|
рKа + рKb = 14; рKb = 14 – 9,24 = 4,76; |
|||||||||||
|
Kb =10–4,76 = 1,74*10–5 ; α=(1.74*10-5/2.102)1/2=2.875*10-3
|
|
|
|
|
|||||||
Ответ: степень ионизации аммиака равна 2.875*10–3.
14.

23.

2.

21.

8.

11.

22.

16.

24.



