

ДОНЕЦЬК 2010
УДК 612.015(075.8)+577.1(075.8)
А в т о р и :
З.М.Скоробогатова , Ю.Д.Турсунова , А.Г.Матвієнко , Є.В.Хомутов ,
О.М.Бакурова , Т.О.Журавель , О.П.Шатова
Біохімія в рисунках і схемах .Навчально -наочний посібник для студентів фармацевтичного факультету . – Донецьк , 2010. – 225 с.
Навчально -наочний посібник з біологічної хімії для студентів вищих фармацевтичних закладів освіти III - IV рівнів акредитації підготовлений співробітниками кафедр біохімії і фармацевтичної та токсикологічної хімії, які мають значний досвід викладання біоорганічної і біологічної хімії на фармацевтичному факультеті Донецького національного медичного університету ім. М. Горького . Посібник складається з окремих розділів , присвячених біохімії ферментів , вітамінів , енергетичному обміну , загальним шляхам катаболізму , обміну вуглеводів , ліпідів , білків, нуклеотидів , основам молекулярної біології , а також біохімії гормонів , крові та печінки . У відповідних розділах навчального посібника надана наочна інформація у вигляді кольорових рисунків та схем про структуру , функції , біохімічні перетворення органічних молекул у організмі людини . Пояснюються причини можливих порушень метаболічних процесів в
організмі |
людини , а також показані механізми дії ряду лікарських засобів , |
створених |
на підставі знань про структури біоорганічних сполук та біохімію |
обміну речовин . Розділи посібника мають елементи профілізації з урахуванням фаху провізора .
Р е ц е н з е н т и :
Скляров О.Я., доктор медичних наук, професор , завідувач кафедри біохімії Львівського національного медичного університету ім. Данила Галицького .
Попов А.Ф., академік НАН України , доктор хімічних наук, професор кафедри біохімії Донецького національного університету .
Рекомендовано Міністерством освіти і науки України як навчальний посібник для студентів фармацевтичних факультетів вищих навчальних закладів (протокол №1/11 7415 від 06.08.2010 р.).
2
ЗМІСТ
Стор.
1. Передмова …………………………………………………………………….. 4
2. Ферменти ……………………………………………………………………… .5
3. Вітаміни ………………………………………………………………………..20
4. Вступ до обміну речовин ……………………………………………………..33
5. Обмін вуглеводів ……………………………………………………………...53
6. Обмін ліпідів …………………………………………………………………..75
7. Обмін простих білків………………………………………………………….98
8. Обмін нуклеотидів …………………………………………………….119
9. Молекулярні основи передачі генетичної інформації ……………………..131
10. Введення в ендокринологію …………………………………………………154
11. Біохімія крові…………………………………………………………………196
12. Біохімія печінки ………………………………………………………………216
13. Предметний покажчик ……………………………………………………….223
14. Література …………………………………………………………………….225
3
ПЕРЕДМОВА
Розвиток біохімії відбувається стрімкими темпами і стає все більш важливим фундаментом для вивчення патогенезу хвороб людини , розробки ефективних методів діагностики та лікування . Значні досягнення у біохімії та клінічній біохімії дають змогу створення нових фармакологічних засобів для профілактики та лікування захворювань .
Майбутнім фармацевтам біохімія потрібна , щоб вміти використовувати знання про молекулярні основи функціонування клітин , тканин та органів , а також організму у цілому , що є необхідним при подальшому вивченні профільних дисциплін та в майбутній професіональній діяльності . На жаль, у навчальному плані кількість лекцій з біохімії для студентів фармацевтичного факультету не дає змогу у достатній мірі викласти величезний обсяг складної інформації , яку містить така фундаментальна дисципліна як біологічна хімія. Саме тому метою авторів було скласти посібник , у якому в наглядній формі , але при цьому стисло і лаконічно , представлена інформація , яку, на наш погляд , повинен містити лекційний курс для студентів -фармацевтів .
На відміну від фундаментального підручника з біохімії , навчально -наочний посібник для студентів фармацевтичного факультету “Біохімія в рисунках і схемах “ містить дуже стислу інформацію по кожній темі, яка розподілена на невеликі фрагменти і супроводжується кольоровими рисунками і схемами метаболічних процесів . Поряд зі схемами метаболічні процеси представлені також і у традиційному формульному вигляді . Такий підхід , на наш погляд , допомагає студентам різнобічно сприйняти навчальний матеріал , полегшує його засвоєння та порозуміння . Наприкінці кожного розділу містяться тестові завдання для самоконтролю засвоєння матеріалу . Вибір вірної відповіді потребує ретельного аналізу отриманої інформації . До тестових завдань у навчальному посібнику є еталони відповідей . Усі розділи мають елементи профілізації з урахуванням фаху провізора .
Окремо повинні зауважити , що для студентів -фармацевтів , які глибоко інтересуються біохімією , цей посібник є дуже лаконічним , тому усі неосяжні біохімічні питання , що не увійшли в посібник , мають бути отримані з відповідних підручників та монографій , список яких є у рекомендованій літературі .
Колектив авторів дуже вдячний завідувачу кафедрою професору Борзенко Б.Г. за підтримку при підготовці посібника , а також рецензентам професору Склярову О.Я. и професору Попову А.Ф. за зауваження та корисні пропозиції під час підготовки посібника .
4 |
Колектив авторів |
|

ФЕРМЕНТИ
“Медицина говорить мовою ензимології” (О.Браунштейн )
Ферменти (ензими) |
– це біологічні |
катал |
ізатори білкової природ и, кот рі |
прискорюють перебіг |
хімічних реакційу клітинах. |
|
|
Ферменти , тобто білки з каталітичними функціями , відрізняються від хімічних каталізаторів за трьома унікальними властивостями :
 високою ефективністю дії;
високою ефективністю дії;
 специфічністю дії;
специфічністю дії;
 здатності до регуляції.
здатності до регуляції.
Докази білкової природи ферментів:
денатурують під дією хімічних і фізичних чинників;
при гідролізі розщеплюються до амінокислот ; мають амфотерні властивості; рухомість під дією електричного поля;
не проходять (не діалізуються )крізь напівпроникні мембрани;
осаджуються висолюванням; мають високу молекулярну масу;
характеризуються високою специфічністю; прямий доказ - синтез білків-ферментів.
Первинна структура пер шого синтезованого білка-фермента
рибонуклеази (1969 рік)
Класифікація ферментів
В основу класифікації покладений тип каталізованої ферментом реакції.
|
Клас |
|
|
Тип каталізованої реакції |
|
||||||||||
1. |
Оксидоредуктази |
Окисно -відновні реакції: |
|
|
|
|
|
|
|
||||||
|
|
А |
|
+ В |
|
|
|
|
|
|
А |
+ В |
|
||
|
|
|
|
|
|
|
|
||||||||
|
|
відн. |
окис |
|
|
|
окис |
|
відн. |
|
|||||
2. |
Трансферази |
Перенос |
груп атомів від молекули -донора до акцептора : |
|
|||||||||||
|
|
|
|
А-Х + В |
|
|
|
|
|
А + В-Х |
|
||||
|
|
|
|
|
|
|
|
|
|||||||
3. |
Гідролази |
Гідроліз (розрив ) зв’язків у присутності води: |
|
||||||||||||
|
|
|
А-В + НО |
|
|
|
|
А-Н + В-ОН |
|
||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||
4. |
Ліази |
Розрив зв’язків між атомами С, О, N, S негідролітичним або |
|
||||||||||||
|
|
неокисно -відновним шляхом : |
|
|
|
||||||||||
|
|
|
|
А(Х)-В(Y) |
|
|
|
|
AX + BY |
|
|||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||||||
5. Ізомерази |
Взаємне перетворення зомеріві: |
|
|
|
|||||||||||
|
|
|
|
А |
|
ізомер А |
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||||
6. |
Лігази |
Утворення нових зв’язків у реакції конденсації двох молекул |
|||||||||||||
(синтетази) |
з використанням енергії АТФ: |
|
|
|
|||||||||||
|
|
|
|
|
|
АТФ |
АДФ |
|
|
5 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А + В |
|
|
|
|
|
А-В |
|||||
|
|
|
|
|
|
|
|
|
|
||||||
Речовина, на котру діє ензим (Е), називається субстратом (S). В результаті ферментативної реакції утворюється продукт (Р):
S |
|
Р |
Е |
Структура ферментів |
|
ферменти |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
прості |
|
|
|
|
|
складні |
|
||
|
ферменти |
|
|
|
|
|
ферменти |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
апофермент |
|
|
|
кофактор |
||
|
|
|
|
|
|
|
|
|
|
|
•Ферменти , як і білки, поділяються напрості та складні.
Прості ферменти - це поліпептидні ланцюги . При гідролізі вони розщеплюються до амінокислот (наприклад, ферменти пепсин , ліпаза, амілаза).
Складний фермент називається голоферментом.
Складні фермент и складаються з білкової частини ( апофермента) та небілкової частини - кофактора.
Якщо кофактор міцно зв’язаний з білковою частиною та не дисоціює при в иділенні фермента, то він називається простетичною групою (наприклад, іони металів).
Якщо |
кофактор легко дис оціює, то він називається коферментом (найчастіше це |
похідні |
вітамінів). У складних ферментах ані кофактор ам, ані апоферментам не |
притаманні самостійні каталітичні дії.
Функціональна организація ферментів
Білкова природа фермент ів визначає їхні функціональні особливості. П ерш за все ,
ферменти |
- це макромолекул и, к отрі за своїми розмірами суттєво |
перевищують |
|
реагуючі |
речовини - субстрати. |
Тому ферменти працюють не |
всією своєю |
поверхнєю, а лише її частиною - активним центром ферменту.
Активний центр - це частина молекул и ферменту (унікальна комб інація ам інокислотних залишків), яка безпосередньо приймає участь у каталізі. Ці амінокислотні
залишки |
знаходяться у |
різних м ісцях поліпептидного |
ланцюгу, |
але при прост |
оровому уклад анні, тобто при |
формуванні трети нної структур и, вони зближуються, створюючи активний центр. Таким чином, активний центр формується на рівні третинної структури, тому денатурація призводить до втрати каталітичної активності ферментів.
6
До активного центру входять наступні функціональні групи:
• СООН-групи дикарбонових амінокислот і кінцеві
• аміногрупи лізину та кінцеві;
• фенольна група тирозину;
• ОН-групи серину та треоніну;
• SH-група цистеїну та дисульфідні зв’язки, утворені цистеїном ;
• індольна група триптофану;
• гуанідинова група аргініну;
• імідазольна група гістидину;
• тіоэфірна група метіоніну;
• гідрофобні групи аліфатичних амінокислот і ароматичне кільце фенілаланіну.
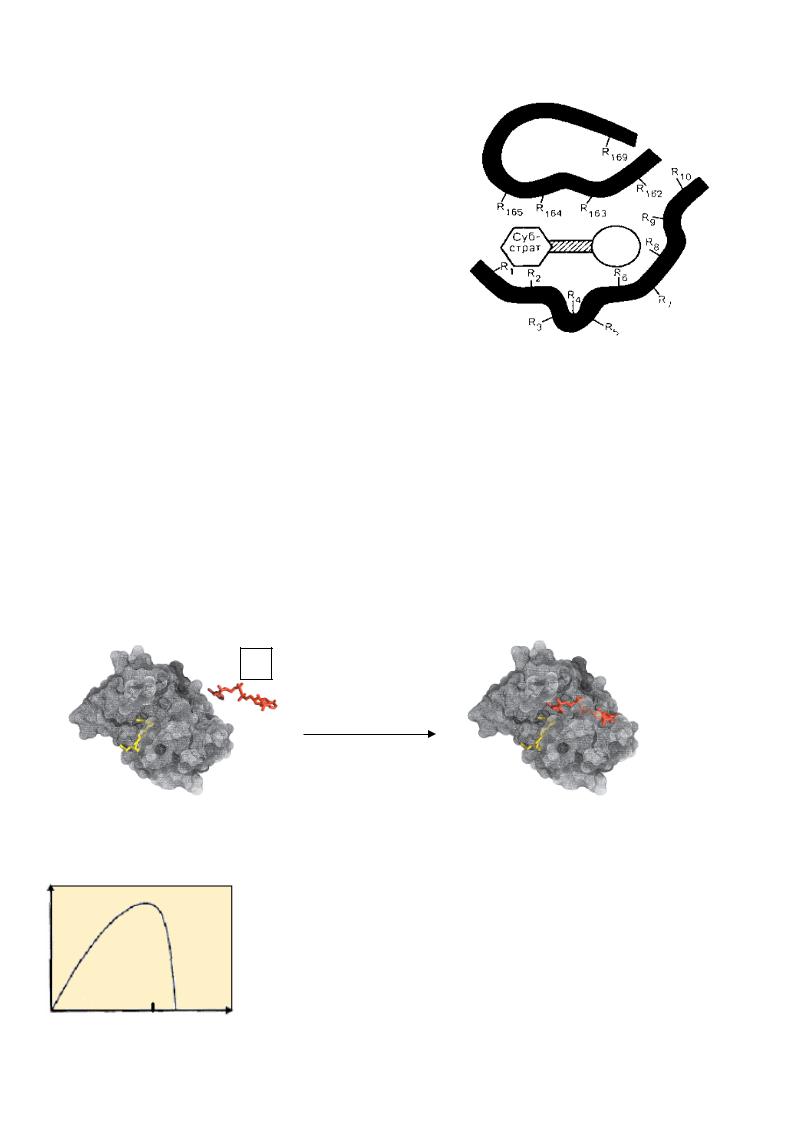
Якщо білок складний, то до складу активного центравходить його небілкова частина. В активному центрі розрізняють:
•контактну (якірну) ділянку - для спізнавання та зв’язування субстрата , т обто необхідну для утворення фермент -субстратного комплексу.
• каталітичну ділянку – для безпосередньої хімічної взаємодії |
ізсубстратом. |
|||
Перша модель активного центр у, |
запропонована Е.Фішером, тракт увала вза ємодію |
|||
ферменту із субстратом як “ключ - замок”, тобто жорстку матрицю. Але у |
молекулі |
|||
білку-ферменту жорсткі ділянки |
чергуються із гнучкими, тому кращою є |
теорія |
||
індукованої відповідності, |
котра була пізніше запропонована |
Д.Кошландом. Ця |
||
теорія припускає гнучкість |
катал ітичного центр у. Субстрат |
індукує конформац ійні |
||
зміни активного центр у фермент у, |
прибудовуючи його до |
себе. Фермент , у свою |
||
чергу, також може спричинити перебудову субстрату до себе.
S
|
|
|
|
|
ES |
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Властивості ферментів |
|
|
||
|
|
|
|
|
|||
1. Залежність активності ферменту від температури |
(термолабільність) |
||||||
v |
У певному обмеженому інтервалі швидкість реакції зростає |
||||||
|
|
|
|||||
|
|
|
при підвищенні температур и, |
т ому що |
збільшується |
||
|
|
|
кінетична енергія молекул . При оптимальн ій |
температур і |
|||
|
|
|
(40◦С) |
швидкість ферментативно ї |
реакц ії є |
||
|
|
|
максимальною. При подальшому підвищенні температур и |
||||
40 |
t° відбувається денатурація ферменту, та реакція зупиняється. |
||||||
|
|
|
|
|
|
|
7 |
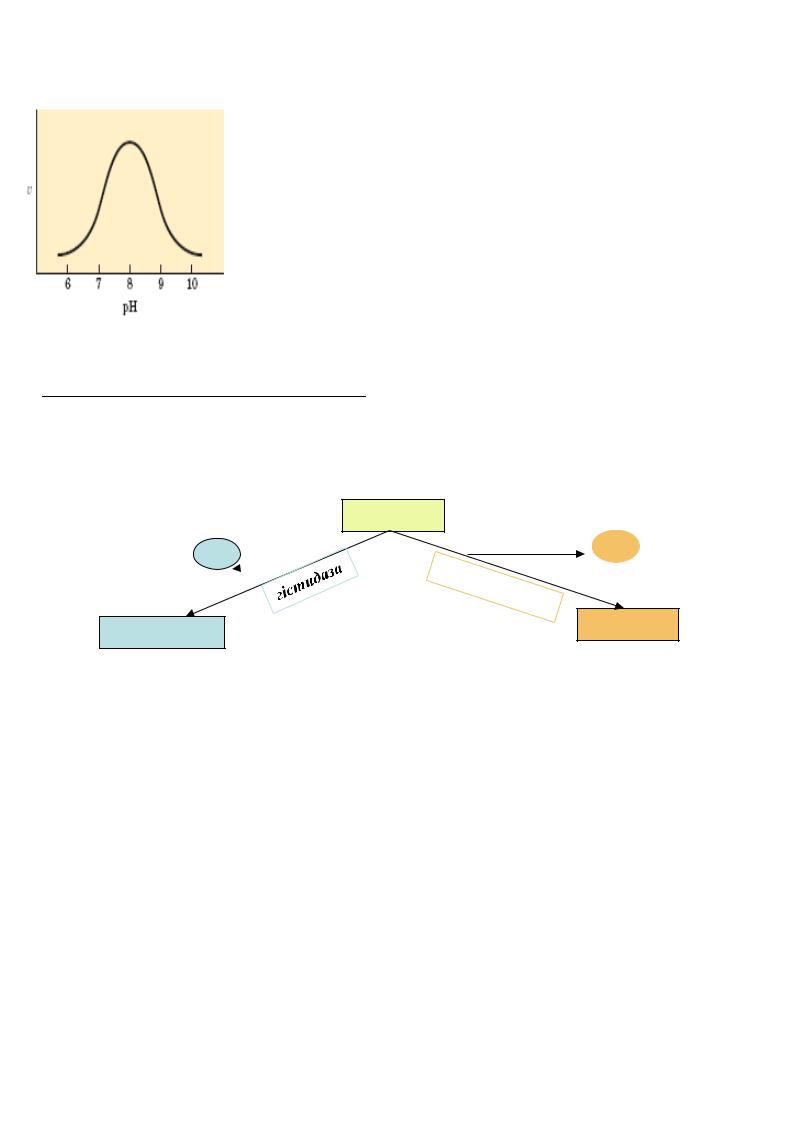
2. Вплив рH середовища на швидкість ферментативної реакції
Ця залежність визначаєтьсянаступними чинниками: -денатурацією ферментів при дуже високих або дуже низьких значеннях рH середовища реакції;
- зміною величин зарядів субстратів або ферментів.
В активном у центрі ферментів є груп и, здатні до іонізації, тому зміна рH середовища реакції призводить до зміни ступіню іонізації функціональних груп, що може спричинити конформаційні зміни у ферментах і, таким чином, змінити його активність.
3. Специфічність дії ферментів
А . Специфічність шляху перетворення. Функціональні групи активного центру здатні хімічно перетворювати субстрат у визначений , а не в будь-який, продукт. Наприклад ,
один і той же самий субстрат (амінокислота гістидин ) може перетворюватися у різні продукти (кетокислоту або амін) в за лежності від того, який діє фермент (гістидаза
або декарбоксилаза):
NН3
кетокислота
гістидин
СО2
декарбоксилаза
гістамін
В .Субстратна специфічність - здатність ферментів зв’язуватися із визначеними субстратами завдяки унікальній структур і активн их центрів, компліментарних саме до цих субстратів.
Розрізняють наступнівиди субстратної специфічності:
1. Абсолютна специфічність - здатність ферменту каталізувати перетворення лише одного субстрату. Наприклад, аргіназа розщепляю тільки аргінін.
2. Відносна |
специфічність - здатність ферментів каталізувати однотипн і |
перетворення групи субстратів, подібних за структурою. Наприклад, ліпаза каталізує
ліполіз (гідроліз ліпідів), пепсин - протеоліз (гідроліз білків). |
|
|
3.Стереоспецифічність - здатність |
ферменту діяти тільки на |
один якийсь із |
стереоізомерів. Наприклад, оксидаза |
D-амінокислот не може д |
іяти на їхні |
стереоізомери L-амінокислоти. |
|
|
8
|
Ізоферменти |
|
Множинні форм и фермент ів – це група ферментн их б ілків, |
які відрізняються між |
|
собою |
фізико-хімічними властивостями , с порідненістю до |
субстрату , але вони |
каталізують одну й ту ж саму реакцію.
Серед множинних форм фермент ів в иділяють ізоферменти, у кот рих фізико-хімічні
відмінності мають |
генетич не походження. Вміст окремих ізоферментів у різних |
клітинах і навіть |
органах неод наковий, що дозволяє використовувати визначення |
іхньої активності для диференціальної діагностики вражень різних органів і тканин .
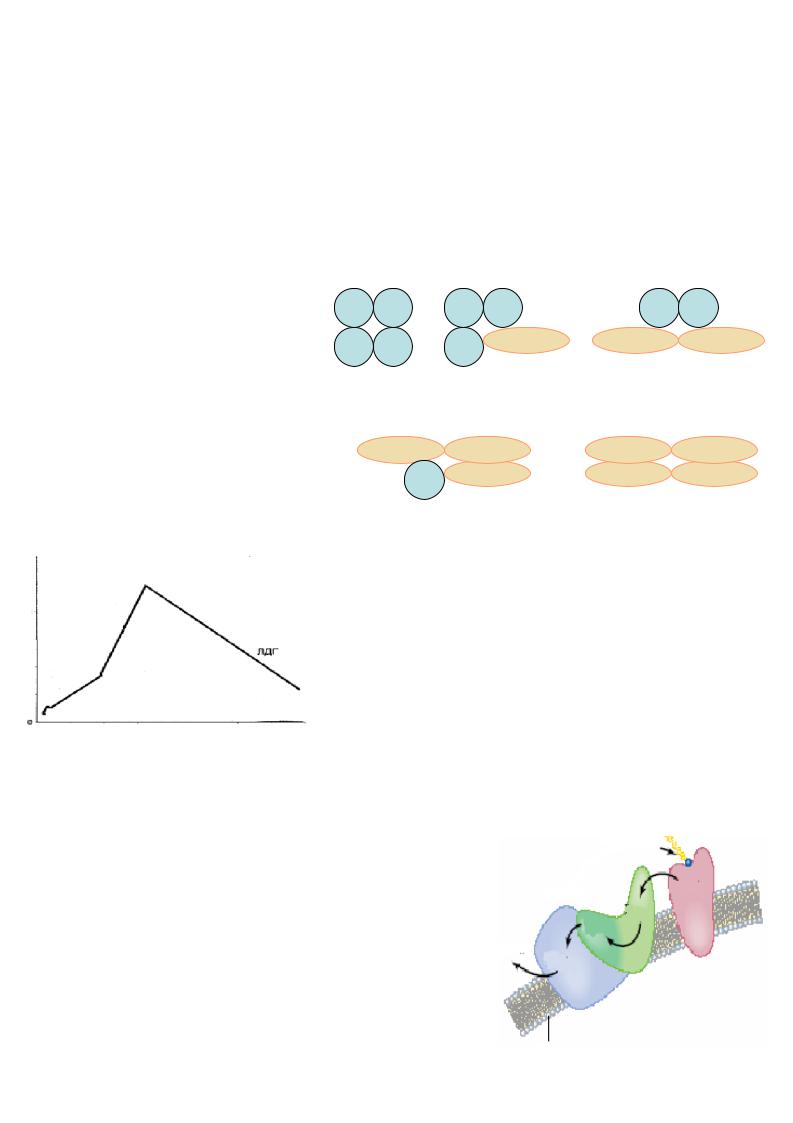
Наприклад, |
|
|
|
лактатдегідрогеназа |
(ЛДГ), |
||
|
|
|
|
складний фермент |
із |
||
четвертинною структуро |
ю, |
||
складається з чотирьох |
|
|
|
субодиниць двох типів: |
|
|
|
Н і М. Комбінація цих |
|||
субодиниць |
( поліпептидних |
||
ланцюгів) да |
є |
п’ять |
|
ізоферментних форм ферменту.
|
|
|
|
|
2 |
4 |
6 |
8 |
|
Доба після інфаркту
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
М |
М |
М |
|
ЛДГ3 |
||||
ЛДГ1 |
ЛДГ2 |
||||
|
М |
М |
М |
М |
|
|
Н |
М |
М |
М |
|
|
ЛДГ4 |
|
ЛДГ5 |
||
Ці ізоферменти характеризуються |
неоднаковою |
||||
швидкістю руху |
в |
електричному полі , |
тому для |
||
їхнього розділення використовується електрофорез. Ферменти органоспециф ічні, т обто локал ізовані у різних органах : ЛДГ1 – переважно у серцевомум’язі, ЛДГ5 – у скелетних м’язах. У кров і їхній вміст у нормі мінімальний . При деструкції органа (інфаркті міокарда ) конце нтрація ЛДГ1 у кров і суттєво підвищується.
Такі ферменти або їхні ізоферментні форм и називаються індикаторними.
Поліферментні системи |
|
|
|
|
|
|
|
• Це надмолекулярні комплекс и, |
до складу яких |
|
|
S |
|
||
входять різноманітні |
фермент и, |
котрі послідовно |
|
матрикс |
|
|
|
каталізують різні стад ії будь-якого метаболічного |
|
|
Е1 |
||||
процесу. Ці систем и |
працюють подібно конве єру: |
|
|
Е2 |
|||
продукт пер шої реакц ії є субстратом для |
другого |
|
Е3 |
||||
ферменту і так далі , |
що призводить до |
виграшу у |
P |
|
|
||
відстані та часі . Часто так і ферментн і |
ансамблі |
Е4 |
|
|
|||
структурно пов’язані з будь-якою органелою клітини |
|
|
|
||||
або мембраною. Приклади поліферментних систем :
піруватдегідрогеназний комплекс , син тетаза в ищих
жирних кислот. |
мембрана |
9 |
|

Загальні закономірності каталізу
•Різниця між вільною енергією вихідних речовин і продукт ів реакц ії визначає ймовірність перебігу цієї реакції.
•Якщо вона вище у вихідних речовин , то можливий самовільний перебіг реакції (екзергонічна реакція), якщо навпаки , - реакція стає енергетично неможливою (ендергонічна реакція).
•Швидкість екзергонічних реакцій залежить від енергетичного бар ’єру, тобто енергії активації . Це та додаткова кількість енергії , наприклад ,
нагрівання, котру необхідно передати молекулам реагуючих речовин, щоб вони вступили в хімічну реакцію.
Каталізатор (фермент ) не в пливає на вільну енергію вихідних речовин і
продуктів, але він впливає на енергетичний проф іль, т обто у присутності каталізатора реакція перебігає через низький енергетичний бар’єр.
•Таким чином, ферменти зменшують енергію активац ії реакц ії, в
результаті чого швидкість ферментативної реакції суттєво підвищується на відміну від неферментативної реакції.
неферментативна
реакція
енергія активаціі неферментативної реакціі
енергія активаціі ферментативної реакціі
ферментативна
реакція
10
