
- •Гетерогенный катализ
- •1) Растворы кипят при более высокой температуре чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре чем чистый растворитель.
- •1) Растворы кипят при более высокой температуре чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре чем чистый растворитель.
- •1) Растворы кипят при более высокой температуре чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре чем чистый растворитель.
- •Ионное произведение воды
- •Вывод значения ионного произведения воды
- •Практическое значение ионного произведения воды
- •Ионные произведения других растворителей
- •Водородный показатель
- •Ионные произведения других растворителей
- •Водородный показатель
- •Общая характеристика физико-химических методов
- •Потенциометрический метод.
.com/id446425943com/club152685050 vk . vk
Ответы смотри ниже
Вопросы к экзамену
1.Основные понятия и законы химии: атом, молекула, изотоп, моль, молекулярная и молярная массы. Законы: сохранения массы и Авогадро.
2.Строение атома. Порядок заполнения электронами энергетических уровней: принцип Паули, правило Хунда, принцип наименьшей энергии.
3.Квантовая теория строения атома. Характер движения электрона в околоядерном пространстве. Понятие "орбиталь электрона". Квантовые числа, их физический смысл. Электронное облако.
4.Порядок заполнения электронами энергетических уровней и подуровней. Принцип Паули, правило Хунда. Нормальное и возбужденное состояние атома.
5.Атомы с многоэлектронными оболочками. Принцип Паули. Правило Гунда. Принцип наименьшей энергии. Проиллюстрировать примерами электронных оболочек атомов К, Mn, Fe.
6.Характеристика электрона четырьмя квантовыми числами.
7.Основное и возбужденное состояние атомов. Рассмотреть на примерах I, Al, Sb, N.
8.Периодические и непериодические свойства химических элементов. Потенциал ионизации, сродство к электрону, электроотрицительность. Изменение этих свойств по периодам и группам периодической системы.
9.Формулировка периодического закона Д.И.Менделеева. построение периодической системы химических элементов с точки зрения строения атома: периоды, группы, подгруппы. лантаноиды и актиноиды.
10.s-, p-, d-, f- элементы. Строение электронных оболочек атомов, положение в периодической системе, свойства.
11.Донорно-акцепторная связь, механизм ее образования. Образование комплексных соединений по методу валентных связей.
12.Метод валентных связей, основные положения. Гибридизация орбиталей, типы гибридизации орбиталей. σ, π, δ- связи.
13.Теория образования химической связи по Льюису. Общая электронная пара. Типы химической связи.
14.Метод молекулярных орбиталей. Связывающие и разрыхляющие МО. Построение методом МО простейших молекул:Н2+, H2, Не2+ , Не2
15.Ионная связь. Механизм образования ионной связи и значение величины электроотрицательности элементов, образующих ионную связь. Строение вещества с ионной связью в конденсированном состоянии.
vk.com/id446425943
vk.com/club152685050
16.Термохимия. Термохимические уравнения. Закон Гесса. Следствие из закона Гесса.
17.Закон Гесса и следствия из него. Стандартные энтальпии образования простых и сложных веществ.
18.Энергетика химических реакций. Энергия Гиббса. Направленность протекания химических реакций при разных знаках энтальпийной и энтропийной составляющих.
19.Стандартные энтальпии соединений. Тепловой эффект химичекой реакции, его расчет. Закон Гесса.
20.Энтропия системы. Стремление системы к переходу в состояние с максимальным беспорядком. Изменение энтропии при переходе: газ- жидкость-кристалл; при расширении и сжатии системы; при повышении
или понижении tº.
21.Энергия Гиббса. Направление химических реакций. Основное уравнение термодинамики
22.Энергетика химических реакций. Энергия Гиббса. Направленность протекания химических реакций при разных знаках энтальпийной и энтропийной составляющих.
23.Скорость химической реакции. Скорость реакции в гомогенной и в гетерогенной среде. Факторы, от которых зависит скорость химической реакции
24.Химическая кинетика. Факторы, влияющие на скорость реакции: концентрация реагирующих веществ, давление. Закон действия масс.
23.Химическая кинетика. Влияние температуры на скорость химических реакций. Энергия активации. Активированный комплекс. Уравнение Аррениуса.
24.Химическое и фазовое равновесие. Константа равновесия.
25.Константа химического равновесия. Сдвиг химического равновесия на примере реакции синтеза аммиака. Принцип Ле-Шателье.
25.Влияние температуры на скорость химической реакции. Температурный коэффициент Ван-Гоффа. Распределение молекул по энергии в зависимости от температуры. Энергия активации.
29.Активные молекулы, их роль в протекании химической реакции. Энергия активации реакции. Уравнение Аррениуса.
30.Катализ гомогенный и гетерогенный. Механизм действия катализатора. Закономерности гомогенного катализа.
31.Необратимые и обратимые химические реакции. Обратимые реакции. Константа равновесия. Зависимость скорости химической реакции от
концентрации реагирующих веществ. Связь между величиной ΔGº |
|
|
vk. |
реакции и величиной Кравн реакции. |
vk. com/id446425943 |
|
com/club152685050 |
32.Состояние химического равновесия. Принцип Ле-Шателье. Смещение химического равновесия при изменении давления, концентрации, температуры.
33.Разбавленные растворы неэлектролитов. Давление насыщенного пара растворителя над раствором. Закон Рауля.
34.Разбавленные растворы неэлектролитов и их свойства. Осмос. Осмотическое давление. Закон Вант-Гоффа.
35.Растворы. Процесс растворения веществ. Гидратная теория растворов Д.И.Менделеева. Термодинамика растворения.
36.Разбавленные растворы неэлектролитов. Закон Рауля. Эбулиоскопическая и криоскопическая константы.
37.Теория электролитической диссоциации. Диссоциация слабых электролитов. Ступенчатая диссоциация. Константа и степень диссоциации. Закон разбавления Оствальда.
38.Электролитическая диссоциация. Теория Аррениуса. Роль растворителя в процессе электролитической диссоциации. Сильные и слабые электролиты. Степень электролитической диссоциации.
39.Электролитическая диссоциация. Степень диссоциации. Константа диссоциации. Привести примеры диссоциации двух слабых электролитов.
40.Электролитическая диссоциация. Свойства растворов электролитов. Применимость законов Вант-Гоффа и Рауля к растворам электролитов.
41.Диссоциация воды. Константа диссоциации. Ионное произведение воды. Водородный и гидроксильный показатели.
42.Ионное произведение воды. Водородный показатель.
43.Гидролиз растворимых солей. Три случая гидролиза. Гидролиз солей, образованных слабыми поликислотами или слабыми полиоснованиями.
44.Равновесие на границе поверхности раздела: металл-раствор. Двойной электрический слой. Электродный потенциал.
45.Электрохимические процессы. Электродный потенциал. Ряд стандартных электродных потенциалов металлов. Уравнение Нернста.
46.Электрохимия. Механизм возникновения скачка потенциала на границе раздела фаз: металл/раствор соли металла. Ряд напряжений.
vk.com/id446425943
vk.com/club152685050

vk.com/id446425943 |
|
vk.com/club152685050 |
Ответы |
|
1.
Молекула - мельчайшая частица вещества, сохраняющая св-ва данного
АТОМ (от греч. atomos — неделимый), мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны, образующие электронные оболочки, размеры которых (~10-8 см) определяют размеры атома. Ядро атома состоит из протонов и нейтронов. Число электронов в атоме равно числу протонов в ядре (заряд всех электронов атома равен заряду ядра), число протонов равно порядковому номеру элемента в периодической системе. Атомы могут присоединять или отдавать электроны, становясь отрицательно или положительно заряженными ионами. Химические свойства атомов определяются в основном числом электронов во внешней оболочке; соединяясь химически, атомы образуют молекулы. Важная характеристика атома — его внутренняя энергия, которая может принимать лишь определенные (дискретные) значения, соответствующие устойчивым состояниям атома, и изменяется только скачкообразно путем квантового перехода. Поглощая определенную порцию энергии, атом переходит в возбужденное состояние (на более высокий уровень энергии). Из возбужденного состояния атом, испуская фотон, может перейти в состояние с меньшей энергией (на более низкий уровень энергии). Уровень, соответствующий минимальной энергии атома, называется основным, остальные — возбужденными. Квантовые переходы обусловливают атомные спектры поглощения и испускания, индивидуальные для атомов всех химических элементов.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Моль - кол-во вещества в граммах, численно равное атомной или молекулярной массе.
Молекулярная масса - это масса одной молекулы вещества, выраженная в атомных единицах массы. Например, Мг (Н20) = 18 а. е. м. Это значит, что одна молекула воды в 18 раз тяжелее атомной единицы массы (1,67• 10-27 кг). Если определим абсолютное значение массы одной молекулы воды (1,67 • 10-27 ' 18), то это будет все равно очень малая величина, пользоваться которой невозможно.
Молярная масса - это масса одного моля вещества, то есть числа Авогадро молекул (6,02 • 1023). Молярная масса воды только численно равна молекулярной М (Н20) = 18 г/ моль. Но
com/id446425943 .com/club152685050 vk . vk
Использование этого ряда для определения направления реакции окисления-восстановления.
47.Стандартный водородный электрод. Его применение. Измерение электродных потенциалов металлических электродов.
48.Электродный потенциал. Ряд напряжений. Уравнение Нернста.
49.Гальванический элемент. Реакции, протекающие при работе гальванического элемента. Примеры.
50.Коррозия металлов. Коррозия химическая и электрохимическая. Механизм протекания электрохимической коррозии. Коррозия с выделением водорода и восстановлением кислорода.
51.Методы защиты коррозии: защитные покрытия, электрозащита, применение ингибиторов коррозии.
52.Комплексные соединения. Внешняя и внутренняя сферы. Комплексный ион. Ион-комплексообразователь, лиганды (моно и полидентальные) координационные числа. Конфигурация комплексного иона в зависимости от величины координационного числа.
53.Химическая идентификация. Качественный анализ на примере анализа природной воды.
54.Химические и физико-химические методы анализа. Общая характеристика химических методов анализа. Аналитический сигнал.
55.Физико-химический анализ. Электрохимические методы анализа. Назвать и объяснить на чем они основаны.
vk.com/id446425943
vk.com/club152685050
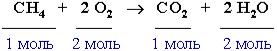
имеет совсем иной смысл: один моль молекул воды (то есть 6,02 • 1023 молекул) весит 18 г.
Закон сохранения массы.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения массы является частным случаем общего закона природы – закона сохранения материи и энергии. На основании этого закона химические реакции можно отобразить с помощью химических уравнений, используя химические формулы веществ и стехиометрические коэффициенты, отражающие относительные количества (число молей) участвующих в реакции веществ.
Например, реакция горения метана записывается следующим образом:
Закон Авогадро
Следствия закона
Первое следствие из закона Авогадро: один мольлюбого газа при одинаковых условиях занимает одинаковый объём.
В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения МенделееваКлапейрона:
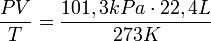 .
.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
vk.com/id446425943
vk.com/club152685050
2.
Строение атома
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спиновогоквантового числа электронов данного подслоя должен быть максимальным. Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют
двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Правило Хунда: электроны располагаются на одинаковых орбиталях, таким образом, чтобы суммарное спиновое число их было максимальным, т.е. наиболее устойчивому состоянию атома соответствует максимально возможное число неспареных электронов с одинаковыми спинами.
vk.com/id446425943
vk.com/club152685050
Согласно этому принципу электроны заполняют орбитали в порядке повышения уровня энергии орбиталей. В первую очередь заполняются орбитали с наименьшей энергий, т.к. на такой орбитали состояние электрона наиболее стабильно. Возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке:
1s ˂ 2s ˂ 2p ˂ 3s ˂ 3p ˂ 4s ˂ 3d ˂ 4p ˂ 5s ˂ 4d ˂ 5p ˂ 6s ˂ 4f ≈
3.
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля:
λ = h / mv,
где m — масса электрона.
2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности служит соотношение
∆x∙m∙∆v > ћ/2,
где ∆х — неопределенность положения координаты, ∆v — погрешность измерения скорости.
3.Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
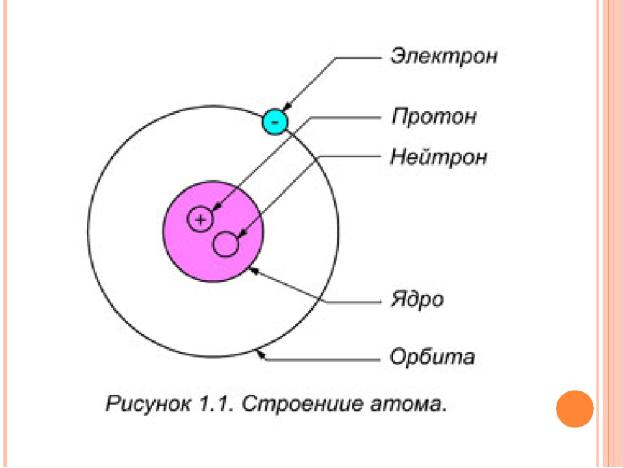
4.Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
vk.com/id446425943
vk.com/club152685050

Движение электрона в атоме носит вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n), форму (l) и ориентацию (ml) атомной обитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму.
Атомная орбиталь — одноэлектронная волновая функция в сферически симметричном электрическом полеатомного ядра,
задающаяся главным n, орбитальным l и магнитным m квантовыми числами.
I. Главное квантовое число(совпадает с номером периода): n=1, 2, 3, 4, …,  Характеризует: 1) номер энергетического уровня, равный номеру периода
Характеризует: 1) номер энергетического уровня, равный номеру периода
2)энергию электрона на уровне
3)радиус ядра, т.е. степень удаления от ядра: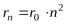
4)максимальное число электронов на энергетическом уровне: N = 2n2 II. Орбитальное квантовое число: ln=0, 1, 2, 3, …, n-1
Характеризует: 1) энергию электрона на подуровне
2)форму электронной орбитали: l=0, то s-орбиталь; l=1, то p-орбиталь; l=2, то d-орбиталь; l=3, то f-орбиталь
III. Магнитное квантовое число: m = –1, 0, 1
Характеризует: 1) энергию электрона в энергетическом состоянии
2)ориентацию электронной орбитали в пространстве
3)проекцию орбитального момента на направление поля IV. Спиновое квантовое число: ms = ½, – ½
Орбитальное и магнитное квантовые числа зависят от значения главного квантового числа.
В атоме не может существовать двух электронов, у которых все 4 квантовых числа одинаковые.
Электронное облако-это место обитания электронов вокруг ядра атома, а 1s и 2sотличаются тем, что 1s это первый уровень. на нем может быть 1 или два электрона, а
vk.com/id446425943
vk.com/club152685050
2s-это второй уровень на нем меньше двух и больше 2 электронов быть не может! Электронные облака - орбитали s-орбиталь Единственный электрон атома водорода образует вокруг ядра сферическую орбиталь - шарообразное электронное облако. (самая устойчивая и располагается довольно близко к ядру). Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания и наконец превращается в гантелеобразную p-орбиталь: p-
орбиталь Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. d-орбитали Кроме s- и p-орбиталей, существуют электронные орбитали еще более сложной формы; их обозначают буквами d и f. Попадающие сюда электроны приобретают еще больший запас энергии, двигаются по сложным путям. Все d-орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только четыре. Движение электрона в атоме описывается волновой функцией. Эта функция
приобретает разные значения в разных точках атомного пространства. Если ядро простейшего атома водорода поместить в центре системы декартовых координат, то электрон можно описать функцией у (х, y, z). Поскольку движение электрона - это волновой процесс, то определение волновой функции сводится к нахождению амплитуды волны.
4.
Порядок заполнения орбиталей электронами. Принцип минимума энергии. Принцип Паули. Правило Хунда. Правило Клечковского. Распределение электронов в атоме происходит по принципу Паули, который может быть сформулирован для атома в простейшем виде: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых
чисел: n, l,Z (n, l, , ) = 0 или 1, где Z (n, l, , ) - число электронов, находящихся в квантовом состоянии, описываемых набором четырех квантовых чисел: n, l, , . Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме различаются значениями, по крайней мере, одного квантового числа.
Правило Хунда - в пределах подуровня электроны распределяются по орбиталям таким образом, чтобы модуль суммы их спиновых квантовых чисел был максимальным. Правило Клечковского: Заполнение орбиталей происходит в порядке увеличения суммы квантовых чисел n+l; при постоянной сумме n+l заполнение происходит в порядке возрастания n. Применение правила Клечковского дает последовательность возрастания энергии орбиталей. Принцип
vk.com/id446425943
vk.com/club152685050
наименьшей энергии: электроны в первую очередь заполняют свободные орбитали с наименьшей энергией.
Квантовое состояние с наименьшей энергией атома называется нормальным, или основным; остальные квантовые состояния с бóльшими уровнями энергии называются возбужденными. Электрон в нормальном состоянии связан с ядром наиболее прочно.
Ввозбужденном состоянии атома связь электрона с ядром ослабевает (вплоть до отрыва электрона от атома).
Внормальном состоянии атом может существовать неограниченное время, в возбужденном же состоянии – ничтожные доли секунды (~10−8 с).
Возбуждение атома происходит при нагревании, электроразряде, поглощении света и т.д., и в любом случае атом поглощает лишь определенные порции – кванты энергии.
Возможные энергетические состояния атомов элементов можно наглядно представить с помощью графических формул. Обычно учитывают только валентные электроны, так как именно они обусловливают химические свойства и возможные превращения атомов элементов.
5.
В многоэлектронном атоме на электрон действует не только сила притяжения со стороны положительного заряженного ядра, но и отталкивание со стороны других электронов. Электроны внутренних электронных уровней атома ослабляют притяжение внешнего электрона ядром – экранируют внешний электрон от ядра. Это экранирование оказывается различным для электронов с разной формой электронного облака. Поэтому в многоэлектронных атомах энергия электрона зависит не только от главного квантового числа, но и от орбитального квантового числа, которое определяет форму электронной орбитали.
Распределение электронов в атоме по уровням и орбиталям происходит в соответствии с принципами Паули, Хунда, наименьших энергий
Принцип (запрет) Паули гласит: в атоме не может быть двух электронов, имеющих одинаковые значения всех четырех квантовых чисел. Отсюда следует, что на каждой орбитали может быть не более двух электронов, причем они должны иметь антипараллельные спины. Т.е. допускается заполнение орбитали следующим образом ; такие варианты , не допускаются.
В соответствии с этим правилом заполнение орбиталей данного подуровня происходит таким образом, чтобы достигалось максимальное значение суммарного спинового числа (∑ms). Заполнение электронами р-подуровня (либо любого другого) происходит таким образом, что каждый из них занимает отдельную орбиталь и только когда все орбитали содержат по одному электрону, начинается их «заселение» вторыми электронами.
Согласно этому принципу электроны заполняют орбитали в порядке повышения уровня энергии орбиталей. В первую очередь заполняются орбитали с наименьшей энергий, т.к. на такой орбитали состояние электрона наиболее стабильно. Возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке:
1s ˂ 2s ˂ 2p ˂ 3s ˂ 3p ˂ 4s ˂ 3d ˂ 4p ˂ 5s ˂ 4d ˂ 5p ˂ 6s ˂ 4f ≈
vk.com/id446425943
vk.com/club152685050

≈ 5d ˂ 6p ˂ 7s ˂ 5f ≈ 6d ˂ 7p.
При заполнении электронных уровней необходимо учитывать правило В.М. Клечковского: последовательное заполнение электронами подуровней происходит в
порядке увеличения суммы главного и побочного квантовых чисел 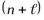 . При одинаковом значении этой суммы для нескольких подуровней, в первую очередь заполняется тот, главное квантовое число которого меньше.
. При одинаковом значении этой суммы для нескольких подуровней, в первую очередь заполняется тот, главное квантовое число которого меньше.
6.
Основная характеристика, определяющая движение электрона в поле ядра,— это его энергия. Энергия электрона, как и энергия частицы светового потока — фотона, принимает не любые, а лишь определенные дискретные, прерывные или, как говорят, квантующиеся значения.
Движущийся электрон обладает тремя степенями свободы перемещения в пространстве (соответственно трем координатным осям) и одной дополнительной степенью свободы, обусловленной наличием у электрона собственного механического и магнитного моментов, которые учитывают вращение электрона вокруг своей оси. Следовательно, для полной энергетической характеристики состояния электрона в атоме необходимо и достаточно иметь четыре параметра. Эти параметры получили название квантовых чисел. Квантовые числа, так же как и энергия электрона, могут приникать не все, а лишь определенные значения. Соседние значения квантовых чисел различаются на единицу.
7. Квантовое состояние с наименьшей энергией атома называется нормальным, или основным; остальные квантовые состояния с бóльшими уровнями энергии называются возбужденными. Электрон в нормальном состоянии связан с ядром наиболее прочно.
Ввозбужденном состоянии атома связь электрона с ядром ослабевает (вплоть до отрыва электрона от атома).
Внормальном состоянии атом может существовать неограниченное время, в возбужденном же состоянии – ничтожные доли секунды (~10−8 с).
Al - …3s2 3p1, *Al - 3s13p2; Р …3s2 3p3, Р* - 3s13p3 3d1.
Sb1s22s22p63s23p63d104s24p64d105s25p3
8.
АТОМНЫЕ РАДИУСЫ (ОБЪЕМЫ).
Орбитальный радиус свободного атома – это расстояние от центра атома до главного максимума плотности внешнего электронного слоя. Он характеризует атом в основном
vk.com/id446425943
vk.com/club152685050
состоянии и определяется с помощью метода рентгеноструктурного анализа. С помощью этого метода определяют графически положение максимума функции радиального распределения (Ф.Р.Р) – F2(r), которая характеризует вероятность нахождения электрона на некотором расстоянии от ядра (см. рис.)
За эффективный (ковалентный) радиус принимают половину межъядерного расстояния в ковалентной гомоядерной (молекула простого вещества) двухатомной молекуле (т.е. половина длины связи). Например: длина связи в молекуле F2, установленная методами рентгеноструктурного анализа и электронографии, основанной на изучении дифракции электронов, равна 1,28 нм. Следовательно эффективный радиус равен 0,64 нм. Следует отметить, что для твердых металлов атомные радиуса всегда больше длины связи: длина связи в молекуле Li2 равна 1,52 нм, а радиус атома лития 1.22 нм.
Значения атомных радиусов элементов находятся в периодической зависимости от атомного номера элемента. В периоде при движении слева направо наблюдается уменьшение атомных радиусов, т.к. увеличивается притяжение
электронов к ядру, несмотря на силы отталкивания между электронами, количество которых увеличивается. При движении группах сверху вниз имеет место увеличение атомных радиусов из-за увеличения числа электронных слоев атома. Радиусы катионов меньше, а радиусы анионов больше, чем радиусы атомов.
ПОТЕНЦИАЛ ИОНИЗАЦИИ (П.И.).
П.И. – это энергия, затраченная в вакууме на удаление электрона из атома на бесконечно большое расстояние. Ме = Меn+ + е + I . (+) соответствует затрате энергии извне – система энергию получает.
Измеряется в электрон-вольтах или кДж. 1 эВ = 1.6 10-19Дж. Например: IСа= 6,11 эВ. Чем меньше потенциал ионизации, тем легче электрон оторвать от атома. Легче всего удалить
первый электрон, затем второй и т.д., поэтому I1 I2 I3. Фактически, П.И. – это мера степени металлических свойств элемента. Чем меньше П.И., тем сильнее выражены металлические свойства атома.
В группе придвижении сверху вниз (с увеличением порядкового номера)
наблюдается уменьшение П.И., что связано с увеличением атомных радиусов, большим расстоянием до ядра и. соответственно, меньшим притяжением к ядру. В периоде с увеличением порядкового номера – в основном, постепенное увеличение П.И., связанное с ростом заряда ядра и, соответственно с большим притяжением электронов к ядру. Однако есть исключения, связанные с особенностями электронной структуры атомов. Например, у атомов элементов 2 периода зависимость следующая (см рис).
Причины в следующем:
-П.И.(В) П.И.(Ве), т.к. электронная структура 2s2 (Ве) более устойчива, чем бора (2s22р1).
-П.И. (О) П.И (N), поскольку электронная структура 2р3 (азота) более устойчива, чем
2р4 (кислорода).
У d и f-элементов, имеющих близкие свойства, вследствие эффекта экранирования (уменьшение воздействия на данный электрон положительного заряда ядра из-за наличия между ним и ядром других электронов)и различной глубины проникновения электронов к
vk.com/id446425943
vk.com/club152685050

ядру (электрон может находиться в любой точке атомного пространства), потенциал ионизации меняется незначительно.
СРОДСТВО к ЭЛЕКТРОНУ (Е).
Сродство к электрону – энергия, которая выделяется в результате присоединения электрона к атому: Э + е = Эn+ - Е. Экспериментально определить величину Е очень сложно, и надежно измерено сродство к электрону далеко не для всех атомов.: Е (О) = 1,47эВ; Е (Н) = 0,75 эВ. Сродство к электрону у атомов элементов тоже изменяется периодически. Наибольшим сродством к электрону обладают р-элементы VII группы, т.к. они приобретают конфигурацию s2р6 – инертных газов. Наименьшим и даже отрицательным – атомы с конфигурацией s2р6 (инертные газы), т.е. они фактически отталкивают электрон от атома. Водород может не только терять электрон, но и приобретать. Но сродства к электрону водорода в 20 раз меньше, чем потенциал ионизации. Поэтому, в основном атом водорода образует положительно заряженные ионы Н+, а не Н-.
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (ЭО)
ЭО – это обобщенная характеристика элемента, связанная с внешними электронами; характеризует способность атома, находящегося в соединении, притягивать (удерживать) электроны. Р.Малликен показал, что количественно ЭО характеризуется полусуммой потенциала ионизации и сродства к электрону: ЭО= I +E/2. Но поскольку экспериментально определить сродство к электрону практическфи невозможно, то Л.Полинг (лауреат Нобелевской премии 1932г.) ввел понятие относительной ЭО (ОЭО). По этой шкале ОЭО атома фтора (самого «электороотрицательного» элемента П.С.) была принята за 4,0; ОЭО лития – за 1,0. Из этих значений рассчитаны ОЭО остальных элементов.
Строго говоря, элементу нельзя приписать постоянную ЭО, т.к. она зависит от типа химической связи в соединении и его окружения. Л.Полинг рассчитывал разность абсолютных электроотрицательностей элементов, сравнивая энергии связи в молекуле АВ
с энергиями связи в исходных молекулах А2 и В2, используя формулу: ЭО = 0,208 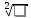 ЕАВ- (ЕААЕВВ)1/2, где Е - энергии связи в молекулах АВ, А2 и В2.
ЕАВ- (ЕААЕВВ)1/2, где Е - энергии связи в молекулах АВ, А2 и В2.
9.
Формулировка периодического закона, данная Д.И. Менделеевым, гласила: свойства химических элементов находятся в периодической зависимости от атомных масс этих элементов.
Периодическая система химических элементов - естественная классификация химических элементов, являющаяся табличным выражением периодического закона Д.И. Менделеева. Прообразом Периодической системы химических элементов послужила таблица, составленная Д.И. Менделеевым 1 марта 1869 г.. В 1870 г. Менделеев назвал систему естественной, а в 1871 г. - периодической.
vk.com/id446425943
vk.com/club152685050
Число элементов в современной Периодической системе почти вдвое больше, чем было известно 60-х годах XIX в. (на сегодняшний день - 113), однако ее структура со времен Менделеева почти не изменилась. Хотя за всю историю Периодической системы было опубликовано более 50 различных вариантов ее изображения, наиболее популярными являются предложенные Менделеевым короткопериодная и длиннопериодная формы. Главный принцип построения Периодической системы - выделение в ней периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов. Современная Периодическая система состоит из 7 периодов (седьмой период должен закончиться 118-м элементом). Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы - 18 групп, имеющих те же обозначения, что и в короткопериодном. Элементы одной группы имеют одинаковое строение внешних электронных оболочек атомов и проявляют определенное химическое сходство.
Номер группы в Периодической системе определяет число валентных электронов а атомах элементов. При этом в группах, обозначенных буквой А, содержатся элементы, в которых идет заселениеs- и р-подуровней - s-элементы (IA- и IIA-группы) и р-элементы (IIIA- VIIIA-группы), а в группах, обозначенной буквой Б, находятся элементы, в которых заселяются d-подуровни - d-элементы. Поскольку в каждом большом периоде должно находиться по 10 d-элементов (у которых заполняются пять d-орбиталей), то Периодическая система должна содержать 10 соответствующих групп. Однако традиционно используется нумерация групп лишь до восьми, поэтому число групп d- элементов расширяется за счет введения дополнительных цифр - это IБ-VIIБ, VIIIБ0, VIIIБ1 и VIIIБ2-группы. Для f-элементов номеров групп не предусмотрено. Обычно их условно помещают в ячейки Периодической системы, отвечающие лантану (лантаноиды) и актинию (актиноиды). Символы лантаноидов и актиноидов выносятся за пределы Периодической системы в виде отдельных рядов.
Номер периода в Периодической системе соответствует числу энергетических уровней атома данного элемента, заполненных электронами.
Номер периода = Число энергетических уровней, заполненных электронами = Обозначение последнего энергетического уровня Порядок формирования периодов связан с постепенным заселением энергетических
подуровней электронами. Последовательность заселения определяется принципом минимума энергии, принципом Паули и правилом Гунда.
vk.com/id446425943
vk.com/club152685050
Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома.
10.
s p d f–элементы– элементы, у которых происходит заполнение соответствующих подуровней
Вхарактере изменения свойств элементов по периоду проявляется внутренняя периодичность, а по группе — вторичная периодичность
Вхарактере изменения свойств s- и р-элементов в подгруппах отчетливо наблюдается вторичная периодичность Для её объяснения привлекается представление о проникновении электронов к ядруэлектрон любой орбитали определенное время находится в области, близкой к ядру. Иными словами, внешние электроны проникают к ядру через слои внутренних электронов. Как видно из рисунка 9, внешний 3s-электрон атома натрия обладает весьма значительной вероятностью находиться вблизи ядра в области внутренних К- и L-электронных слоев.
Концентрация электронной плотности (степень проникновения электронов) при одном и том же главном квантовом числе наибольшая для s-электрона, меньше — для р-электрона, ещё меньше — для d-электрона и т. д. Например, при n = 3 степень проникновения убывает в последовательности 3s>3p>3d
Во внешнем слое у атомов d-элементов (за исключением Pd) находятся 1—2 электрона (ns-состояние). Остальные валентные электроны расположены в (n—1)d-состоянии, т. е. в предвнешнем слое.
Вподгруппах d-элементов значения энергии ионизации атомов в общем увеличиваются. Это можно объяснить эффектом проникновения электронов к ядру. Так, если у d- элементов 4-го периода внешние 4s-электроны проникают под экран 3d-электронов, то у элементов 6-го периода внешние 6s-электроны проникают уже под двойной экран 5d- и 4f- электронов.
Вподгруппах d-элементов радиусы атомов в общем увеличиваются. Важно отметить следующую особенность: увеличение атомных и ионных радиусов в подгруппах d- элементов в основном отвечает переходу от элемента 4-го к элементу 5-го периода. Соответствующие же радиусы атомов d-элементов 5-го и 6-го периодов данной подгруппы примерно одинаковы. Это объясняется тем, что увеличение радиусов за счет возрастания числа электронных слоев при переходе от 5-го к 6-му периоду компенсируется f-сжатием, вызванным заполнением электронами 4f-подслоя у f-элементов 6-го периода. В этом случае f-сжатие называется лантаноидным. При аналогичных электронных конфигурациях внешних слоев и примерно одинаковых размерах атомов и ионов для d-элементов 5-го и 6-го периодов данной подгруппы характерна особая близость свойств.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
vk.com/id446425943
vk.com/club152685050
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями – квáнтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем – высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N – максимальное число электронов на уровне, n – номер уровня.
Тогда для первого уровня N = 2 · 12= 2,
для второго N = 2 · 22= 8 и т.д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
11.
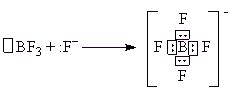
Донорно-акцепторный механизм связан с передачей неподеленной пары электронов от одного атома на вакантную атомную орбиталь другого атома. Например, образование иона [BF4]-:
Вакантная р-АО в атоме бора в молекуле BF3 акцептирует пару электронов от фторидиона (донор). В образовавшемся анионе четыре ковалентные связи В-F равноценны по длине и энергии. В исходной молекуле все три связи В-F образовались по обменному механизму.
Атомы, внешняя оболочка которых состоит только из s- или р-электронов, могут быть либо донорами, либо акцепторами неподеленной пары электронов. Атомы, у которых валентные электроны находятся и на d-АО, могут одновременно выступать и в роли доноров, и в роли акцепторов. Чтобы различить эти два механизма ввели понятия дативного механизма образования связи.
В водных растворах комплексные соединения подвергаются диссоциации
[Cr(H2O)6]Cl3 = [Cr(H2O)6]3+ + Cl-
Наряду с этим комплексный ион так же подвергается распаду на составные части
[Cr(H2O)6]3+ = Сr3+ + 6H2O
Так как в этой системе наступает состояние динамического равновесия, то к нейприменим закон действующих масс:
vk.com/id446425943
vk.com/club152685050
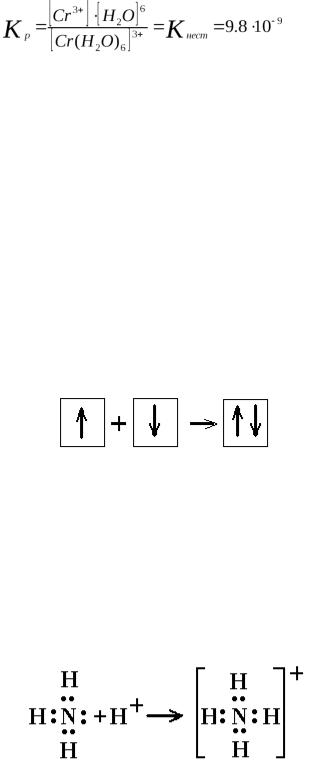
Чем меньше значение константы нестойкости, тем прочнее комплекс.
Величина обратная константе нестойкости, называется константой устойчивости. Для большинства комплексов этих параметры определены и отображены в химических справочниках.
12.
1. Ковалентную химическую связь образуют два электрона с противоположными спинами, принадлежащие двум атомам. Например, при сближении двух атомов водорода происходит частичное перекрывание их электронных орбиталей и образуется общая пара электронов
H+H = HH
или
Ковалентная связь может быть образована и по донорно-акцепторному механизму. Механизм образования ковалентной связи за счёт электронной пары одного атома (донора) и другого атома (акцептора), предоставляющего для этой пары свободную орбиталь, называется донорно-акцепторным.
Рассмотрим в качестве примера механизм образования иона аммония NH4+. В молекуле NH3 три поделённые электронные пары образуют три связи N H, четвёртая пара внешних электронов является неподелённой, она может дать связь с ионом водорода, в результате получается ион аммония NH4+:
Таким образом, ион NH4+ имеет четыре ковалентных связи, причем все четыре связи NH равноценны, то есть электронная плотность равномерно распределена между ними.
2. При образовании ковалентной химической связи происходит перекрывание волновых функций электронов (электронных орбиталей), при этом связь будет тем прочнее, чем больше это перекрывание.
3. Ковалентная химическая связь располагается в том направлении, в котором возможность перекрывания волновых функций электронов, образующих связь будет наибольшей.
vk.com/id446425943
vk.com/club152685050
4. Валентность атома в нормальном (невозбужденном) состоянии определяется:
oчислом неспаренных электронов, участвующих в образовании общих электронных пар с электронами других атомов;
oналичием донорной способности (за счёт одной неподелённой электронной пары).
В возбужденном состоянии валентность атома определяется:
oчислом неспаренных электронов;
oчислом вакантных орбиталей, способных акцептировать электронные пары доноров.
Таким образом, валентность выражается небольшими целыми числами и не имеет знака. Мерой валентности является число химических связей, которыми данный атом соединён с другими.
К валентным относятся прежде всего электроны внешних уровней, но для элементов побочных подгрупп к ним относятся и электроны предпоследних (предвнешних) уровней.
В зависимости от направления перекрывания электронных облаков образуются s-, p- и δ-связи.
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется s-связью.Сигма-связь может возникать при перекрывании двух s-орбиталей s- и p-орбиталей, p-орбиталей между собой, d- орбиталей, а также d- и s-орбиталей, d- и p-орбиталей, а также перекрыванием гибридных орбиталей с другими видами орбиталей и между собой. Сигма-связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью.
s-s |
p-p |
p-s |
spn-s |
|
spn-spn |
|
d-spn |
|
Связь, образованная перекрыванием негибридных р- и d-АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью. Пи-связь может образовываться при перекрывании р-р-орбиталей, р-d – орбиталей, d-d- орбиталей а также f-p-, f-d- и f-f-орбиталей.
Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется δ-связью
vk.com/id446425943
vk.com/club152685050
Соответственно, s-элементы могут образовывать только σ-связи, p-элементы – σ- и π- связи, d-элементы σ-, π-, и δ-связи, а f-элементы – σ-, π-, δ- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у π- и δ-связей ниже, чем у σ-связей.
13.
В том же 1916 году американский физико-химик Дж. Льюис высказал предположение, что химическая связь возникает в результате образования электронной пары, одновременно принадлежащей двум атомам. Эта идея послужила исходным
пунктом для разработки современной теории ковалентной связи.
Процесс спаривания электронов при образовании молекулы водорода может быть изображён следующей схемой:
Общая электронная пара обозначается черточкой: Н – Н.
Общая электронная пара принадлежит обоим атомам, поэтому каждый атом водорода в молекуле Н2 имеет завершенную электронную структуру IS2.
Квантово-механическая теория электронного строения атомов объясняется образованием общей электронной пары как перекрывание электронных облаков.
Ионная связь.
Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий(Na), калий(K), кальций (Ca), стронций(Sr), барий(Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия(NaOH) и сульфате натрия(Na2 SO4 ) ионные связи существуют только между атомами натрия и кислорода (остальные связи – ковалентные полярные).
Ковалентная неполярная связь.
При взаимодействии атомов с одинаковой электроотрица-тельностью образуются молекулы с ковалентной неполярной связью. Такая связь существует в молекулах следующих простых веществ: H2 , F2 , Cl2 , O2 , N2 . Химические связи в этих газах образованы посредством общих электронных пар, т.е. при перекрывании
vk.com/id446425943
vk.com/club152685050
соответствующих электронных облаков, обусловленном электронно-ядерным взаимодействием, которые осуществляет при сближении атомов.
Составляя электронные формулы веществ, следует помнить, что каждая общая электронная пара – это условное изображение повышенной электронной плотности, возникающей в результате перекрывания соответствующих электронных облаков.
Ковалентная полярная связь.
При взаимодействии атомов, значение электроотрецательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому. Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония и амония.
Металлическая связь.
Связь, которая образуется в результате взаимодействия относите-льно свободных электронов с ионами металлов, называются металлической связью. Этот тип связи характерен для простых веществметаллов.
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свобо-дные электроны, оторвавшиеся от атома, перемещаются между положи-тельными ионами металлов. Между ними возникает металлическая связь, т. е. Электроны как бы цементируют положительные ионы кристаллической решетки металлов.
Водородная связь.
Связь, которая образуется между атомов водорода одной молекулы и атомом сильно электроотрицательного элемента (O, N, F) другой молекулы, называется водородной связью.
Может возникнуть вопрос: почему именно водород образует такую специфическую химическую связь?
Это объясняется тем, что атомный радиус водорода очень мал. Кроме того, при смещении или полной отдаче своего единственного электрона водород приобретает сравнительно высокий положительный заряд, за счет которого водород одной молекулы взаимодействует с атомами электроотрицательных элементов, имеющих частичный отрицательный заряд, выходящий в состав других молекул (HF, H2 O, NH3 ).
14.
Метод МО позволяет описывать важнейшие свойства молекулярных систем:
1.Принципиальную возможность образования молекулярных систем.
2.Насыщаемость химической связи и состав молекул.
3.Энергетическую устойчивость молекул и (соответствующих молекулярных ионов) прочность химической связи.
4.Распределение электронной плотности и полярность химических связей.
vk.com/id446425943
vk.com/club152685050
5. Донорно-акцепторные свойства молекулярных систем.
При образовании молекулярной (1sA+1sB)-орбитали две атомные орбитали находятся в положительной (конструктивной) интерференции, т.е. взаимодействие их происходит в фазе. Занимающий эту орбиталь электрон связывает два ядра в единую систему, но в тесный контакт друг с другом ядра войти не могут. Это обусловлено двумя причинами. Во-первых, при очень малых межъядерных расстояниях электрону просто не хватает места, чтобы находиться между ядрами, и его связывающий эффект уменьшается. Во-вторых, при уменьшении расстояния возрастает отталкивание ядер, которое в конце концов должно превысить связывающее действие электрона. Для любого расстояния между ядрами можно вычислить общую энергию молекулы; полученная зависимость носит название кривой потенциальной энергии молекулы . На кривой имеется минимум («яма»), соответствующий стабильному состоянию молекулы с межъядерным расстоянием Rравн, которое носит название равновесной длины связи (или просто длины связи; в ионе Н2+. Rравн=1.06 Å). (1sA+1sB)-Орбиталь является связывающей молекулярной орбиталью в соответствии с определением: молекулярная орбиталь называется связывающей, если заселение ее электронами приводит к понижению общей энергии молекулы.
Другую МО иона Н2+., которая является следующим точным решением уравнения Шредингера, можно смоделировать, комбинируя орбитали 1sA и 1sB в противофазе .Эта комбинация записывается как 1sA-1sB, что совершенно эквивалентно записи 1sВ-1sА, так как выбор знака волновых функций произволен. В этом случае в области перекрывания наблюдается отрицательная (деструктивная) интерференция двух АО, вследствие чего электрон, занимающий 1sA-1sB-орбиталь, не занимает места между ядрами. Вероятность распределения электрона дается выражением
(1sA-1sB)2d =(1sA)2d +(1sB)2d - 2(1sA)(1sB)d .
Принципиальное отличие между этой орбиталью и орбиталью связывающей состоит в том, что третий член в приведенной формуле отрицателен, т.е. электронная плотность в межъядерной области уменьшается .В плоскости, проходящей через середину связи, где орбитали 1sA и 1sB имеют равные амплитуды, отрицательная интерференция максимально полная, и поэтому в орбитали возникает узел. Электрон, занимающий (1sA-1sB)-орбиталь, стремится «растолкнуть» ядра. Частично это обусловлено тем, что его почти нет в межъядерной области, и он находится в основном снаружи атомов, а поэтому стремится растянуть связь, чтобы находиться и с внутренней стороны атомов. Вследствие этого (1sA- 1sB)-орбиталь является антисвязывающей (другое название - разрыхляющая).
Молекулярная орбиталь называется антисвязывающей (разрыхляющей), если заселение ее электронами приводит к повышению общей энергии молекулы.
vk.com/id446425943
vk.com/club152685050
Молекула H2 имеет два электрона на связывающей ls-МО и конфигурация основного состояния этой молекулы ( ls)2. Два электрона образуют простую связь,
причем распределение электронной плотности в молекуле симметрично относительно центра межъядерного расстояния. Такая связь называется ковалентной. Энергия диссоциации Н2 равна 4,75 эВ, равновесное расстояние 0,74 А.
Молекула Не2 с конфигурацией ( ls)2( *ls)2 имеет два связывающих и два разрыхляющих электрона, которые в сумме формально не дают связи. Действительно, молекула Не2 неустойчива (равновесное расстояние 1,587 А) и не наблюдалась в основном состоянии. В то же время, если один из электронов возбудить с ( *ls) МО на связывающую орбиталь, например 2s, то в молекуле He2 окажется три связывающих и один разрыхляющий электрон. Возбужденные состояния Не2 стабильны и спектроскопически наблюдались. Ион молекулы гелия Не2+ устойчив, его энергия диссоциации 3 эВ и равновесное расстояние 1,08 А близки аналогичным характеристикам Н2. Для стабильной молекулы Н2 электронная плотность возрастает в межъядерном пространстве, для неустойчивой молекулы Не2 межъядерное пространство характеризуется пониженной электронной плотностью.
Н2+, что вызывает трудности в методе валентных связей. На σ-связывающую молекулярную орбиталь катиона Н2+переходит один электрон атома H с выигрышем энергии. Образуется устойчивое соединение с энергией связи 255кДж/моль. Кратность связи равна ½. Молекулярный ион парамагнитен. Молекула обычного водорода содержит уже два электрона с противоположными спинами на σcв1s-орбитали: Энергия
связи в Н2больше, чем вH2+ - 435 кДж/моль. В молекуле Н2имеется одинарная связь, молекула диамагнитна.
- 435 кДж/моль. В молекуле Н2имеется одинарная связь, молекула диамагнитна.
15.
Ионная связь –возникает между разноимённо заряженными частицами – ионами в результате действия электростатических сил притяжения.
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Взаимодействие между катионами и анионами не зависит от направления, поэтому оионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Вот почему ионная связь является ненасыщенной. Число
vk.com/id446425943
vk.com/club152685050
взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому "молекулой" ионного соединения следует считать весь кристалл.
Для возникновения ионной связи необходимо, чтобы сумма значений энергии ионизации Ei (для образования катиона) и сродства к электрону Ae (для образования аниона) должна быть энергетически выгодной. Это ограничивает образование ионной связи атомами активных металлов (элементы IA- и IIA-групп, некоторые элементы IIIAгруппы и некоторые переходные элементы) и активных неметаллов (галогены, халькогены, азот).
Идеальной ионной связи практически не существует. Даже в тех соединениях, которые обычно относят к ионным, не происходит полного перехода электронов от одного атома к другому; электроны частично остаются в общем пользовании. Так, связь во фториде лития на 80% ионная, а на 20% - ковалентная. Поэтому правильнее говорить о степени ионности (полярности) ковалентной химической связи. Считают, что при разности электроотрицательностей элементов 2,1 связь является на 50% ионной. При большей разности соединение можно считать ионным.
Ионной моделью химической связи широко пользуются для описания свойств многих веществ, в первую очередь, соединений щелочных и щелочноземельных металлов с неметаллами. Это обусловлено простотой описания таких соединений: считают, что они построены из несжимаемых заряженных сфер, отвечающих катионам и анионам. При этом ионы стремятся расположиться таким образом, чтобы силы притяжения между ними были максимальными, а силы отталкивания - минимальными.
16.
Термохимия оперирует термохимическими уравнениями. В них указывают тепловой эффект, агрегатные состояния веществ и допускаются дробные коэффициенты.
С термохимическими уравнениями можно оперировать, как и с алгебраическими уравнениями.
Термохимические расчеты
Закон Гесса:
Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции.
Закон лежит в основе термохимических расчетов.
ледствия закона Гесса:
1 следствие
vk.com/id446425943
vk.com/club152685050
Тепловой эффект химической реакции равен разности между суммами теплот (энтальпий) образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов в уравнении.
Тепловой эффект реакции:
bB + dD =lL + mM
рассчитывается по уравнению
ΔН1 = lΔfHL + mΔfHM – dΔfHD - bΔfHB
Для термохимических расчетов используют стандартные энтальпии образования веществ fH0 – это изменение энтальпии в процессе образования 1 моля соединения в стандартном состоянии из простых веществ, тоже находящихся в стандартном состоянии в устойчивых формах и модификациях.
Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях, условно принимаются равными нулю.
Стандартные энтальпии образования веществ приведены в справочниках термодинамических величин и известны примерно для 8000 тысяч веществ, что позволяет расчетным путем установить тепловой эффект любого процесса.
2 следствие
Важно для реакций, протекающих с участием органических веществ.
Тепловой эффект реакции равен разности между суммами теплот (энтальпий) сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
Теплота (энтальпия) сгорания – это тепловой эффект сгорания 1 моль органического вещества до СО2 и Н2О. Остальные продукты определяются конкретно для каждого случая.
17.
Закон Гесса:
Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции.
Закон лежит в основе термохимических расчетов.
ледствия закона Гесса:
1 следствие
Тепловой эффект химической реакции равен разности между суммами теплот (энтальпий) образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов в уравнении.
vk.com/id446425943
vk.com/club152685050
Тепловой эффект реакции:
bB + dD =lL + mM
рассчитывается по уравнению
ΔН1 = lΔfHL + mΔfHM – dΔfHD - bΔfHB
Для термохимических расчетов используют стандартные энтальпии образования веществ fH0 – это изменение энтальпии в процессе образования 1 моля соединения в стандартном состоянии из простых веществ, тоже находящихся в стандартном состоянии в устойчивых формах и модификациях.
Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях, условно принимаются равными нулю.
Стандартные энтальпии образования веществ приведены в справочниках термодинамических величин и известны примерно для 8000 тысяч веществ, что позволяет расчетным путем установить тепловой эффект любого процесса.
2 следствие
Важно для реакций, протекающих с участием органических веществ.
Тепловой эффект реакции равен разности между суммами теплот (энтальпий) сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
Теплота (энтальпия) сгорания – это тепловой эффект сгорания 1 моль органического вещества до СО2 и Н2О. Остальные продукты определяются конкретно для каждого случая.
Стандартная энтальпия образования простых и сложных веществ
Стандартная энтальпия образования простых веществ в их наиболее термодинамически устойчивом агрегатном и аллотропном состоянии при стандартных условиях принимается равной нулю.
Стандартная энтальпия образования сложного вещества равна энтальпии реакции получения 1 моль этого вещества из простых веществ при стандартных условиях.
18.
Энергетика химических процессов – часть химической термодинамики (часть общей термодинамики).
Энергетическое состояние химической реакции как системы описывается с использованием следующих характеристик: U-внутренняя энергия, H-энтальпия, S- энтропия, G-энергия Гиббса.
Теплота, которую получает система, идет на приращение внутренней энергии и совершение работы: Q= U+A. Если система не совершает никакой работы, кроме работы
vk.com/id446425943
vk.com/club152685050

расширения, то Q= U+p V. Величина H= U+p V при p=const называется энтальпией реакции. Т.к. внутреннюю энергию тела измерить невозможно (можно измерить только изменение U), то точно так же невозможно измерить энтальпию тела – в расчетах используется изменение энтальпии H.
Стандартной энтальпией образования называется изобарный тепловой эффект реакции получения одного моля сложного вещества из простых веществ, взятых в их наиболее устойчивой форме при стандартных условиях (T=298К, p=1 атм., С=1 моль/л). Энтальпия образования простых веществ в их устойчивом состоянии при стандартных условиях принимается равной 0
Энергия Гиббса и направление протекания реакции
В химических процессах одновременно действуют два противоположных
фактора — энтропийный (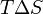 ) иэнтальпийный (
) иэнтальпийный (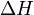 ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменениеэнергии Гиббса (
). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменениеэнергии Гиббса ( ):
):
Из этого выражения следует, что 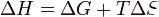 , то есть некотороеколичество теплоты расходуется на увеличение энтропии (
, то есть некотороеколичество теплоты расходуется на увеличение энтропии (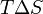 ), эта часть энергии рассеивается в окружающую среду в виде тепла, её часто называютсвязанной энергией. Другая часть теплоты (
), эта часть энергии рассеивается в окружающую среду в виде тепла, её часто называютсвязанной энергией. Другая часть теплоты (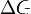 ) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При 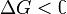 процесс может протекать, при
процесс может протекать, при процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же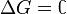 , то система находится в состояниихимического равновесия.
, то система находится в состояниихимического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства 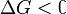 (покинетическим причинам).
(покинетическим причинам).
Существует полезное соотношение, связывающее изменение свободной энергии Гиббса 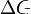 в ходе химической реакции с еёконстантой равновесия
в ходе химической реакции с еёконстантой равновесия 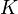 :
:
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
где 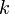 —константа скорости прямой реакции,
—константа скорости прямой реакции, 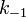 — константа скорости обратной реакции.
— константа скорости обратной реакции.
vk.com/id446425943
vk.com/club152685050
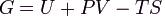
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая
изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
19.
Тепловой эффект химической реакции не зависит от пути проведения реакции, а определяется только н6ачальным и конечным состоянием системы при следующих условиях:
1)процесс осуществляется при V = const или p = const;
2)температура исходного и конечного состояний системы одинакова (однако это не означает, что она должна быть постоянной в течение всего процесса);
3)единственным видом работы является работа расширения (сжатия).
Если не выполняется хотя бы одно из условий, закон Гесса не работает.
Действие закона Гесса удобно представить в виде схемы. Рассмотрим некоторый обобщенный химический процесс превращения исходных веществ в продукты реакции, который может быть осуществлен различными путями в одну или несколько стадий (
Согласно закону Гесса, тепловые эффекты всех этих реакций связаны между собой соотношением:
Н1= Н2+ Н3+ Н4= Н5+ Н6.
Тепловой эффект изобарного процесса часто называют просто энтальпией.
Уравнение реакции с указанием агрегатного состояния реагентов и теплового эффекта реакции называют термохимическим уравнением. Например, термохимическое уравнение реакции образования бензола в жидком состоянии из простых веществ запишется:
6С (т) + 3Н2(г) = С6Н6(ж), Н = 49,03 кДж/моль,
где символы (т), (ж), (г) указывают на агрегатное состояние реагента. Эти символы обычно опускаются, когда агрегатное состояние вещества является очевидным в данных
условиях. Верхний индекс « » у теплового эффекта указывает на то, что все реагенты взяты в стандартном состоянии.
Стандартное состояние – это состояние чистого вещества при давлении 1 атм (101325 Па) и заданной температуре (Т =const). При этом вещества должны быть взяты в том агрегатном состоянии, в котором они являются термодинамически устойчивыми. В справочной литературе приводятся величины, характеризующие вещество в стандартном
vk.com/id446425943
vk.com/club152685050

состоянии, определяемом более узко, а именно р = 1 атм и Т = 298 К. Стандартную
энтальпию реакции, протекающей при температуре Т, обозначают 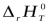 (индексr означает «reaction» – реакция).
(индексr означает «reaction» – реакция).
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать энтальпии тех химических процессов, для которых непосредственное определение
rН связано с большими экспериментальными затруднениями.
20.
Характерной особенностью многих самопроизвольных процессов является то, что их протекание сопровождается уменьшением внутренней энергии или энтальпии системы. Это утверждение справедливо и для большинства химических реакций, которые, как правило, являются экзотермическими, если протекают сами по себе.
Принято, что энтропия чистых веществ, существующих в виде идеальных кристаллов при температуре абсолютного нуля (0оK или –273оС), равна нулю. Это значит, что в данном случае достигается полная упорядоченность системы, в результате чего всякое движение частиц в узлах кристаллической решетки станет невозможным. Таким образом, данное макросостояние системы может быть реализовано только одним определенным расположением структурных единиц друг относительно друга (иначе говоря, лишь одним их микросостоянием).
Принято, что энтропия чистых веществ, существующих в виде идеальных кристаллов при температуре абсолютного нуля (0оK или –273оС), равна нулю. Это значит, что в данном случае достигается полная упорядоченность системы, в результате чего всякое движение частиц в узлах кристаллической решетки станет невозможным. Таким образом, данное макросостояние системы может быть реализовано только одним определенным расположением структурных единиц друг относительно друга (иначе говоря, лишь одним их микросостоянием.
S=k·lgW,
где k – коэффициент пропорциональности, называемый иначе константой Больцмана. Он имеет значение 1,38 · 10–23 Дж/K и рассчитывается по формуле:
,
где R – универсальная газовая постоянная;
NA – число Авогадро.
Однако таким образом определить значение энтропии для термодинамической системы нельзя, т.к. не представляется возможным учесть и сосчитать все ее микроскопические состояния.
vk.com/id446425943
vk.com/club152685050
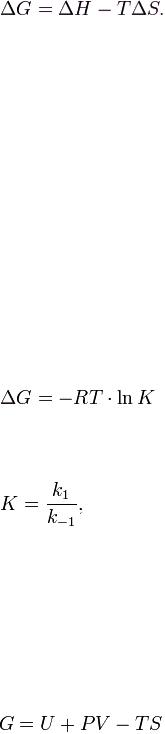
21.
Энергия Гиббса и направление протекания реакции
В химических процессах одновременно действуют два противоположных
фактора — энтропийный ( ) иэнтальпийный (
) иэнтальпийный ( ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменениеэнергии Гиббса (
). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменениеэнергии Гиббса ( ):
):
Из этого выражения следует, что 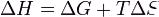 , то есть некотороеколичество теплоты расходуется на увеличение энтропии (
, то есть некотороеколичество теплоты расходуется на увеличение энтропии ( ), эта часть энергии рассеивается в окружающую среду в виде тепла, её часто называютсвязанной энергией. Другая часть теплоты (
), эта часть энергии рассеивается в окружающую среду в виде тепла, её часто называютсвязанной энергией. Другая часть теплоты ( ) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При 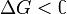 процесс может протекать, при
процесс может протекать, при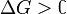 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же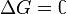 , то система находится в состояниихимического равновесия.
, то система находится в состояниихимического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства 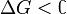 (покинетическим причинам).
(покинетическим причинам).
Существует полезное соотношение, связывающее изменение свободной энергии Гиббса  в ходе химической реакции с еёконстантой равновесия
в ходе химической реакции с еёконстантой равновесия 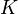 :
:
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
где 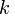 —константа скорости прямой реакции,
—константа скорости прямой реакции, 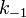 — константа скорости обратной реакции.
— константа скорости обратной реакции.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая
изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
vk.com/id446425943
vk.com/club152685050
22.
Термохимия оперирует термохимическими уравнениями. В них указывают тепловой эффект, агрегатные состояния веществ и допускаются дробные коэффициенты.
С термохимическими уравнениями можно оперировать, как и с алгебраическими уравнениями.
Термохимические расчеты
Закон Гесса:
Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции.
Закон лежит в основе термохимических расчетов.
ледствия закона Гесса:
1 следствие
Тепловой эффект химической реакции равен разности между суммами теплот (энтальпий) образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов в уравнении.
Тепловой эффект реакции:
bB + dD =lL + mM
рассчитывается по уравнению
ΔН1 = lΔfHL + mΔfHM – dΔfHD - bΔfHB
Для термохимических расчетов используют стандартные энтальпии образования веществ fH0 – это изменение энтальпии в процессе образования 1 моля соединения в стандартном состоянии из простых веществ, тоже находящихся в стандартном состоянии в устойчивых формах и модификациях.
Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях, условно принимаются равными нулю.
Стандартные энтальпии образования веществ приведены в справочниках термодинамических величин и известны примерно для 8000 тысяч веществ, что позволяет расчетным путем установить тепловой эффект любого процесса.
2 следствие
Важно для реакций, протекающих с участием органических веществ.
Тепловой эффект реакции равен разности между суммами теплот (энтальпий) сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
vk.com/id446425943
vk.com/club152685050

Теплота (энтальпия) сгорания – это тепловой эффект сгорания 1 моль органического вещества до СО2 и Н2О. Остальные продукты определяются конкретно для каждого случая.
23.
Гомогенной называется химическая система, в которой все вещества находятся в одной фазе (в растворе или в газе). Если фаз несколько, то система называется
гетерогенной.
Соответственно химическая реакция называется гомогенной, если реагенты находятся в одной фазе. Если реагенты находятся в разных фазах, то химическая реакция называется
гетерогенной.
Скоростью химической реакции называется изменение количества вещества в единицу времени в единице объема реагирующей системы (для гомогенной реакции) или на единице площади поверхности (для гетерогенной реакции).
Таким образом, если объем |
системы |
или площадь |
поверхности раздела ф |
не изменяются, то выражения для скоростей химических реакций имеют вид:
|
ν |
C |
|
|
ν |
W |
= |
= |
; |
W |
= |
hom o |
V t |
t |
|
hetero |
S |
|
|
|
Отношение изменения количества вещества к объему системы можно интерпретировать как изменение концентрации данного вещества.
Скорость химических реакций. Факторы, влияющие на скорость химической реакции (зависимость скорости от природы, концентрации вещества, площади поверхности соприкосновения реагирующих веществ, температуры, катализатора).
24.
Химическая кинетика изучает скорость и механизм протекания химических процессов, а так же их зависимость от различных факторов.
Скоростью химических реакций называется изменение концентрации за единицу времени. Т.к. концентрация непрерывно меняется во времени, то и скорость непрерывно меняется во времени.
Факторы, влияющие на скорость реакции:
1.Природа реагирующих веществ. Необходимым, но недостаточным условием осуществления химического взаимодействия между частицами является их столкновение. Взаимодействие происходит лишь в том случае, если частицы приближаются на расстояние, на котором становится возможным перераспределение
vk.com/id446425943
vk.com/club152685050

электронной плотности. Следовательно частица должна обладать некоторой энергией для преодоление энергетического барьера другой частицы, которая называется энергией активации Ea. Для атомов – это энергия отталкивания между электронными облаками, для молекул – энергия разрыва связей. Однако для большинства молекул реакция протекает через образование так называемого активированного комплекса. При обычных условиях достаточно быстро протекают реакции с Ea<100 кДж.
2.Концентрация реагентов. Закон действия масс: скорость гомогенной реакции в каждый момент времени пропорциональна произведению концентрации реагирующих
веществ, возведенных в некоторую степень. V=kCaNaCbNb. В общем случае Na a и Nb b. K зависит от тех же факторов, что и сама скорость. Численные значения k зависят от выбора единиц времени и концентраций. Na и Nи – частные порядки реакций, их сумма называется общим порядком реакции. Порядок реакции может принимать произвольные значения. Порядок реакции совпадает со стехиометрическими коэффициентами, если реакция простая и концентрация первого вещества искуственно поддерживается постоянной.
3.Зависимость от температуры. Скорость большинства реакций с ростом температуры
возрастает, т.к. повышается число активных частиц. Зависимость скорости реакции от температуры приблизительно выражается правилом Ван-Гоффа: скорость реакции при повышении температуры на каждые десять градусов возрастает в 2-4 раза. V2=V1 (T2T1)/10. Более точное выражение дает уравнение Аррениуса: k=Aexp(-Eакт/kT), где k- константа скорости реакции, A=pz, p-стерический фактор, учитывающий ориентацию столкновения, z-общее число столкновений.
Математическим выражением закона термодинамики для равновесия химических процессов (реакций) является закон действующих масс, устанавливающий связь между равновесными концентрациями или парциальными давлениями компонентов реакцииДействующими массами называются:
-парциальные равновесные давления реагентов (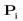 );
);
-равновесные концентрации веществ (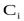 );
);
-числа молей (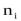 );
);
-мольные доли (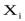 ).
).
ЗДМ при равновесии отношение произведений концентраций конечных продуктов, взятых в степенях, равных их стехиометрическим коэффициентам, к такому же произведению концентраций исходных веществ в обратимой реакции при данной температуре есть величина постоянная, называемая константой равновесия химической реакции (К).
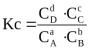 ,
,
где СC, СD, CA, СВ – равновесие концентрации веществ-участников реакции; а, в, с, d – стехиометрические коэффициенты.
vk.com/id446425943
vk.com/club152685050
25.
ПРИНЦИП ЛЕ-ШАТЕЛЬЕ.СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ.
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому. N2 + 3H2 2NH3 + Q
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом;
при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 0С:давление, МПа 0,1 10 20 30 60 100
объемная доля NH3, % 0,4 26 36 46 66 80
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
Условием термодинамического равновесия в закрытой системе является минимальное значение соответствующего термодинамического потенциала:
vk.com/id446425943
vk.com/club152685050
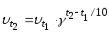
Изобарно-изотермического (P=const, T=const):
∆G=0, dG=0, d2G>0;
Изохорно-изотермического (V=const, T=const):
∆F=0, dF=0, d2F>0.
Учение о равновесных состоянияходин из разделов термодинамики.
Количественной характеристикой химического равновесия является константа равновесия К, которая может быть выражена через равновесные концентрации С или парциальные давления Р реагирующих веществ. Для некоторой реакции:
aA+bB+… mM+nN+…
соответствующие константы равновесия выражаются следующим образом:
Kс=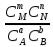
Kp=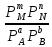
Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры.
Кроме того, константа равновесия есть отношение констант скоростей прямой и обратной реакций. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратимой реакции при данной температуре и концентрациях всех реагирующих веществ, равных 1моль/л.
26.
Я.Г. Вант-Гофф установил, что, как правило, скорость реакции с повышением температуры возрастает. Согласно общепринятому правилу Вант-Гоффа повышение
температуры на 10 градусов приводит к увеличению скорости реакции в 2 - 4, реже более раз. Математическое выражение правила Вант-Гоффа
где υt1 - скорость реакции при t1; υt2 - скорость реакции при t2; γ - температурный коэффициент константы скорости реакции или температурный коэффициент ВантГоффа, принимает значения 2, 3, иногда 4 (не обязательно значения целых чисел) в зависимости от природы реагирующих веществ. Физический смысл температурного коэффициента: показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 градусов.
vk.com/id446425943
vk.com/club152685050
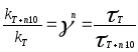
Концентрация вещества с повышением температуры изменяется незначительно, увеличение температуры в основном сказывается на константе скорости. Поэтому она имеет постоянное значение только при постоянной температуре. Влияние температуры на константу скорости оценивается величиной температурного коэффициента константы скорости реакции γ, то есть
где kT и k(T+10) константы скорости при температурах Т и (T + 10) соответственно.
Константу скорости реакции при какой-нибудь температуре (Т +n ∙10) k(T.+n∙10) можно приближенно выразить через kT
kT+n∙10= γn∙kT;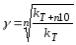
Для небольших интервалов температур γ можно рассматривать как постоянную величину и выражать константу скорости реакции при какой-нибудь температуре. При
этом n может быть как целым, так и дробным числом, то есть интервал между двумя температурами не обязательно должен быть кратным 10, а также положительным или отрицательным. Так как с повышением температуры увеличивается константа скорости, очевидно, время реакции будет обратно пропорционально константе скорости
Это важное соотношение позволяет определить температурный коэффициент ВантГоффа, если известны два значения константы скорости при разных температурах, а, следовательно, и значения констант при других температурах. По этому соотношению можно ориентировочно рассчитать время реакции при заданной температуре, если известно время реакции при любой другой температуре.
Приближенный характер правила Вант-Гоффа объясняется тем, что влияние температуры на скорость реакции зависит от величины энергии активизации Еа данной реакции. Энергия активации (Еа) - это избыточная энергия, которая необходима
частице (атому, молекуле, иону) для преодоления энергетического барьера и превращения в активное состояние. Она равна разнице между средней энергией реагирующих молекул и той энергией, которой они должны обладать, чтобы при их сталкивании произошла химическая реакция. Энергия активации зависит от природы реагирующих веществ. Если энергия активации мала (< 40 кДж/моль), то эти реакции практически протекают мгновенно. Если Еа > 120 кДж/моль, то скорость таких реакций очень мала.
простейшем случае активированный комплекс представляет собою конфигурацию атомов, в которой ослаблены старые связи и образуются новые. Активированный комплекс образуется в ходе прямой и обратной реакций. Энергетически он отличается от исходных веществ на величину Еа прямой реакции, а от конечных – на Еа обратной реакции. Тепловой эффект реакции будет равен разности Еапрямой и обратной реакций.
vk.com/id446425943
vk.com/club152685050
В обычных условиях только часть молекул реагентов обладает достаточной энергией, чтобы преодолеть энергетический барьер активации. При увеличении температуры все большая часть молекул реагентов приобретает достаточную энергию для преодоления энергетического барьера и вследствие этого происходит увеличение скорости реакции.
С. Аррениус показал, что число активных частиц, а следовательно и скорость, и константа скорости возрастают с температурой по экспоненциальному закону. Более строгая зависимость константы скорости от температуры выражается эмпирическим уравнениемАррениуса
k=ko∙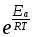
где k - константа скорости реакции; е - основание натуральных логарифмов; Еа - энергия активации; R - универсальная газовая постоянная; Т - температура по шкале Кельвина; ko - предъэкспоненциальный множитель, указывающий долю числа столкновений между молекулами, которая оканчивается реакцией. Это уравнение достаточно хорошо выполняется для простых гомогенных и многих гетерогенных реакций.
С. Аррениус использовал некоторые теоретические представления о механизме реакций, в частности, понятие об энергии активации. Только те столкновения приводят к химическому превращению, когда сталкивающиеся молекулы обладают достаточной энергией для совершения акта химического превращения.
Изобразим графически изменение энергии в ходе химической реакции
А + В ↔ М + N
Уровень I соответствует энергии прямой реакции; уровень II - соответствует энергии обратной реакции. Если прямая реакция (переход состояния I в состояние II) является экзотермической, то общий запас энергии продуктов реакции меньше, чем исходных веществ, то есть система в результате этой реакции переходит на более низкий энергетический уровень (с уровня I на уровень II). Разность уровней I и II равна тепловому эффекту реакции ΔН. Уровень К определяет тот, наименьший запас энергии, которым должны обладать молекулы, чтобы их столкновения могли приводить к химическому взаимодействию. Разность между уровнем К и уровнем I представляет энергию активации прямой реакции (Е*1), а разность между уровнями К и II – энергию активации обратной реакции (Е*2). Таким образом, по пути из исходного состояния в конечное система должна перейти через своего рода энергетический барьер. Только активные молекулы, то есть молекулы, обладающие в момент
столкновения избытком энергии (в нужной форме), могут вступать в соответствующее химическое взаимодействие, то есть перейти через энергетический барьер.
Величина энергии активации Еа характерна для каждой химической реакции. Она колеблется в широких пределах: от 50 до 350 кДж/моль. Чем больше значение Еа, тем медленнее протекает реакция; чем меньше Еа, тем быстрее идёт реакция. Простейший способ ускорить реакцию при больших значениях Еа заключается в повышении температуры.
27.
vk.com/id446425943
vk.com/club152685050
Впростейшем случае активированный комплекс представляет собою конфигурацию атомов, в которой ослаблены старые связи и образуются новые. Активированный комплекс образуется в ходе прямой и обратной реакций. Энергетически он отличается от
исходных веществ на величину Еа прямой реакции, а от конечных – на Еа обратной реакции. Тепловой эффект реакции будет равен разности Еапрямой и обратной реакций.
Вобычных условиях только часть молекул реагентов обладает достаточной энергией, чтобы преодолеть энергетический барьер активации. При увеличении температуры все большая часть молекул реагентов приобретает достаточную энергию для преодоления энергетического барьера и вследствие этого происходит увеличение скорости реакции.
С. Аррениус показал, что число активных частиц, а следовательно и скорость, и константа скорости возрастают с температурой по экспоненциальному закону. Более строгая зависимость константы скорости от температуры выражается эмпирическим уравнениемАррениуса
k=ko∙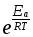
где k - константа скорости реакции; е - основание натуральных логарифмов; Еа - энергия активации; R - универсальная газовая постоянная; Т - температура по шкале Кельвина; ko - предъэкспоненциальный множитель, указывающий долю числа столкновений между молекулами, которая оканчивается реакцией. Это уравнение достаточно хорошо выполняется для простых гомогенных и многих гетерогенных реакций.
С. Аррениус использовал некоторые теоретические представления о механизме реакций, в частности, понятие об энергии активации. Только те столкновения приводят к химическому превращению, когда сталкивающиеся молекулы обладают достаточной энергией для совершения акта химического превращения.
Изобразим графически изменение энергии в ходе химической реакции
А + В ↔ М + N
Уровень I соответствует энергии прямой реакции; уровень II - соответствует энергии обратной реакции. Если прямая реакция (переход состояния I в состояние II) является экзотермической, то общий запас энергии продуктов реакции меньше, чем исходных веществ, то есть система в результате этой реакции переходит на более низкий энергетический уровень (с уровня I на уровень II). Разность уровней I и II равна тепловому эффекту реакции ΔН. Уровень К определяет тот, наименьший запас энергии, которым должны обладать молекулы, чтобы их столкновения могли приводить к химическому взаимодействию. Разность между уровнем К и уровнем I представляет энергию активации прямой реакции (Е*1), а разность между уровнями К и II – энергию активации обратной реакции (Е*2). Таким образом, по пути из исходного состояния в конечное система должна перейти через своего рода энергетический барьер. Только активные молекулы, то есть молекулы, обладающие в момент
столкновения избытком энергии (в нужной форме), могут вступать в соответствующее химическое взаимодействие, то есть перейти через энергетический барьер.
Величина энергии активации Еа характерна для каждой химической реакции. Она колеблется в широких пределах: от 50 до 350 кДж/моль. Чем больше значение Еа, тем медленнее протекает реакция; чем меньше Еа, тем быстрее идёт реакция. Простейший
vk.com/id446425943
vk.com/club152685050
способ ускорить реакцию при больших значениях Еа заключается в повышении температуры.
28.
Гомогенные каталитические реакции широко распространены в природе. Примером промышленных гомогенных каталитических процессов может служить реакция этерификации, омыления сложных эфиров и т. д.
Механизм каталитического действия при гомогенном катализе заключается в образовании между реагирующими соединениями и катализатором промежуточных соединений, которые в некоторых случаях удается даже выделить. Ускорение реакции в большинстве случаев проходит за счет снижения энергии активации. При гомогенном катализе в растворах каталитическое действие могут оказывать ионы водорода, гидроксила, солей, а также веществ, способствующих образованию свободных радикалов.
Катализ под действием ионов водорода или гидроксила называют кислотно – основным. Этот вид катализа наиболее распространен. Сущность его заключается в переходе протона от катализатора к реагирующему веществу (катализ кислотами) или от реагирующего вещества к катализатору (катализ основаниями). В дальнейшем протон перемещается в обратном направлении и катализатор регенерируется.
На скорость гомогенных каталитических реакций влияют многие факторы: активность катализатора, температура, концентрация катализатора, перемешивание. Скорость многих каталитических реакций зависит от концентрации катализатора. При малых значениях Скатвыход продукта Х за данный период времени примерно пропорционален концентрации катализатора, но при дальнейшем повышении Скаткривая переходит в затухающую
Жидкофазные каталитические реакции обычно осуществляют в реакторах с перемешивающими устройствами.
Гетерогенный катализ
Основным недостатком гомогенного катализа является трудность выделения катализатора из конечной реакционной смеси, в результате чего часть катализатора теряется безвозвратно, с продукт загрязняется им. Поэтому значительно большее распространение получил гетерогенный катализ.
По фазовому признаку известны различные виды гетерогенного катализа: жидкие катализаторы, ускоряющие реакции между несмешивающимися жидкостями (или жидкостями и газами) и твердые катализаторы, ускоряющие реакции между жидкостями или газами. Большинство каталитических реакций - это реакции газов с участием твердых катализаторов. Из существующих теорий катализа общим для всех теорий является образование на поверхности твердого катализатора промежуточного соединения адсорбционного типа с участием электронов катализатора.
Катализаторы, как правило, представляют собой пористые твердые тела, имеющие высокоразвитую внутреннюю поверхность. Весь каталитический процесс на твердом пористом катализаторе можно представить в виде пяти самостоятельных стадий:
1.Диффузия реагирующих веществ из потока к поверхности зерна катализатора и внутри пор, имеющихся в зерне.
vk.com/id446425943
vk.com/club152685050
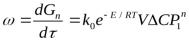
2.Активированная адсорбция (хемосорбция) на поверхности катализатора с образованием промежуточных поверхностных соединений реагент - катализатор.
3.Перегруппировка атомов с образованием промежуточного соединения продукт – катализатор.
4.Десорбция продукта с поверхности катализатора.
5.Диффузия продукта с поверхности катализатора сначала внутри пор, а затем с поверхности зерна в общий поток.
Общая скорость суммарного каталитического процесса лимитируется самой медленной из стадий. Если этой стадией является один из диффузионных этапов, то катализ проходит в диффузионной области. Причем различают внешне- и внутридиффузионные области.
Если медленными являются 2, 3 или 4 стадия, то процесс идет в кинетической области.
Общее уравнение скорости каталитического процесса, протекающего в каталитической области,
,
где 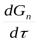 - приращение количества продукта во времени;
- приращение количества продукта во времени;
k0 – предэкспоненциальный множитель в уравнении Аррениуса;
V – насыпной объем катализатора;
е – основной натуральный логарифм;
ΔС – движущая сила процесса при атмосферном давлении;
Р1 – безразмерное давление, т. е. отношение действительного давления к атмосферному;
29.
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном)
Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному
vk.com/id446425943
vk.com/club152685050
наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямаяобратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
30.
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому. N2 + 3H2 2NH3 + Q
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
vk.com/id446425943
vk.com/club152685050
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом;
при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 0С:давление, МПа 0,1 10 20 30 60 100
объемная доля NH3, % 0,4 26 36 46 66 80
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Для достижения химического равновесия при протекании обратимых реакций требуется определенный период времени, зависящей от природы веществ, составляющих реакционную систему. Для характеристики используется величина - скорость химической реакции.
Скорость реакции - это величина, показывающая как изменяется концентрация одного из веществ в единицу времени.
Чтобы ускорить достижение состояния равновесия, требуется увеличить скорость реакции. Основными способами увеличения скорости реакции является повышение температуры, изменение концентрации, введение катализатора.
31.
Если в замкнутый сосуд, из которого предварительно удалили воздух, поместить чистый растворитель, например, воду то в результате естественного процесса испарения над жидкостью образуется пар. Он будет состоять из молекул жидкости, оторвавшихся от ее верхнего слоя в результате своего хаотического теплового движения и перешедших в газовую фазу. На совершение данного процесса необходимо затратить определенное количество энергии, чтобы преодолеть силы притяжения между молекулами жидкой фазы. Эндотермический процесс испарения обратим. По мере накопления молекул в газовой фазе над поверхностью жидкости
vk.com/id446425943
vk.com/club152685050
