
ЛАБОРАТОРНАЯ РАБОТА 1-5
.docЛАБОРАТОРНАЯ РАБОТА 1-5
ОПРЕДЕЛЕНИЕ ГАЗОВОЙ ПОСТОЯННОЙ МЕТОДОМ ОТКАЧКИ.
1. ЦЕЛЬ РАБОТЫ: определение молярной (универсальной) газовой постоянной R.
2. ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ: стеклянная колба с краном, насос Комовского, U-образный открытый манометр, весы с равновесами.
3. МЕТОД ИЗМЕРЕНИЙ: измерение массы воздуха в одном и том же сосуде при различных его давлениях позволяет, используя уравнение состояния идеального газа, вычислить универсальную газовую постоянную.
4. ВВЕДЕНИЕ.
Универсальную газовую постоянную можно определить с помошью уравнения состояния идеального газа:
![]() (1.5.1.)
(1.5.1.)
где P – давление; V – объем; m – масса газа; - масса одного моля этого газа; T – абсолютная температура газа.
Все параметры газа, входящие в уравнение (1.5.1.), можно определить путем прямых измерений, за исключением массы газа, так как взвешивание газа возможно только вместе с сосудом, в котором он заключен. Массу газа можно определить с помощью косвенных измерений. Рассмотрим разные количества m1 и m2 одного и того же газа при одинаковой температуре T и объеме V. Записав дважды уравнение состояния (1.5.1.) для двух значений массы газа и отняв второе равенство от первого, получим следующее выражение для универсальной газовой постоянной:
![]() (1.5.2.)
(1.5.2.)
Следовательно, если определить давление P1 и температуру T для некоторой массы m1, заключенной в сосуде объемом V, а затем изменить массу m1 газа в том же сосуде до величины m2 (например, путем откачки) и вновь определить давление P2 при той же температуре T, то по формуле (1.3.2.) легко рассчитать универсальную газовую постоянную.
Примечание: молярная масса воздуха равна = 29 кг/кмоль.
5.ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА.
Схема установки представлена на рис. 1.
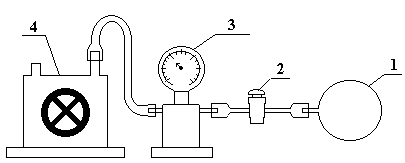
Рис. 1
Установка состоит из стеклянной колбы 1, помещенной в матерчатый мешок, снимать который из-за мер предосторожности нельзя. Колба соединена трубкой с краном 2 через манометр 3 с насосом Комовского 4.
6. ПРОВЕДЕНИЕ ЭКПЕРИМНТА.
6.1. Отсоединить колбу с краном от манометра.
6.2. Взвесить колбу с открытым краном и определить суммарную массу колбы с мешочком и краном (m0) и содержащегося в ней воздуха
(m1) – (m0 + m1).
6.3. Колбу соединить с манометром и при открытом кране откачать воздух до давления P2 (по манометру)500-600 мм рт. ст. При этом манометр показывает давление Pм, равное разности между атмосферным давлением P1 и давлением в колбе P2 (Pм = P1 – P2).
6.4. Закрыть кран, отсоединить колбу от манометра и вновь определить суммарную массу колбы (m0) и содержащегося в ней воздуха (m2), т.е. (m0 + m2).
6.5. Измерить температуру воздуха в лаборатории T.
6.6. Опыты провести i раз.
7.ОБРАБОТКА РЕЗУЛЬТАТОВ.
Все измеренные в опыте величины занести в таблицу 1, вычислить величины по формуле (1.5.2.) Ri, рассчитать, пользуясь таблицей 2, среднее значение универсальной газовой постоянной и доверительный интервал ее погрешностей с вероятностью p = 95%.
Таблица 1
|
№ опыта |
V м |
T K |
Pm Па |
m0+m1 кг |
m0+m2i кг |
m1-m2i кг |
Ri= Дж/кмольК |
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
Таблица 2
|
№ опыта |
Ri
Дж/кмольК |
Дж/кмольК |
Ri-R
Дж/кмольК |
R=
Дж/кмольК |
R=
Дж/кмольК |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
5 |
|
|
|
|
|
8. КОНТРОЛЬНЫЕ ВОПРОСЫ.
8.1. Укажите физический смысл универсальной газовой постоянной.
8.2. Определите основные источники погрешности при измерениях.
8.3. Запишите уравнение состояния для одного моля идеального газа.
9. ЛИТЕРАТУРА.
9.1. Савельев И.В. Курс общей физики. Т.1. Механика. Молекулярная физика. М.: Наука. 1982. – 432 с. §§ 80, 86, 90.
9.2. Сивухин Д.В. Общий курс физики. Т.2. Термодинамика и молекулярная физика. М.: Наука. 1990. – 592 с. §§ 7, 8, 12.

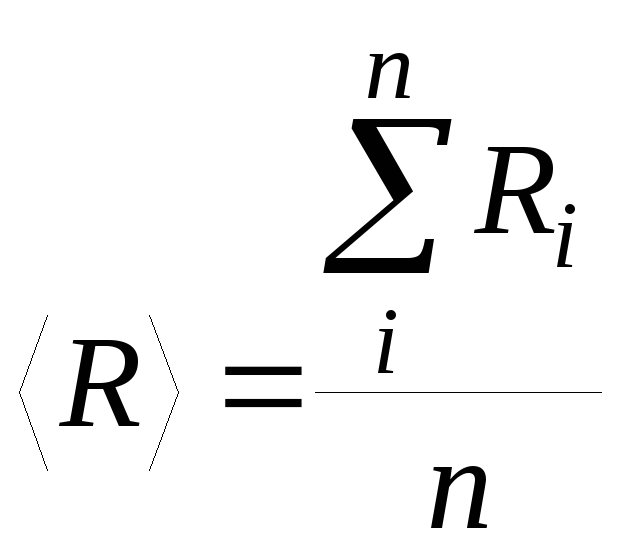
 2,776
2,776