
- •Результирующий механический момент многоэлектронного атома.
- •Эффект Зеемана
- •Электронный парамагнитный резонанс
- •Связь в молекулах.
- •Гибридизация
- •Молекулярные спектры
- •Вращательная энергия молекул
- •Комбинационное рассеяние света.(Эффект Рамона).
- •Поглощение света
- •Нелинейная оптика
- •Физика твёрдого тела
- •Кристаллическая структура твёрдых тел
- •Энергия связи кристаллической решётки.
- •Индексы Миллера
Результирующий механический момент многоэлектронного атома.
Каждый е имеет орбитальный момент импульса Le и основной магнитный момент Ls. Суммируя все моменты, получаем результирующий момент атома Zs зависящий от квантового числа: =L+S; L+S-1; |L-S| (1). L – квантовое число суммарного орбитального момента импульса; S – квантовое число суммарного спинового магнитного момента. Т.к. с орбитальным движением связан орбитальный магнитный момент, и если е обладает собственным магнитным моментом, то можно вычислить результирующий момент, как сумму этих моментов. M, где принимает значения из (1) . Энергия атома зависит от в следствии взаимодействия орбитального и спинового моментов. При этом соответствующий терм атома, энергия которого зависит от : 2s+1L .
Вместо L принято писать L = 0S1P 2D 3F
Эффект Зеемана
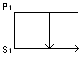
Когда атомы вещества имеют момент <> 0. (если момент = 0, то диамагнетики). Эффект Зеемана возникает лишь в парамагнетиках. Он заключается: в расщеплении энергетических уровней атома при действии на него магнитного поля. Величина расщепления: ΔE = -MJZ·B. Где MJZ – проекция магнитного момента атома на направление магнитного поля; B – индукция магнитного поля. Значит расстояние между Зееманскими подуровнями одинаково. MJZ = Мб·g·My. g – коэффициент Ланде, зависит от квантовых чисел S,L,J. g = 1+((J(J+1)+L(L+1)-S(S+1))/2·J(J+1)). Квантовое число принимает 2J+1значения: My = -J; -J+1; … +J.
Каждый энергетический уровень распадается на 2J+1 компонентов.
Жёлтый дуплет атома Na: 3p →3s
g=1; ΔE= Мб·B; Δω = ΔE/Ћ → Δω = Мб·B/Ћ (*)
Расстояние между линиями по частоте. Простой или нормальный эффект Зеемана – расщепление на 3 линии: ω0 → ω0, ω0 ± Δω. Сложный эффект Зеемана – при расщеплении более чем на линии: Δω`=r· Δω/q, r,q – небольшие простые числа 1,2,3…
Для Na:
![]()
Электронный парамагнитный резонанс
Если атомы вещества внести в магнитное поле, то каждый терм расщепляется на 2J+1 подуровни; расстояние между 3 подуровнями: ΔE = Мб·g·B. Пусть также имеется переменное э.м. поле с частотой ω; hω = ΔE = Мб·g·B. В этом случае будет происходить поглощение энергии в э.м. поле, т.к. атомы будут переходить между энергетическими состояниями, соответствующими 3-м подуровням. Это обнаружил Завойский в 1944г. Т.к. чисто атомов в обычном состоянии < чем атомов в возбуждённом, то преобладает поглощение магнитных волн над излучением.
ω = Мб·B·g/Ћ=1011Гц(если g=1)
Явление поглощения
магнитных волн парамагнетиками развилось
в «электронный парамагнитный резонанс»
(ЭПР). Ядерный магнитный резонанс (ЯМР)
– поглощение ядрами атомов электронных
волн U
109
Гц. «Резонанс» значит, что поглощение
идёт на определенных частотах. В случае
ЭПР схема наблюдения его: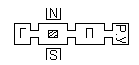
Тут зависимость импульса от индукции будет:
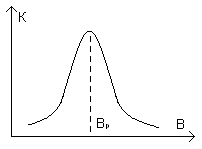
Связь в молекулах.
Чтоб объяснить свойства молекулы надо рассмотреть разные виды движения и строения молекул.
Ионная (связь Li(литий) и F(фтор)). В литии энергия ионизации Ei Li = 5,3 эВ. Сродство с электроном у фтора ЕcF=3,5 эВ. Если сближать эти два атома, то энергетически выгодно электрону от лития перейти к фтору.

Когда r=R0, то минимум потенциальной энергии. U0 = K0e2/R0; (где K0 – константа из закона Кулона, R0 – расстояние между атомами фтора и лития, когда есть молекула Li+F.
Это выражение показывает, что связь в этом F+Li можно считать ионной. В ионной молекуле F+Li электростатическое взаимодействие ионов Li+ и F- компенсирует разницу Ei Li и Eс F.
При этом взаимодействии e из Li с орбиты S переходят к F.
Такая связь обусловленная электростатическим взаимодействием атомов - ионная. Некоторые связи можно считать ионными и вводят некий коэффициент ионности.
Ковалентная связь (наиболее распространённая) – химическая связь, обусловлненная тем, что один или более валентных электронов обобществлены двумя атомами.
 Н2+
Н2+
Этот e не даёт оттолкнуться двум протоном.
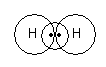 Н2
Н2
Рассмотрим потенциальную энергию взаимодействия двух атомов в молекуле. Как она меняется при изменении расстояния между ядрами двух атомов. Форма кривой зависит от ориентации спинов (↑↓ или ↑↑). Состояние ↑↑ - возбуждённое, ↑↓ - основное.
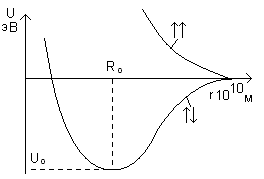
Мы видим, что в возбуждённом состоянии молекула находиться не может, его называют отталкивательным (если ↑↑ то молекула распадается на 2 атома). Эти кривые получены из квантово-механических вычислений. У других молекул на примере 2-х атомных, можно нарисовать:
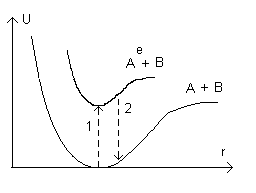
Ае – электронно-возбужденный атом А.
А и В – атомы.
1 – переход в возбуждённом состоянии, то перейти и по 2 с выделением света.
Также зависимости характерны не только для 2-х атомных, но и для многоатомных, но вместо расстояния r – некоторая дргуая переменная, определяющая расстояние атомов в пространстве, т.е. U(r1, r2, r3, … rn)
Разновидность ковалентной – гибридная связь.
