
- •Первое начало термодинамики.
- •В более точном виде
- •Работа газа при изменении его объема.
- •Теплоемкость.
- •Применение первого начала изопроцессов.
- •При изохорном процессе газ не совершает работы над внешними телами
- •Круговой процесс. Обратимые и необратимые процессы.
- •Энтропия, ее статическое толкование и связь с термодинамической вероятностью. Второе и третье начала термодинамики.
- •Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия.
- •Считается, что сила отталкивания есть положительная сила, т.Е. Больше нуля, а сила притяжения – отрицательная сила, т.Е. Меньше нуля.
- •Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия обладает минимальной энергией.
Первое начало термодинамики.
Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. Допустим, что некоторая система, например газ, заключенный в цилиндр под поршнем, обладает внутренней энергией, и получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U2, совершила работу A над внешней средой, т.е. против внешних сил. Количество теплоты считается положительным, если оно подводится к системе, а работа считается положительной, если система совершает ее против внешних сил. В соответствии с законом сохранения энергии, при любом способе перехода системы из первого состояния во второе
U = U2 – U
будет одинаковым и равным разности между количеством теплоты, полученном системой, и работой, совершаемой системой против внешних сил.
U = Q – A, или
Q = U + A (1).
Уравнение (1) выражает Первое начало термодинамики: теплота, сообщенная системе, расходуется на изменение ее внутренней энергии и совершение ею работы против внешних сил.
В более точном виде
dQ = dU + dA, где
dU – бесконечно малое изменение внутренней энергии, dA – элементарная работа, dQ – бесконечно малое количество теплоты.
Если система периодически возвращается в первоначальное состояние, то изменение внутренней энергии равно нулю, тогда согласно I началу термодинамики Q = A, т.е. вечный двигатель первого рода – периодически действующий двигатель, который совершал бы работу большую, чем сообщенная ему извне энергия, что невозможно! Это является еще одной формулировкой I начала термодинамики.
Работа газа при изменении его объема.
(Самостоятельно)
Теплоемкость.
ОПРЕДЕЛЕНИЕ:Удельная теплоемкость вещества – величина равная количеству теплоты, необходимому для нагревания одного килограмма вещества на 1 Кельвин.
![]()
ОПРЕДЕЛЕНИЕ:Молярная теплоемкость – это величина равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 Кельвин.
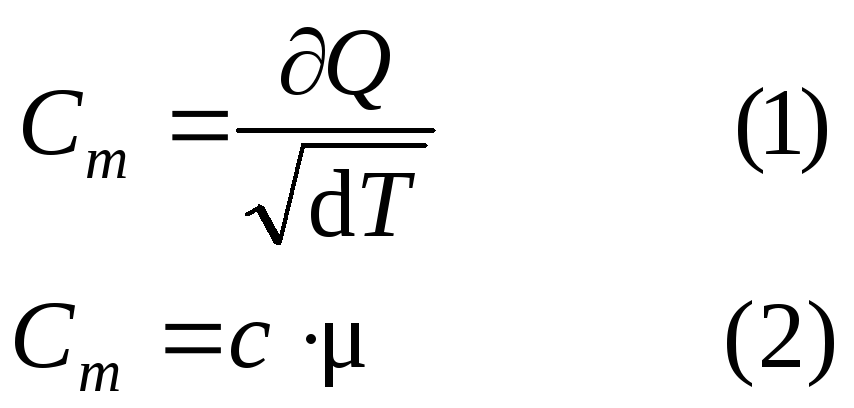
Согласно I началу термодинамики dQ = dU + dA.
Для одного моля вещества можем записать
CmdT = dUm + PdVm.
Если газ нагревается при постоянном объеме, т.е. PdVm = 0, тогда получим
![]()
т.е. молярная теплоемкость газа при постоянном объеме равна изменению внутренней энергии 1 моля газа при повышении температуры на 1 Кельвин.
![]()
Если газ нагревается при постоянном давлении, то
![]()
Т.к. первое слагаемое не зависит от вида процесса, потому что внутренняя энергия идеального газа не зависит от P и V, а определяется лишь температурой, и при этом всегда равна CV,
![]()
то, используя уравнение Менделеева-Клапейрона, записанное в виде PdVm = RdT, получим

Формулы (3) и (4) выражают уравнение Майера для газов. Форма записи (3) показывает, что CP всегда больше CV на величину молярной газовой постоянной. Следовательно, при нагревании газа при постоянном давлении требуется дополнительное количество теплоты на совершение работы расширения газа. При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение CP к CV
![]()
Для одноатомных газов молярная теплоемкость определяется лишь числом степеней свободы и не зависит от температуры, но уже в двухатомных газах число степеней свободы, проявляющиеся в теплоемкости, зависит от температуры.
Из качественной экспериментальной зависимости молярной теплоемкости CV водорода следует, что CV зависит от температуры – при низкой, порядка 50 К, CV = 3/2R, при комнатной – CV = 5/2R, и при очень высокой CV = 7/2R.
Э то
можно объяснить, предположив, что при
низких температурах наблюдается только
поступательное движение, при комнатной
добавляется их вращение, а при высоких
– колебание молекул. При вычислении
теплоемкости необходимо учитывать
квантование энергии, вращение и колебание
молекул, т.к. возможны не любые вращательные
и колебательные энергии, а определенный
дискретный ряд значений энергии.
то
можно объяснить, предположив, что при
низких температурах наблюдается только
поступательное движение, при комнатной
добавляется их вращение, а при высоких
– колебание молекул. При вычислении
теплоемкости необходимо учитывать
квантование энергии, вращение и колебание
молекул, т.к. возможны не любые вращательные
и колебательные энергии, а определенный
дискретный ряд значений энергии.
Если энергии теплового движения недостаточно, например для возбуждения колебаний, то эти колебания не вносят своего вклада в теплоемкость, потому что соответствующая степень свободы «замораживается» и к ней не применим закон равнораспределений энергии по степеням свободы. Поэтому теплоемкость двухатомного газа при комнатной температуре равна 5/2R, а не 7/2R.
