
Курсовая по химии2
.doc-
Химический элемент №49 In (индий)
-
Электронная формула: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1
-
5IIIA; 5 – номер периода, соответствует числу энергетических уровней (5); III – номер группы, определяет число валентных электронов и высшую валентность; А – главная подгруппа; 49 – порядковый номер, определяет заряд ядра и количество электронов. Эффект провала электрона отсутствует.
-
5s2 5p1 – валентные электроны. Индий принадлежит к p-элементам, т.к. последний валентный электрон находится на p-подуровне.
-
Набор квантовых чисел для валентных электронов:
-
|
n |
5 |
5 |
5 |
|
l |
0 |
0 |
1 |
|
ml |
0 |
0 |
-1 |
|
ms |
+0.5 |
-0.5 |
+0.5 |
-
Индий представляет собой серебристо-белый металл. Проявляет максимальную степень окисления +3.
-
 Ковалентность
равна 3.
Ковалентность
равна 3.
 5p 5p
5p 5p
5s 5s
Возбужденное состояние.
-
При образовании бинарных соединений In проявляет sp2-гибридизацию, например InF3. У индия (в возбужденном состоянии) 3 неспаренных электрона (1s и 2p) и при образовании соединения, они гибридизуются, и тип гибридизации- sp2.
-
Свойства соединений данного химического элемента.
-
Оксид: In2O3 – амфотерный (т.к. ∆Э.О.=Э.О.O2 - Э.О.In =3.5-1.5=2)
-
Гидроксид: In(OH)3- амфотерный.
In(OH)3 + 3HCl = InCl3 + 3H2O
H3InO3 = HInO2 + H2O
HInO2 + NaOH = NaInO2 + H2O
-
М
 олекула
InF3 плоская и имеет
форму плоского треугольника F
олекула
InF3 плоская и имеет
форму плоского треугольника F

 In
In
F F
-
K+[In(OH)4]- - тетрагидроксоиндиат калия; In3+-комплексообразователь, (OH)—лиганд, 4-координационное число.
K[In(OH)4]= K+ + [In(OH)4]-
[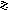 In(OH)4]-
In3+
+ 4(OH)-
In(OH)4]-
In3+
+ 4(OH)-
In3+ - акцептор, т.к. имеет свободную АО (5р); т.к. Э.О. O2 > Э.О. H2, то O2- донор, т.к. имеет двухэлектронную орбиталь.
Кн=(СIn3+ * COH-)/C[In(OH)4]-
-
Состояние электролита в растворе.
3.1 Гидролиз NaInO2 идет по аниону, т.к. эта соль образована сильным основанием и слабой кислотой (NaOH и HInO2).
NaInO2 + aq → Na+aq + (InO2)-aq
(
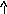 InO2)-
+ H2O
→ HInO2 +
(OH)-
InO2)-
+ H2O
→ HInO2 +
(OH)-
 H+
+ (OH)-
H+
+ (OH)-
NaInO2 + H2O → HInO2 + NaOH
pH=14+0.5lg(Kводы*С(InO2)- / КHInO2)=-0,5lg(10-14*1.9/(6.7*10-14))=13.7
Гидролиз In(NO3)3 идет по катиону т.к. эта соль образована слабым основанием и сильной кислотой (In(OH)3 и HNO3).
In(NO3)3 + aq → In3+aq + 3(NO3)-aq
I
 n3+
+ H2O
→InOH2+
+ H+
n3+
+ H2O
→InOH2+
+ H+

 H+
+ (OH)-
H+
+ (OH)-
In(NO3)3 + H2O → InOH(NO3)2 + HNO3
pH=-0.5lg(Kводы*СIn3+ / К In(OH)3)=-0.5lg(10-14*1.9/(4.5*10-3))=5.7
Реакция гидролиза эндотермическая, поэтому, в соответствии с принципом Ле-Шателье о сдвиге равновесия, нагревание способствует гидролизу.
4. Окислительно-восстановительные процессы.
4.1 Индий, как металл может проявлять только восстановительные (Red) свойства :
In0 – 3e → In3+ φ In3+/ In0=-0.34В (ст.усл)
In0 –e → In+ φ In+/ In0=-0.25В (ст.усл)
Ионы индия могут быть как окислителями так и восстановителями. Они проявляют восстановительные свойства в кислой среде окислительные – в щелочной.
pH<7: In2+ – e → In3+ φ In3+/ In2+=-0.45В
In+ – e → In2+ φ In2+/ In+=-0.35В
pH>7: In3+ + 3e → In0 φ In3+/ In0=-0.34В
In+ + e → In0 φ In+/ In0=-0.25В
In2+ + e → In+ φ In2+/ In+=-0.35В
4 .2
1) In0
+ Fe3+Cl3
+ H2O
→ In3+2O3
+ Fe2+
.2
1) In0
+ Fe3+Cl3
+ H2O
→ In3+2O3
+ Fe2+
1 2In0 – 6e + 3H2O → In3+2O3 + 6H+
6 Fe3+
+ e → Fe2+
Fe3+
+ e → Fe2+
2In0 + 6 Fe3+ + 3H2O → In2O3 + 6 Fe2+ +6H+
2In0 + 6 FeCl3 + 3H2O → In2O3 + 6 FeCl2 +6HCl
E0 = φFe3+/Fe2+ - φIn2O3/In0 = 0.77 – (-1.03) =1.8
Так как E0>0, то реакция самопроизвольно идет в прямом направлении, т.е. концентрации исходных веществ будут уменьшаться, а продуктов реакции – увеличиваться.
2) InCl3 + Zn0 +KOH → In0 + [Zn(OH)4]2- + …
2 In3+
+ 3e → In0
In3+
+ 3e → In0
3 Zn0 –
2e + 4(OH)-
→ [Zn(OH)4]2-
Zn0 –
2e + 4(OH)-
→ [Zn(OH)4]2-
2In3+ + 3Zn0 + 12(OH)- → 2In0 + 3[Zn(OH)4]2-
2InCl3 + 3Zn0 + 12 KOH → 2In0 + 3K2[Zn(OH)4] + 6KCl
E0 = φIn3+/In0 – φZn0/[Zn(OH)4]2- = -0.34 + 1.2=0.86В
Реакция идет в прямом направлении.
3) In0 + KMnO4 + HCl → In3+ + Mn2+ + …
5 In0
– 3e → In3+
In0
– 3e → In3+
3 MnO4-
+ 5e + 8H+
→ Mn2+
+ 4H2O
MnO4-
+ 5e + 8H+
→ Mn2+
+ 4H2O
5In0 + 3 MnO4- +24H+ → 5In3+ + 3Mn2+ + 12H2O
5In0 + 3KMnO4 +24HCl → 5InCl3 + 3MnCl2 + 12H2O + 3KCl
E0 = φMnO4-/Mn2+ – φIn3+/In0 = 1.5 + 0.34=1.84В
Реакция идет в прямом направлении.
5.Электрохимические свойства.
5.1 VIn2O3/2VIn = 1.04 – оксидная пленка плохо защищает металл от дальнейшего окисления. Tok/Tпл = 1.3 – металл не теплостойкий. ∆Gin-O2=-832 кДж/моль – металл склонен к самопроизвольному окислению.
Взаимодействие с водой (pH=7):
2 In
+ 6H2O
→ 3H2↑
+ 2In(OH)3
In
+ 6H2O
→ 3H2↑
+ 2In(OH)3
2 In0 – 3e → In3+
3 2H2O + 2e → H2↑ + 2(OH)-
φH2O/ H2=-0.059pH=-0.41
φ In3+/ In0=-0.34В
Ep = φH2O/ H2 – φIn3+/In0 = -0.41+0.34=-0.07В
Индий водой не окисляется.
Взаимодействие с кислотами. Взаимодействие с неокислительными кислотами (HCl):
2 In
+ 6HCl → 3H2↑
+ 2InCl3
In
+ 6HCl → 3H2↑
+ 2InCl3
2 In0 - 3e → In3+
3 2H+ + 2e → H2↑
φH+/H2=-0.059pH=-0.059*0=0
φ In3+/ In0=-0.34В
Ep = φH+/H2– φIn3+/In0 = 0+0.34=0.34В
Неокислительной (соляной) кислотой окисляется.
Взаимодействие с окислительными кислотами (HNO3):
При нагревании:
In + 6HNO3(конц) → In(NO3)3 + 3H2O + 3NO2↑
Ep = φNO3-/ NO2– φIn3+/In0 = 0.8+0.34=1.14В
8In + 30HNO3(оч.оч.разб) → 8In(NO3)3 + 9H2O + 3NH4NO3
Ep = φNO3-/ NH4+– φIn3+/In0 = 0.87+0.34=1.21В
На холоду:
8In + 3HNO3(оч.оч.разб) + 3H2O → 4In2O3 + 3NH4NO3
Ep = φNO3-/ NH4+– φIn3+/In0 = 0.87+0.34=1.21В
Взаимодействие с щелочами:
2In + 2NaOH + 2H2O → 3H2↑ + 2NaInO2
4In + 3O2(г) + 4NaOH → 4NaInO2 + 2H2O
5.2 Электролит In(NO3)3, H2O; pH=4.6
Анод (+) из C:
Анодная реакция в общем виде: RedA – Ze → OxA
Конкурирующие частицы: (NO3)-, H2O
φO2/H2O=1.23 – 0.059pH + ηO2/In=2.1 (ηO2/In=1.12)
Катод (-) из С:
Катодная реакция в общем виде: OxК + Ze → RedК
Конкурирующие частицы: In3+, H2O
φH2O/H2=-0.059pH- ηH2/In=0.43 (ηH2/In=-0.7) – самый положительный на катоде
φ In3+/ In0=-0.34В
A: 2H2O – 4e = O2↑ + 4H+
K:H2O + 2e = H2↑ + 2(OH)-
Продукты электролиза на аноде HNO3 в диссоциированном виде и газ O2, а на катоде газ
H2 и In(OH)3(тв).
5
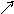



 .3
.3


 K Ag||AgClтв|Cl-||In3+|In
A
K Ag||AgClтв|Cl-||In3+|In
A
φAgClтв/Ag=0.22- предположительно катод
φK = φAgClтв/Ag , тогда φA= φIn3+/In0 ЭДС= φK – φA
Снимаются показания потенциометра (ЭДС) и находится φA по формуле: φA= φK– ЭДС.
5.4 φSn2+/Sn=-0.14; φ In3+/ In0=-0.34 Значит In – анод, а Sn - катод (т.к. φ In3+/ In0< φSn2+/Sn)
1) Без аэрации, pH=7
 e
e
 A:
In | H2O
| Sn :K
A:
In | H2O
| Sn :K
(OH)-
A :
2 In0
- 3e → In3+
:
2 In0
- 3e → In3+
K: 3 2H2O + 2e → H2↑ + 2(OH)-
2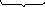 In0
+ 6H2O
= 3H2↑
+ 2In3+
+ 6(OH)-
In0
+ 6H2O
= 3H2↑
+ 2In3+
+ 6(OH)-
2In(OH)3
φK = -0.059pH=-0.41В
φA= φ In(OH)3/ In0=-1.07В
Eкор= φK – φA=0.66В
Процесс коррозии идет интенсивно.
2) С аэрацией, pH=7


 e
e
 A:
In | O2,
H2O |
Sn :K
A:
In | O2,
H2O |
Sn :K
(OH)-
A :
4 In0
- 3e → In3+
:
4 In0
- 3e → In3+
K: 3 O2 + 4e + 2H2O → 4(OH)-
2 In0
+ 3O2
+ 6H2O
= 4In3+
+ 12(OH)-
In0
+ 3O2
+ 6H2O
= 4In3+
+ 12(OH)-
4In(OH)3
φK = 1.23-0.059pH=0.82В
φA= φ In3+/ In0=-0.34 В
Eкор= φK – φA=1.16 В
Процесс коррозии протекает очень активно.
5 .5 pH=9
.5 pH=9


In0 | In3+|| (MnO4)- | (MnO4)2-
φ In3+/ In0=-0.34; φ(MnO4)-/ (MnO4)2-=.056 Значит In – анод, а (MnO4)2-- катод
(т.к. φ In3+/ In0< φ(MnO4)-/ (MnO4)2-)
A: In0 - 3e → In3+
K: (MnO4)- + e → (MnO4)2-
In0 + 3(MnO4)- = In3+ + 3(MnO4)2-
5.6 E= φK – φA=0.56+0.34=0.9В
Дан раствор соли In(SCN)3, Cг/л=7,5 г/л, ρ=1,1 г/см3,М=115+(32+12+14)*3=289г/моль
А) С%= Cг/л/10 ρ=7,5/11=0,68
Б)СМ= Cг/л/М=7,5/289=2,6*10-2М
В)СН= Cг/л/1000=7,5*10-3 г-экв/л
Г)Т= Cг/л/1000=7,5*10-3 г/см3
Министерство образования и науки Российской Федерации
«МАТИ»-РГТУ им. К.Э.Циолковского
Кафедра «Общая химия, физика и химия композиционных материалов»
Курсовая работа по неорганической и аналитической химии
«Свойства металла и его соединений».
Студент: Васильев А.А.
Факультет № 1
Группа: 1ОМД-1ДС-066
Преподаватель: Клеменьтьева В.С.
Отметка о сдаче
