
Билеты экзамен / Bilet_30
.docxБилет 30
-
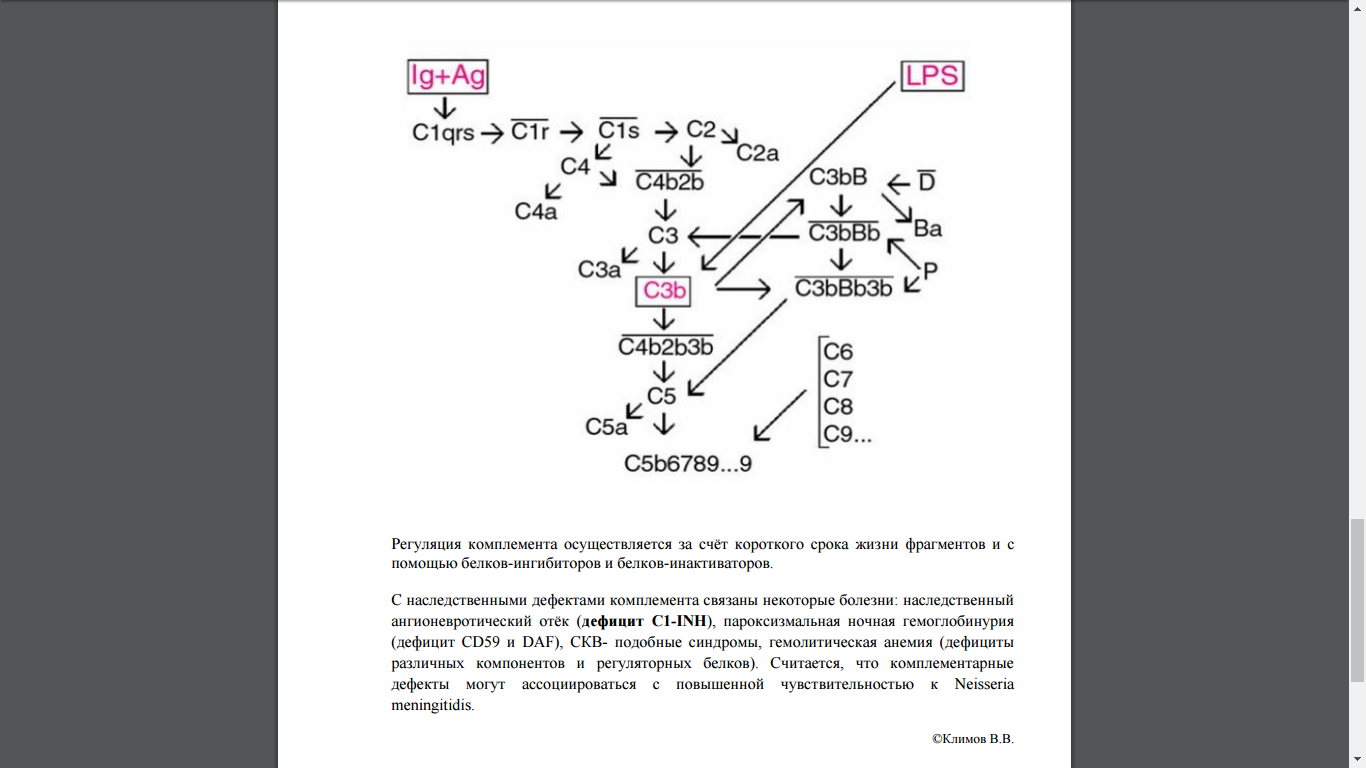
Пути активации комплемента

Мегасистема Хагемана: система комплемента, кинин-калликреиновая система, свёртывающая и фибринолитическая системы
Механизмы активации комплемента:
-
классический путь – зависимый от иммунных комплексов
-
лектиновый – близок к классическому
-
альтернативный – зависимый от фактора Р
-
протеазный – близок к альтернативному, но не зависит от фактора Р.
Классический путь активации.
Запускается комплексом антиген + антитело( иммунный комплекс - ИК), то есть требует наличия в данный момент специфического иммунного процесса. Он может запускаться комплексом антиген + С – реактивный белок, либо маннозосвязывающим лектином( лектиновый путь) – MBL. Прикрепляясь к поверхности клетки – мишени( *: бактерия), антитело первоначально меняет то, что должно быть уничтожено впоследствии комплементом. Соединение антитела с антигеном приводит к изменению пространственной конфигурации антитела, что делает возможным дальнейшую фиксацию на нем С1q.
Однако для прочной фиксации необходима 1 молекулаIgM или 2 молекулы IgG. Другие классы Ig не активируют комплемент.
С1 компонент комплемента состоит из трех компонентов: C1q, C1r, C1s.
C1q - мономер, C1r – димер( препротеаза C1s), C1s – димер( препротеаза для С2 и С4).
Внешне молекула C1qrs имеет форму тюльпана.
Физиологические и патологические эффекты фрагментов активированного комплемента.
С2а – кининоподобная субстанция, которая раздражает болевые рецепторы.
С4а – вызывает сильное расширение капилляров и сильный отек ткани
С3b – стимуляция адгезии и опсонизации
С3а, С5а – анафилотоксины 1 и 2 соответственно, они стимулируют хемотаксис клеток в очаг воспаления, вызывая спазм гладких мышц, повышение проницаемости капилляров, дегрануляцию тучных клеток( например за счет гистамина). С5а более агрессивный фрагмент, чем С3а. С5а обладает потенциальной способностью к цитолизу( образуется много кислородзависимых радикалов).
С5b6789…9 – вещество, имеющее форму полого цилиндра, с липидсвязывающими центрами, это мембранатакующий комплекс. Цилиндр с диаметром отверстия 10 нм, которое за счет липидсвязывающих центров способен фиксироваться на мембране клетки – мишени, пробуравливать ее, вследствие чего содержимое клетки вытекает наружу( точнее в клетку входят ионы натрия и вода).

C4b2b – конвертаза I классического пути С4b2b3b – конвертаза II классического пути
Лектиновый путь активации комплемента: Начинается со связывания с углеводами поверхностных структур микробных клеток, а именно с остатками маннозы + маннозосвязывающий лектин (MBL). У млекопитающих имеются специальные MBL-ассоциированные сериновые протеазы, MASP-1 и MASP-2, которые аналогично C1s классического пути катализируют активационное расщепление С4
Альтернативный путь запускается бактериальными полисахаридами, денатурированными белками, IgA и IgE, некоторыми лекарствами. Они запускают свободно плавающий С3 – С3b, тот фактор В, а образовавшийся комплекс для постоянно циркулирующего фактора D

-
Иммунная система и опухолевый рост, механизмы онкогенеза
Иммунная система и опухолевый рост
Давняя уверенность в существовании иммунной защиты против злокачественного опухолевого роста первоначально основывалась на представлениях об опухолях как о чужеродном для организма новообразовании и источнике биологической агрессии изнутри. Постулаты противоопухолевого иммунитета (концепция “иммунного надзора” Burnet, 70-е годы) были разработаны с учетом достижений инфекционной и трансплантационной иммунологии, в соответствии с которыми отторжение опухоли рассматривалось как адекватная реакция иммунной системы, а прогрессирование - как проявление иммунодефицита.
В настоящее время не вызывает сомнения факт, что иммунной системе принадлежит решающая роль в борьбе со злокачественными новообразованиями. В пользу существования иммунных механизмов защиты свидетельствуют данные о повышении частоты развития опухолей при наследственных иммунодефицитах и иммуносупрессии, индуцированной облучением или введением химиопрепаратов.
На современном этапе трактовка опухолевой прогрессии как следствия иммунодефицита представляется упрощенной. Если при генерализации онкозаболевания дисфункция иммунитета действительно имеет место, то на более ранних стадиях опухоли иммунная система организма-хозяина сохраняет свою компетентность. Многочисленные данные свидетельствуют о том, что иммунная система часто не только не отторгает растущую опухоль, но и активно помогает опухолевой прогрессии. С другой стороны, раковые клетки в процессе своего развития приобретают ряд признаков, характерных в норме для клеток иммунной системы: способность к избирательной миграции в ткани, адгезивность и инвазивность.
На трансформированных клетках экспрессируются рецепторы, свойственные клеткам иммунной системы. Все вышеназванное служит основанием для коррекции наших представлений о взаимодействии между опухолью и иммунной системой. Это взаимодействие не всегда является абсолютным антагонизмом. Злокачественная опухоль не является для организма полностью генетически чужеродным образованием. Более того, своеобразное родство между злокачественными клетками и клетками иммунной системы обнаруживается и на генетическом уровне. Развитие органов и клеток иммунной системы контролируется в значительной степени теми же генами, которые при определенных условиях вызывают опухолевый рост.
13.2. Механизмы онкогенеза
Согласно современным представлениям, злокачественные новообразования являются формой патологии, которая сопровождается принципиальными искажениями механизмов контроля пролиферации и дифференцировки клеток.
Современная концепция онкогенеза построена на понятиях “протоонкогены” и “онкогены”. Протоонкогены - гены пролиферации и дифференцировки клеток. В нормальных клетках белки, кодируемые онкогенами (гены синтеза ростовых факторов, рецепторов к ним, гены сигнальных и транскрибирующих факторов), необходимы для регуляции роста клеток. Онкогены - избыточно или аномально экспрессированные протоонкогены.
-
Нарушения контроля над пролиферативной активностью клеток могут быть вызваны превращением протоонкогенов в активные онкогены под действием мутагенов (излучение, химические агенты и т.д.) или вирусов. Так, ретровирусы могут трансформировать инфицированные клетки в опухолевые, амплифицируя копию клеточного протоонкогена клетки хозяина, превращая его в онкоген или внося в клетку вирусные онкогены, которые контролируют синтез белков - регуляторов пролиферации клеток. Для клеток некоторых опухолей характерна транслокация протоонкогена с одной хромосомы на другую, что приводит к активной экспрессии протоонкогена.
Вирусы Усиление экспрессии генов
Мутации Протоонкоген Аномальная экспрессия
Транслокации генов
Злокачественная трансформация клетки
-
Нарушение механизмов апоптоза. Злокачественный рост опухолей может быть обусловлен не только слишком высоким уровнем пролиферативной активности, но и недостаточной активностью апоптоза или сочетанием обоих факторов. Блокирующей апоптоз активностью обладают онкобелки Bcl-2, гены которых впервые были обнаружены в клетках В-клеточной лимфомы. Этот онкоген в норме обеспечивает пролиферацию и длительную жизнеспособность лимфоцитов памяти, а опухолевым клеткам позволяет избегать апоптотической гибели. Усиление апоптоза осуществляется белками Bax и Bad. Относительное внутриклеточное содержание белков этих двух функционально антагонистичных групп определяет готовность клеток к апоптотической гибели. В тканях имеются также белки, запускающие апоптотическую гибель генетически измененных клеток на определенной фазе клеточного цикла (р53). Мутации в гене р53 широко распространены и встречаются в 55-75% случаев рака. В целом, мутации в генах, которые прямо или косвенно приводят к снижению апоптоза, связаны с плохим прогнозом в отношении целого спектра опухолей.
Результат активации онкогенов - возникновение клона опухолевых клеток с новыми свойствами.
-
Правила клинической оценки иммунного статуса
-
Оценка показателей иммунного статуса в комплексе, учёт относительных и абсолютных значений.
-
Оценка показателей в связи с конкретной клинической ситуацией у конкретного пациента с учётом формы, фазы, тяжести патологического процесса.
-
Предпочтение в оценке значительных сдвигов по сравнению со слабыми колебаниями.
-
Оценка иммунного статуса в динамике патологического процесса, в разных клинических ситуациях у одного и того же пациента.
-
Приоритет клинического подхода в оценки иммунного статуса.
