
- •Виды химической связи
- •Классификация диэлектрических материалов
- •Основные положения зонной теории твердого тела
- •Электропроводность полупроводников
- •Контактные явления в полупроводниках Классификация электронно-дырочных переходов
- •Классификация электрических переходов
- •Р ис. 7. Пространственное распределение зарядов (а, б, в) и энергетические диаграммы р-п-перехода (г, д, е):
- •Методы формирования электронно-дырочных переходов
- •Р ис. 9. Диффузионный р-п-переход (а) и распределение примесей в полупроводнике после диффузии в него доноров (б).
- •Контакт металл-полупроводник
- •Гетеропереходы
- •Полупроводниковые диоды
- •В ыпрямительные диоды
- •Диоды шотки
- •Стабилитроны
- •Стабисторы
- •Туннельные диоды
- •Варикапы
- •Работа биполярного транзистора в активном режиме
- •Статические параметры биполярного транзистора
- •Статические характеристики биполярного транзистора
- •Полевые транзисторы
- •Классификация интегральных микросхем
- •Активные элементы
- •Пассивные элементы
- •Интегральные микросхемы на основе биполярных транзисторных структур
- •Интегральные микросхемы на основе полевых транзисторных структур
- •Оптоэлектроника
- •Классификация Оп/пП
- •Основные характеристики инфракрасных и светоизлучающих диодов
- •Принцип действия и основные характеристики фоторезисторов
- •Экзаменационные вопросы по курсу «Физические основы микроэлектроники»
- •Тема 1. Основные материалы электронной техники
- •Тема 2. Контактные явления в полупроводниках
- •Тема 3. Полупроводниковые диоды
- •Тема 4. Биполярные транзисторы
- •Тема 5. Полевые транзисторы
- •Тема 6. Интегральные микросхемы
- •Тема 7. Оптоэлектронные полупроводниковые приборы
Виды химической связи
Под химической связью понимают взаимодействие между атомами, в результате которого образуются молекулы и твердые тела. Химическая связь осуществляется посредствам электронов, находящихся на внешних, не полностью занятых электронных оболочках. Эти электроны называют валентными. Независимо от природы сил, возникающих при сближении частиц, характер взаимодействия между атомами остается одинаковым (рис.1):
р ис.
1.
ис.
1.
на относительно больших расстояниях появляются силы притяжения Fпр, быстро увеличивающиеся с уменьшением расстояния х между частицами (кривая 1); на небольших расстояниях возникают силы отталкивания Fот, которые с уменьшением расстояния увеличиваются гораздо быстрее, чем Fпр (кривая 2). На расстоянии х - r0 силы отталкивания уравновешивают силы притяжения и результирующая сила взаимодействия F обращается в нуль (кривая 3). Состояние частиц, сближенных на расстояние r0, является состоянием равновесия.
Существует несколько видов химических связей.
К овалентиая
связь
(гомеополярная)
возникает
в результате перекрытия электронных
облаков отдельных
атомов при их сближении, вследствие
чего возрастает плотность отрицательного
заряда в межъядерном пространстве, что
приводит к появлению сил притяжения,
уравновешивающих силы взаимного
отталкивания между ядрами. Перекрытие
электронных оболочек сближающихся
атомов приводит к обобществлению
электронов. В этом случае уже нельзя
говорить о принадлежности электрона
одному из атомов: электроны принадлежат
одновременно нескольким атомам,
образующим
молекулу или твердое тело. Подобным
образом создается молекула водорода:
в разъединенных атомах водорода s-орбиты
имеют сферическую симметрию
с антипараллельной ориентацией спинов.
При объединении атомов в молекулу
образуется структура, показанная на
рис. 2.
овалентиая
связь
(гомеополярная)
возникает
в результате перекрытия электронных
облаков отдельных
атомов при их сближении, вследствие
чего возрастает плотность отрицательного
заряда в межъядерном пространстве, что
приводит к появлению сил притяжения,
уравновешивающих силы взаимного
отталкивания между ядрами. Перекрытие
электронных оболочек сближающихся
атомов приводит к обобществлению
электронов. В этом случае уже нельзя
говорить о принадлежности электрона
одному из атомов: электроны принадлежат
одновременно нескольким атомам,
образующим
молекулу или твердое тело. Подобным
образом создается молекула водорода:
в разъединенных атомах водорода s-орбиты
имеют сферическую симметрию
с антипараллельной ориентацией спинов.
При объединении атомов в молекулу
образуется структура, показанная на
рис. 2.
рис. 2.
В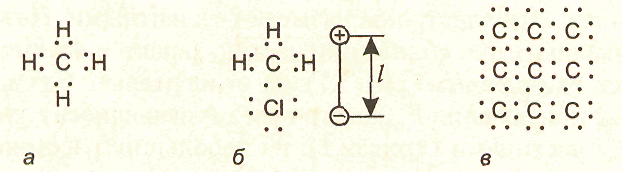 зависимости от того, симметричную или
асимметричную структуру имеют молекулы,
они могут быть неполярными и полярными.
В неполярных молекулах центры
положительных и отрицательных зарядов
совпадают (рис. 3, а),
в полярных они
находятся на некотором расстоянии l
друг от друга (рис. 3, б), в результате
чего образуется диполь, характеризующийся
дипольным моментом т
= ql
(q — заряд электрона).
зависимости от того, симметричную или
асимметричную структуру имеют молекулы,
они могут быть неполярными и полярными.
В неполярных молекулах центры
положительных и отрицательных зарядов
совпадают (рис. 3, а),
в полярных они
находятся на некотором расстоянии l
друг от друга (рис. 3, б), в результате
чего образуется диполь, характеризующийся
дипольным моментом т
= ql
(q — заряд электрона).
рис. 3.
Ковалентная связь типична для органических молекул. Вместе с тем, она может иметь место и в твердых веществах. Примером могут служить атомы алмаза, кремния и германия, которые входят в четвертую группу периодической системы элементов. Они имеют валентность, равную четырем, и в твердом теле образуют структуру, в которой каждый атом связан ковалентными связями с четырьмя ближайшими своими соседями (рис. 3, в). В такой структуре происходит обобществление валентных электронов, при котором каждый атом оказывается окруженным восемью обобществленными электронами. Такая связь характеризуется очень высокой прочностью.
М еталлическая
связь
возникает
между атомами с небольшим числом
валентных электронов,
что характерно для металлов. При сближении
таких атомов, как и при ковалентной
связи, происходит перекрывание электронных
оболочек и обобществление
валентных электронов с той лишь разницей,
что обобществленные электроны
не локализуются вблизи своих атомов, а
свободно перемещаются между атомами,
образуя «электронный газ». При этом
атомы, отдавшие свои электроны,
превращаются
в положительные ионы, силы отталкивания
между которыми уравновешиваются
силами притяжения между ионами и
электронами. В результате такой
связи образуется кристаллическая
структура, в которой атомы металла
находятся на строго определенном
расстоянии друг от друга в среде
коллективизированных
электронов (рис. 4).
еталлическая
связь
возникает
между атомами с небольшим числом
валентных электронов,
что характерно для металлов. При сближении
таких атомов, как и при ковалентной
связи, происходит перекрывание электронных
оболочек и обобществление
валентных электронов с той лишь разницей,
что обобществленные электроны
не локализуются вблизи своих атомов, а
свободно перемещаются между атомами,
образуя «электронный газ». При этом
атомы, отдавшие свои электроны,
превращаются
в положительные ионы, силы отталкивания
между которыми уравновешиваются
силами притяжения между ионами и
электронами. В результате такой
связи образуется кристаллическая
структура, в которой атомы металла
находятся на строго определенном
расстоянии друг от друга в среде
коллективизированных
электронов (рис. 4).
рис. 4.
Ионная связь (гетерополярная) возникает между атомами металлов, имеющими на внешней орбите один электрон, и атомами металлоидов, имеющими на внешней орбите семь электронов. В этом случае при сближении атомов происходит переход валентных электронов от металлического атома к металлоидному атому, в результате чего образуются разноименные ионы, между которыми возникает электростатическое притяжение. Весь монокристалл ионного соединения можно считать одной гигантской молекулой.
Так происходит, например, образование кристаллов хлористого натрия (NaCl). В таких кристаллах каждый ион связан с шестью ионами противоположного знака, в результате чего образуется структура, показанная на рис. 5.
р ис.
5.
ис.
5.
Молекулярная связь (Ван-дер-Ваальса) возникает между молекулами с ковалентным характером внутримолекулярного взаимодействия.
Межмолекулярное притяжение возникает при согласованном движении валентных электронов в соседних молекулах, то есть таком движении, когда в любой момент времени электроны соседних молекул максимально удалены друг от друга и максимально приближены к положительным зарядам ядер соседних молекул (рис. 6). Тогда силы притяжения валентных электронов ядром соседней молекулы оказываются сильнее сил взаимного отталкивания электронов оболочек этих молекул. За счет молекулярных связей образуется твердое состояние инертных газов, водорода, кислорода, азота. Молекулярная связь легко разрушается тепловым движением, поэтому молекулярные кристаллы обладают низкими температурами плавления (для парафина Тпл = 50-52 оС).
р ис.
6.
ис.
6.
