
не разобрано / БАКТЕРИАЛЬНЫЙ ВАГИНОЗ
.docОкраска мазков 1. Мазки фиксируют над пламенем горелки. На свободную от исследуемнго материала часть стекла одновременно наносят по 6 капель растворов "А" и "Б". Смешивают стеклянной палочкой и равномерно распределяют по стеклу. Экспозиция – 2 мин. 2. Удаляют остатки краски и наносят раствор йода на 2 мин. 3. Удаляют остатки йода и наносят 10-20 капель смывной жидкости, повторяют манипуляцию до полного обесцвечивания, постоянно покачивая стекло. 4. Промывают водопроводной водой. 5. Докрашивают сафранином 2 мин. Промывают водой, просушивают, микроскопируют.
Результаты окраски При использовании данной окраски происходит оптимальное прокрашивание препарата метиленовым синим грамположительной флоры в голубые тона и грамотрицательной - в интенсивный иссиня-черный цвет.
Непосредственную микроскопию лучше проводить под относительно небольшим увеличением (окуляр х 2-7) с целью увеличения поля зрения и максимального охвата всех присутствующих в материале объектов. С учетом современных достижений клинической бактериологии и знаний инфекционной патологии женских половых органов Кира Е. Ф. в 1994 году была разработана оригинальная классификация микроскопической характеристики биоценоза влагалища, в которой представлена микроскопическая характеристика 4 типов биоценоза влагалища и соответствующие каждому типу нозологические формы:
Нормоценоз
-
Доминирование лактобактерий, отсутствие грамотрицательной микрофлоры, спор, мицелия, псевдогифов, наличие единичных лейкоцитов и единичных "чистых" эпителиальных клеток соответственно фазе менструального цикла. Типичное состояние нормального биотопа влагалища.
Промежуточный тип Умеренное или незначительное количество лактобактерий, наличие грамположительных кокков, грамотрицательных палочек. Обнаруживаются лейкоциты, моноциты, макрофаги, эпителиальные клетки. Часто наблюдается у здоровых женщин, редко сопровождается субъективными жалобами и клиническими проявлениями.
Дисбиоз влагалища
-

Незначительное количество или полное отсутствие лактобактерий, обильная полиморфная грамотрицательная и грамположительная палочковая и кокковая микрофлоры; наличие "ключевых" клеток. Количество лейкоцитов вариабильно, отсутствие или незавершенность фагоцитоза. Полимикробная картина мазка.
Бактериальный вагиноз
Вагинит Большое количество лейкоцитов, макрофагов, эпителиальных клеток, выраженный фагоцитоз, морфологический пейзаж воспалительного процесса.
Неспецифический вагинит При обнаружении: гонококков, трихомонад, мицелия, псевдогифоф, спор выставляется соответствующий этиологический диагноз – Гонорея, Трихомониаз, Микотический вагинит [7, 8]. Предложенная классификация достаточно проста и информативна, так как сочетает в себе микробиологическую интерпритацию влагалищного мазка, характеристику клинической картины и соответствующую нозологическую форму.
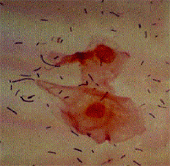
Наиболее важное диагностическое значение при БВ имеет выявление "ключевых" клеток.
Формирование "ключевых" клеток происходит в случае увеличения колонизации G.vaginalis и последующей их адгезии на клетки вагинального плоского эпителия. Таким образом "ключевые" клетки представляют собой отторгшиеся от эпителиальной выстилки интактные или литически измененные клетки, колонизированные G.vaginalis. G.vaginalis покрывают всю поверхность эпителиальных клеток в виде облака или вуали, а в наиболее клинически выраженных случаях заполняют собой все межклеточное пространство. Однако, выявление "ключевых" клеток при микроскопии влажного неокрашенного мазка увеличивает вероятность получения ложноположительного результата, так как часто "ложноключевые" клетки (эпителиальные клетки с адгезированными на них лактобактериями) отождествляют с истинными, что ведет к гипердиагностике БВ. Некоторые авторы считают, что более достоверную информацию можно получить при микроскопии вагинальных мазков, окрашенных по методу Грама, когда "ключевые" клетки легко дифференцировать с "ложноключевыми". Чувствительность микроскопического метода диагностики составляет 93%, а специфичность 70% [6]. Микроскопический метод позволяет оценить не только морфологические особенности и соотношение отдельных компонентов вагинальной микрофлоры, но и получить информацию о состоянии слизистой влагалища и наличии лейкоцитарной реакции макроорганизма.
Количественный критерий обнаружения "ключевых" клеток остается дискутабельным, поскольку до настоящего времени окончательно не решен вопрос о показаниях нормы для микрофлоры влагалища. Вместе с тем, общепризнанным является факт превалирования в норме бактерий рода Lactobacillus, что позволило использовать его в качестве основного при исследовании БВ. В пользу указанного свидетельствует невозможность чрезмерного развития сопутствующей флоры, а следовательно и наличие "ключевых" клеток, при сохраненном количественном уровне лактобактерий. Это автоматически исключает подщелачивание среды влагалища и т.д., характерные для БВ. В настоящее время существует несколько микроскопических классификаций БВ.
Мавзютов Р. А. и соавт. предложили дифференцирование БВ по трем степеням:
1 степень – компенсированный, для которого характерно полное отсутствие в исследуемом материале микрофлоры при неизмененных эпителиоцитах. Указанное состояние слизистой влагалища не рассматривается в качестве патологического, но отсутствие лактобактериальной флоры свидетельствует о принципиальной возможности заселения пустующей экологической ниши попадающими с наружных половых органов микроорганизмами и последующим формированием БВ ввиду нарушения на фоне отсутствия лактобактерий естественной колонизационной резистентности слизистой. Описанные формы могут наблюдаться при микроскопии в результате "чрезмерной" подготовки пациентки к посещению врача или же после проведения интенсивной химиотерапии антибактериальными препаратами широкого спектра действия (Цефалоспорины, макролиды и т.п.).
2 степень – субкомпенсированный, характеризующийся количественным снижением лактобактерий, соизмеримым с возрастанием количества сопутствующей грамвариабельной полиморфной бактериальной флоры, и появлением в поле зрения единичных (1-5) "ключевых" клеток при относительно умеренном лейкоцитозе (15-25 в поле зрения). "Ключевые" клетки могут быть представлены как покрытыми бактериальной флорой снаружи эпителиоцитами, так и содержащими бактерии внутриклеточно ввиду неспецифического осуществления эпителиальными клетками функций фагоцитоза.
3 степень – декомпенсированный, являющийся клинически выраженным в соответствии с симптоматикой БВ и микроскопически характеризующийся полным отсутствием лактобактерий, когда все поле зрения заполнено "ключевыми" клетками. Бактериальная флора при этом может быть представлена самыми различными, за отсутствием лактобактерий, микроорганизмами как в монокультуре, так и в различных морфо- и видовых сочетаниях [15]. Одним из методов лабораторной диагностики, который позволяет в полной мере оценить качественные и количественные характеристики микрофлоры влагалища является бактериологическое исследование. C развитием этого метода изменялось и представление о составе микрофлоры влагалища. Усовершенствование бактериологического метода диагностики – улучшение качества питательных сред, методов культивирования, различных техник выделения и идентификации микроорганизмов способствовали изменению представлений о критериях нормы. Первоначально было установлено, что наряду с лактобактериями в составе нормальной микрофлоры могут быть и условно-патогенные микроорганизмы (стафилококки, стрептококки, некоторые грамотрицательные бактерии) [13, 14]. Внедрение с начала 70-х годов техники анаэробного культивирования привнесло новые существенные коррективы в понятие "нормальная" вагинальная микрофлора. По мере совершенствования анаэробной техники и идентификации строгих анаэробов заметно расширился спектр микроорганизмов, входящих в состав нормальной вагинальной микрофлоры [16, 17].
Однако, бактериологический метод исследования не универсален, пределы его возможностей весьма ограничены и зачастую зависят от ряда субъективных факторов, таких как оснащенность бактериологической лаборатории, качество используемых для выделения микроорганизмов питательных сред, уровень подготовки бактериологов и т.д. Поэтому результаты исследований различных авторов значительно варьируют и в настоящее время пока еще не определены четкие критерии "нормофлоры" влагалища, пограничных и патологических состояний. А это, в свою очередь, создает определенные трудности в постановке диагноза, прогнозировании тяжести течения патологического процесса и возможности его осложнений, а также в назначении адекватной этиотропной терапии.
-
БАКТЕРИОЛОГИЧЕСКИЙ МЕТОД
Классическое бактериологическое исследование отделяемого из влагалища позволяет оценить как качественный, так и количественный состав бактериальной микрофлоры. Дифференциация и идентификация микроорганизмов – определение родовой, видовой и типовой принадлежности микроорганизмов является наиболее трудоемким и ответственным этапом бактериологического исследования. Он осуществляется на основании изучения целого комплекса свойств: морфологических, тинкториальных, культуральных, ферментативных и антигенных.
При идентификации микроорганизмов необходимо работать только с чистой культурой, поскольку присутствие посторонних микроорганизмов может исказить результаты исследования и послужить поводом для ошибочного заключения.
Широкий спектр микрорганизмов, играющих роль в формировании микробиоценоза влагалища, а также в возникновении инфекционного процесса, требует изучения их ферментативной активности путем постановки большого количества различных биохимических реакций, позволяющих по сочетанию полученных результатов в комплексе с другими данными определить вид микроорганизма. Этот раздел работы наиболее трудоемкий, проводится в несколько этапов, требует приготовления большого количества питательных сред, дефицитных реактивов, посуды и т.д., что делает этот метод исследования достаточно дорогостоящим. В связи с этим, в настоящее время для идентификации микроорганизмов используются микрометоды – коммерческие микротест-системы или слайды для биохимической идентификации микроорганизмов различных групп.
Важным фактором, значительно влияющим на успех бактериологической диагностики БВ, является корректный способ взятия и транспортировки исследуемого материала. Так, взятие материала должно всегда осуществляться до начала лечения биотерапевтическими или антибактериальными препаратами или не ранее чем через 10 дней после окончания их приема, а также до начала проведения других местных терапевтических вмешательств. Накануне взятия материала пациентка не должна иметь половую связь. Для предотвращения гибели бактерий, чувствительных к различным факторам окружающей среды, и во избежании размножения в исследуемом материале бактерий-комменсалов транспротировка взятого материала в лабораторию должна осуществляться в максимально короткие сроки и в специальных транспортных средах. В настоящее время бактериологи располагают большим арсеналом коммерческих универсальных транспортных сред, которые способны сохранять в жизнеспособном состоянии весь спектр культивируемых микроорганизмов.
В зависимости от цели исследования, которая определяется в необходимости проведения точной количественной оценки микрофлоры или возможностью ограничиться ориентировочным (полуколичественным) методом, вагинальное отделяемое высевается на питательные среды двумя методами: 1. взятие вагинального отделяемого производится с помощью калиброванной петли (диаметр 3 мм) или ложечки Фолькмана, затем материал погружается в 1 мл жидкой транспортной среды, далее из материала готовят серийные разведения из расчета 10:1(объем/вес) и затем по 0,1 мл высевают на различные селективные питательные среды; 2. взятие вагинального отделяемого производится микробиологическим тампоном и засевается на среду обогощения (тиогликолевая среда) и на половину чашки Петри с селективной питательной средой с последующим рассевом (метод истощения).
Степень роста в первом случае определяется в пересчете на 1 мл вагинального отделяемого (КОЕ/мл). При полуколичественной оценке используется четыре уровня (градации) микробного обсеменения:
со среды обогащения – рост только на жидкой среде, на плотной питательной среде рост отсутствует;
скудный рост – на плотной питательной среде рост до 10 колоний микроорганизмов определенного вида;
умеренный рост – на плотной питательной среде рост от 10 до 100 колоний микроорганизмов одного вида;
обильный рост – на плотной питательной среде рост более 100 колоний микроорганизмов одного вида.
Посев проводится на набор стандартных питательных сред, позволяющих выявить максимально возможный спектр микроорганизмов. Питательные среды должны: · содержать необходимые для питания микроорганизма питательные вещества; · иметь реакцию рН, оптимальную для выращиваемого вида микроорганизма; · иметь достаточную влажность, так как микроорганизмы питаются по законам диффузии и осмоса; · обладать изотоничностью; · быть стерильными, обеспечивая тем самым возможность выращивания чистых культур микроорганизмов.
Для выделения всего спектра факультативно-анаэробных микроорганизмов и определения их количественных характеристик обычно используется агар с добавлением 5% донорской крови.
Стафилококки представляют собой широко распространенную в природе группу микроорганизмов, объединяющую в себе наряду с сапрофитическими и болезнетворные формы с различно выраженной степенью их патогенности и вирулентности. В связи с этим, выделение стафилококков из вагинального содержимого, содержащего смешанную флору, не может являться доказательством их этиологического значения. Только выделение монокультуры стафилококка из закрытых гнойных очагов, независимо от свойств штамма является бесспорным доказательством его патогенности. Для выделения стафилококков используют отечественные питательные среды – желточно-солевой агар Чистовича, молочно-солевой агар или коммерческую среду Staphylococcus agar (Becton Dickinson). Эти среды обладают элективными свойствами, обусловленными высоким содержанием хлорида натрия, а желточно-солевой агар, кроме того, позволяет более четко, чем кровяной агар, дифференцировать патогенные и непатогенные штаммы стафилококка.
Стрептококки выделяют на среде Columbia agar (BioMerioux, Becton Dickinson, Oxoid) с добавлением лошадиной или бараньей дефибринированной крови (5%), налидиксовой кислоты (15 мг/л) и колистина (10 мг/л). Кроме стрептококков на этой среде растут коагулазопозитивные стафилококки. В связи с этим, перед идентификацией бактерии необходимо исследовать на наличие каталазы.
Для выделения энтерококков (стрептококки группы D) используют Enterococcus agar (Serva), Enterococcus agar (Difco), Slanes and Bartley agar или Bile Esculine agar (Oxoid). При проведении количественного исследования посев производится из исходного материала в разведениях 10-3 и 10-5. Во все среды, кроме Bile Esculine agar входит трифенилтетразолий хлорид (ТТХ), который, расщепляясь энтерококками, придает их колониям характерную розовую или малиновую окраску. В состав среды Bile Esculine agar входят соли желчи, к которым устойчивы энтерококки. Кроме того, в среду входят эскулин и цитрат железа. Энтерококки способны гидролизовать эскулин с образованием эскулетина и глюкозы. Эскулетин, связываясь с цитратом железа, образует комплекс черного цвета, который придает характерную черную окраску колониям энтерококков и среде вокруг них.
Для выделения грамотрицательных неспорообразующих факультативно-анаэробных бактерий обычно используют среды MACCONKEY agar или Эндо (Oxoid, BioMerioux, Becton Dickinson). При количественном методе исследования посевы на эти среды осуществляют из разведений 10-5 и 10-7. При учете колоний отмечают отдельно лактозонегативные и лактозопозитивные колонии.
Для выделения дрожжеподобных грибов используется среда Сабуро с добавлением хлорамфеникола (400 мг/л). При проведении количественного исследования посев производят из разведения 10-3. Инкубация посевов проводится в течении 24-48 часов при температуре +370С.
Для выделения G.vaginalis используют коммерческие селективные питательные среды Columbia CNA agar (Becton Dickinson), Gardneralla vaginalis agar (Oxoid) или HBT Bilayer medium (BBL) в которые добавляется 10% бараньей или донорской крови. Инкубация посевов проводится при 370С в атмосфере с 5% СО2 в течение 48 часов.
Для транспортировки биологического материала при бактериологическом исследовании на микоплазмы используют только специальные транспортные среды, содержащие лошадиную сыворотку и дрожжевой экстракт производства BioMerioux или Becton Dickinson. Посев материала производится на плотную питательную среду A7 (BioMerioux, Becton Dickinson). Для культивирования, идентификации, количественного определения и определения чувствительности к антибиотикам микоплазм могут быть использованы тест-системы - Mycoplasma DOU (Sanofi Diagnostics Pasteur) или Mycoplasma IST (BioMerioux).
Для выделения лактобактерий чаще всего используют агаризованные среды MRS (Difco, Oxoid). При количественном методе исследования посев проводят из разведений 10-3 и 10-5. Для того чтобы избежать роста дрожжеподобных грибов рода Candida в среду добавляют раствор сорбиновой кислоты в 1 М NaOH из расчета 14 г/л, простерилизованную фильтрованием. Инкубацию проводят в анаэростате с газовой смесью без палладиевого катализатора при +370С в течении 48 часов.
Изоляция анаэробных бактерий остается самой деликатной процедурой. Для выращивания анаэробов необходимо создать определенные условия, сущность которых заключается в удалении молекулярного кислорода из питательной среды и пространства, окружающего эти культуры. Среды должны быть приготовлены ex tempore или, в том случае, если они приготовлены заранее, должны храниться в условиях анаэробиоза. Другим обязательным условием, обеспечивающим выделение анаэробов из исследуемого материала, является внесение большого количества посевного материала в питательную среду.
Самым простым способом удаления растворенного кислорода из питательной среды является кипячение. Непосредственно перед посевом материала пробирки с питательными средами кипятят в водяной бане в течение 10-20 минут. При кипячении из среды вытесняется воздух и, следовательно, удаляется кислород. Свежеприготовленную питательную среду быстро охлаждают, погружая в лед или подставляя под струю холодной воды, чтобы не дать ей насытиться кислородом воздуха, и используют для посева. Для уменьшения диффузии кислорода из воздуха питательные среды заливают сверху стерильным вазелиновым или парафиновым маслом (толщина слоя 1-1,5 см). Посев биологическогоматериала производят пипеткой сквозь масло в наклонном положении пробирки.
В качестве редуцирующих веществ используют глюкозу, аскорбиновую кислоту, цистеин, гликокол, глютатион. Активно связываются с кислородом животные ткани паренхиматозных органов. На этом свойстве животных клеток основано приготовление питательной среды Китта-Тароцци, широко применяемой для выращивания анаэробов. В жидкие питательные среды помещают иногда пористые вещества: вату, пемзу, которые адсорбируют на своей поверхности пузырьки воздуха.
Для создания бескислородных условий используют физические, химические и биологические факторы. Физические способы культивирования анаэробов Способ Виньяля-вейона. Берут 4-5 пробирок с 0,5% расплавленным и охлажденным до температуры 40-450С сахарным агаром. В содержимое одной из них вносят пипеткой небольшое количество исследуемого материала и тщательно размешивают. Для уменьшения концентрации материала с целью получения изолированных колоний засеянную среду в количестве, соответствующем объему внесенного материала, переносят из 1-й пробирки во 2-ю, из 2-й в 3-ю. Затем содержимым каждой пробирки заполняют капилляры трех пастеровских пипеток.
Чтобы предупредить застывание питательной среды в момент насасывания ее в пипетки, кончик их, пока он не обломан, погружают на 3-5 минут в стерильную воду при температуре 45-500С. После заполнения вытянутый конец трубки запаивают и помещают в стеклянный цилиндр с ватой на дне. Через 2-3 суток в столбике агара вырастают ясно видимые колонии микробов-анаэробов. Выросшие колонии легко изолировать. Для этого капилляр надрезают напильником выше уровня намеченной колонии, надламывают, а колонию микрорганизма, находящуюся в агаре, извлекают петлей и пересевают в свежую питательную среду. Выращивание анаэробов в условиях вакуума. Вакуумные условия для выращивания анаэробов создают в анаэростате или эксикаторе. Исследуемый материал или культуру микроорганизмов засевают в пробирки с жидкой средой или на чашки Петри с плотной питательной средой. Сразу после посева чашки со средами помещаются в микроанаэростат с палладиевым катализатором (Oxoid) для поглощения кислорода и индикатором для выявления свободного кислорода (Disposable anaerobic indicator BBL, Becton Dickinson). Катализатор перед употреблением регенерируют в сухожаровом шкафу при температуре +175-1800С в течение часа. Затем микроанаэростат закрывают, удаляют из него воздух при помощи вакуумного насоса, после чего микроанаэростат заполняют нулевым поверочным азотом. Вновь удаляют газ из микроанаэростата, заполняют его газовой смесью (10% СО2, 10% Н2, 80% N2) и помещают в термостат. Анаэробные условия в микроанаэростате могут быть созданы и при использовании коммерческих газогенерирующих пакетов для анаэробов (BioMerioux; Becton Dickinson). После 48 часов инкубации проводят первый учет чашек с отсевом типичных колоний на жидкие питательные среды для анаэробов (Rosenow cysteine, Diagnostics Pasteur; Schadler with Vitamin K1, BBL, Becton Dickinson; Thioglycolate, Serva) для изучения культуральных свойств микроорганизмов и последующей идентификации, а также отсевов на плотные питательные среды, которые затем культивируют в аэробных условиях, чтобы убедиться, что выросшие микроорганизмы не являются факультативно-анаэробными. После первого учета чашки возвращают в микроанаэростат и инкубируют еще в течение 72 часов. Затем повторно изучают морфологию колоний, обращая особое внимание на появление черного пигмента, и производят отсев в жидкие питательные среды материал из тех колоний, которые отсутствовали при первом учете чашек, т. е. через 48 часов инкубации.
Микроаэрофилы (G.vaginaluis и Lactobacillus sp.) выращиваются в условиях пониженного содержания О2 в атмосфере СО2 в эксикаторе.
Анаэростат – прибор для выращивания микроорганизмов в анаэробных условиях – представляет собой толстостенный металлический цилиндр с герметически привинчивающейся крышкой, на которой имеются вакууметр и два крана для присоединения к вакуум-насосу.
Коммерческие микроанаэростаты (BbioMerioux, Becton Dickinson, Oxoid) представляют собой пластиковые цилиндры различного объема с металлическими плотно закрывающимися крышками, на которых также имеются вакууметр и два крана. Химические методы выращивания анаэробов Метод Аристовского Материал, исследуемый на наличие анаэробов, засевают на среду в чашки Петри и помещают их в эксикатор, на дно которого кладут химический поглотитель кислорода: гидросульфат натрия или пирогаллол. В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор помещают в термостат при температуре 370С на 24-48 часов. Биологический метод выращивания анаэробов (по Фортнеру) В чашку Петри наливают толстым слоем 5% кровяной агар с 1-2% глюкозы. Посередине чашки в питательной среде вырезают стерильным скальпелем канавку шириной 1-1,5 см, которая делит питательную среду на две половины. Одну из них засевают культурой анаэробов или исследуемым на их наличие биологическим материалом, другую половину – культурой аэробов: Serratia marcescens или E.coli. Перед посевом чашки подсушивают в термостате, чтобы анаэробы вместе с капельками влаги не могли попасть на другую сторону чашки. Засеянные чашки закрывают, а свободное пространство между дном и крышкой заклеивают лейкопластырем, чтобы предупредить поступление в чашку кислорода извне. В термостате чашки устанавливают вверх дном. Быстрорастущие аэробы, поглощая находящийся в чашке кислород, создают тем самым благоприятные условия для роста анаэробов. Большинство грамотрицательных анаэробных бактерий могут быть изолированы на средах с добавлением канамицина (100 мг/л), ванкомицина (7,5 мг/л), гемина (10 мг/л), витамина К3 (менадион, 1,5 мг/л) или К1 (фитоменадион, 1,5 мг/л), а также бараньих эритроцитов (5%). К базовым относятся среды Columbia agar Base (BBL, Becton Dickinson; BioMerioux), Schaedler agar или Wilkins Chalgren agar (Oxoid). При количественном методе исследования материал засевают из 10-6, 10-7 и 10-8 разведений. Срок инкубирования составляет 48 часов при температуре 350С.
Для выделения бифидобактерий используют среду Блаурокка. Для предотвращения роста аэробных бактерий в среду добавляют азид натрия в концентрации 100 мг/л. При количественном методе исследования посев производят из 10-5, 10-7 и 10-9 разведений. При полуколичественном методе исследования посев проводят методом агаровых столбиков в полужидкой питательной среде, либо на плотной питательной среде на чашке Петри. Инкубацию проводят в микроанаэростате при +370С в течении 48 часов. В том случае, если посев производился в толщу среды, после инкубации отмечают образование зоны задержки роста и газообразование. В агаре бифидобактерии образуют характерные колонии, напоминающие гречишные зерна, но могут также образовывать колонии в форме дисков.
Грамположительные анаэробные кокки выделяют на базовых средах (Columbia agar Base и др. см. выше), с добавлением бараньей крови (5%), налидиксовой кислоты (10 мг/л) и колистина (10 мг/л) или фенилэтилалкола (2,5 г/л).
Выделение бактерий рода Mobiluncus проводят с использованием Columbia agar Base с добавлением 2,5% лошадиной сыворотки, 15 мкг/мл налидиксовой кислоты и 1,0 мкг/мл тинидазола. Возможно использование и другой селективной среды – Columbia agar Base с добавлением 5% бараньей крови, 10 мкг/мл колистина и 15 мкг/мл налидиксовой кислоты. Инкубация посевов производится в анаэробных условиях 4-5 дней при температуре +370С.
Для выделения клостридий используют плотную среду RCM (Oxoid). В прбирки с расплавленной средой, разлитой по 9 мл и охлажденной до +480С, засевают взятый материал (при количественном методе исследования посев производят из 10-3, 10-5 и 10-7 разведений). Быстро ресуспендируют, затем в каждую пробирку добавляют небольшое количество (1,5 см) расплавленной среды RCM, содержащей метиленовую синьку в концентрации 1:20000 для того, чтобы предохранить среду от диффузии кислорода. Учет результатов производится через 16-18 часов инкубации. Для выделения C.perfringens используют селективную питательную среду TSC (Oxoid). В среду добавляют Д-циклодекстрин (400 мг/л) и эмульсию яичного желтка (50 мг/л) (Oxoid). С.perfringens на этой среде приобретают черный цвет, из за содержания в ней метабисульфита натрия и цитрата железа. Наличие эмульсии яичного желтка позволяет различить лецитиназопозитивные клостридии.
