
- •4 Повреждения миокарда
- •4.1. Ишемическое и реперфузионное повреждения миокарда
- •4,2, Изменение физико-химических свойств и структуры мембран, активности ферментов, баланса ионов и электрофизиологических параметров кардиоцитов
- •4.3. Нарушения генетической программы клеток миокарда и механизмов ее реализации
- •4.4. Расстройство симпатического и парасимпатического механизмов регуляции сердечной деятельности
- •4.5. Ремоделирование сердца
эгия Тема 4. Синдромы ишемического и реперфузионного повреждения миокарда •Ф- 61
ТЕМА СИНДРОМЫ ИШЕМИЧЕСКОГО
4 Повреждения миокарда
Высокий уровень заболеваемости и смертности от болезней системы кровообращения в значительной мере определяется широкой распространенностью ишемической болезни сердца (ИБС). Основой развития многих ее форм является транзиторная коронарная недостаточность, которая характеризуется сменой периода ишемии миокарда более или менее выраженным возобновлением коронарного кровотока в нем.
Постишемическая реперфузия миокарда развивается также после хирургического (например, в результате стентирования, аортокоронарного шунтирования, баллонной ангиопластики, тромбэктомии) или медикаментозного (например, вследствие фибринолиза, дезагрегации форменных элементов крови) возобновления кровотока в магистральных ветвях коронарных артерий.
Реоксигенация миокарда после его гипоксии наблюдается и при устранении различных форм патологии систем дыхания (дыхательная недостаточность) или крови (анемический синдром), в условиях проведения сеансов нормо- или ги- пербарической оксигенации (при состояниях, сопровождающихся общей гипоксией), после эпизодов значительной физической нагрузки или выраженной стрессорной реакции.
Таким образом, самые разнообразные состояния у человека сопровождаются сменой преходящего снижения коронарного кровотока и развитием ишемического синдрома, последующей его реперфузией и реоксигенацией с развитием реперфузионного синдрома.
4.1. Ишемическое и реперфузионное повреждения миокарда
Начиная с первых клинических и экспериментальных исследований причин и механизмов развития ИБС, считалось, что основным повреждающим фактором ее является ишемия миокарда. Прекращение ишемического периода расценивалось как завершение действия на миокард повреждающих факторов и начало репаративного периода.
Вместе с тем, во время интенсивной разработки и внедрения в клинику хирургических и медикаментозных способов восстановления коронарного кровообращения накапливались факты, свидетельствующие о существенных нарушениях сердечной деятельности и системного кровообращения не только в условиях ишемии и/или гипоксии миокарда, но и во время и на раннем этапе после восстановления перфузии миокарда, либо проведения сеансов нормо- или ги- пербарической оксигенации у пациентов с ИБС. Воспроизведение у животных экспериментальных моделей различных вариантов ИБС с обратимым нарушением коронарного кровотока показало также, что важными звеньями механизма дополнительного реперфузионного повреждения сердца являются патогенные факторы кальциевого и кислородного «парадоксов».
В целом, результаты анализа и сопоставления клинических и экспериментальных данных свидетельствуют о факте пролонгирования и даже потенцирования степени повреждения сердца в условиях его коронарогенной постишемической реперфузии. Этот феномен, обозначаемый как реперфузионный кардиальный синдром, представляет собой реальное и весьма распространенное явление в кардиопа
-
Схема
4.1.
Общие механизмы повреждения сердца
при его регионарной ишемии и на начальном
этапе реперфузии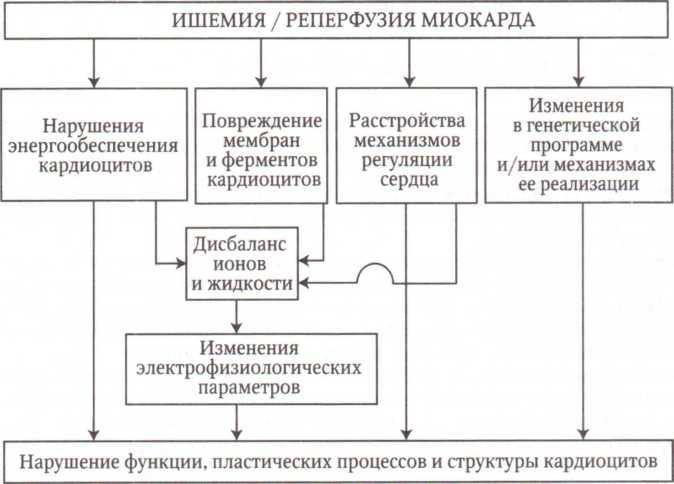
тологии человека. Кроме того, накопились факты, свидетельствующие о том, что при регионарной ишемии сердца и при последующем восстановлении кровотока в нем активируются ряд общих как патогенных, так и адаптивных механизмов.
Выделение закономерностей повреждения и адаптации сердца при его регионарной ишемии и реперфузии возможно в связи с тем, что их материальная основа — клеточные и молекулярные механизмы — едины и взаимосвязаны. При этом ведущее значение среди них имеют нарушения:
-
процессов энергетического обеспечения клеток миокарда;
-
физико-химического состояния и структуры их мембран, активности ферментов, баланса ионов и электрофизиологических параметров кардиоцитов;
-
генетической программы клеток миокарда и/или процессов ее реализации;
-
механизмов нейрогуморальной регуляции сердца (схема 4.1). Определенная комбинация и последовательность реализации указанных
и других механизмов обуславливают специфику и неповторимость течения патологического процесса у каждого конкретного пациента с транзиторным снижением коронарного кровообращения.
Нарушение энергетического обеспечения кардиоцитов. Расстройство энергоснабжения клеток миокарда является инициальным («стартовым») и одним из основных механизмов их альтерации как при ишемии, так и в период возобновления коронарного кровотока в сердце. При этом нарушения развиваются на всех основных этапах процесса энергообеспечения:
-
ресинтеза аденозинтрифосфата (АТФ);
-
транспорта его энергии от мест продукции к эффекторным структурам клеток;
-
утилизации последними энергии АТФ (схема 4.2).
х
О
Схема 4.2. Механизмы нарушения энергетического обеспечения миокарда (период ишемии и начальный этап реперфузии)
Важно, что при ишемии миокарда расстройства энергообеспечения доминируют на этапе ресинтеза АТФ. Его содержание в миокарде снижается двухфазно — быстро в первые 10 мин ишемии и медленнее — с 40-й по 120-ю минуту. Начальное уменьшение содержания АТФ обусловлено, главным образом, падением в миокарде р02 (табл. 4.1). Вторая фаза уменьшения содержания АТФ в зоне ишемии обусловлена, в основном, подавлением гликолитического пути его ресинтеза.
Для клинической практики важно, что подавление реакций гликолиза является маркером начала периода необратимого ишемического повреждения миокарда. Известно, что гликолиз ингибируется избытком ионов водорода, которые тормозят активность одного из его ключевых ферментов — глицеральде- гид-3-фосфатдегидрогеназы. В эксперименте и клинике выявлено двухфазное увеличение содержания НАД • Н2 (и соответственно развития ацидоза): первое — с 1-й по 10-ю минуту ишемии миокарда (на 30—40 % в сравнении с нормой), второе — между 40-й и 80-й минутой ишемии (более чем на 40 %). Первая волна повышения содержания НАД ■ Н2 является следствием угнетения процесса его окисления, главным образом, в малат-аспартатном челночном механизме митохондрий в результате дефицита кислорода, вторая — преимущественно в дегидрогеназной реакции «пируват-лактат» вследствие ацидотического подавления активности глицеральдегид-3-фосфатдегидрогеназы. Увеличение содержания НАД • Н2 в кардиомиоцитах совпадает во времени с двумя этапами снижения концентрации АТФ в зоне ишемии миокарда (см. табл. 4.1). При этом необходимо отметить, что первый этап снижения содержания АТФ сочетается с депрессией сократительной функции миокарда в зоне ишемии и в связи с этим — сократимости сердца в целом, а второй — с переходом обратимых повреждений миокарда в необратимые. Существенно, что подавление гликолити- ческой «продукции» АТФ потенцируется нарушением нейроэффекторной регуляции функции миокарда. Это обусловлено существенным снижением содержания норадреналина в поврежденном миокарде, начиная, как правило, с 15—20-й минуты ишемии. Известно, что норадреналин является одним из важных факторов активации фосфорилазы.
В ишемический период транзиторной коронарной недостаточности (ТКН) повреждаются также механизмы транспорта и использования энергии АТФ (см. схему 4.2). Об этом свидетельствует увеличение в плазме крови (уже в первые 40—120 мин после начала коронароокклюзии) уровня миокардиоцитарного фермента, участвующего в транспорте энергии АТФ — изоэнзима молекулярная фракция креатинфосфокиназы (МФ КФК) (см. табл. 4.1).
Одновременно с этим наблюдается прогрессирующее значительное снижение показателей сократительной функции сердца, происходящее на фоне сравнительно небольшого уменьшения содержания АТФ в зоне ишемии (на 0,8—0,9 мкмоль/г за первые 110 мин после начала коронароокклюзии при практически неизменной концентрации АТФ в участках сердца, отдаленных от зоны ишемии). Этот факт подтверждается положением о подавлении активности АТФазы миозина по мере развития ишемии миокарда.
В период реперфузии восстановление адекватного энергообеспечения миокарда наблюдается после его ишемии, не превышающей по длительности 10 мин (см. табл. 4.1). Реперфузия же после более длительной (20, 40 и особенно 120 мин) коронароокклюзии характеризуется потенцированием расстройств процессов энергетического снабжения миокарда в зоне постокклюзионного возобновления кровотока. Отчасти это обусловлено отсутствием признаков восстановления
Я
н
5
|
Показатели |
Фон |
Ишемия миокарда (10 мин) |
Реперфузия (40 мин) |
Ишемия миокарда (40 мин) |
Реперфузия (40 мин) |
Ишемия миокарда (120 мин) |
Реперфузия (40 мин) |
Ложная операция (160 мин) |
|
АТФ, мкмольМ на 1 кг сырой ткани (л = 8) А Б |
|
1,7 ± 0,04* 3,4 ± 0,02 |
|
|
2,7 ± 0,03* 3,3 ± 0,03* |
0,8 ± 0,06* 3,2 ± 0,02* |
1,3 ± 0,07* 3,2 ± 0,04* |
|
|
Р02, мм рт. ст. (Я = 9) А Б |
|
1,3 + 0,2* 38,7 ± 1,4 |
34,3 + 1,1 34,0 ± 1,6* |
2,2 ± 0,2* 38,7 ± 1,1 |
32,3 ± 1,9 33,2 ± 0,7 |
2,4 ± 0,2* 34,7 ± 1,1 |
22,1 ± 0,97* 35,3 ± 1,4 |
|
|
1НАД • Н2 , уел. ед. (л = 6) А Б |
100 100 |
63,7 ± 2,3 114,0 ± 0,7* |
99,6 ± 2,0 97,9 ± 0,5* |
58,2 + 7,7* 99,7 ± 6,8 |
|
54,6 ± 3,8* 75,0 ± 3,5* |
58,3 ± 5,1* 71,6 + 1,1* |
|
|
МФ КФК, ME на 1 л плазмы крови (л = 8) |
21,4 ± 1,9 |
37,1 ± 2,5* |
83,5 ± 4,1* |
50,7 ± 0,9* |
135,8 ± 4,1* |
62,0 ± 2,1* |
163,1 ± 2,5* |
23,0 ± 2,1 |
Динамика содержания АТФ, НАД • Н2, р02 в миокарде и МФ КФК в плазме крови крыс при регионарной коронарогенной ишемии и последующей реперфузии сердца различной длительности (М ± т)
Таблица 4.1
кровотока в отдельных областях реперфузируемого миокарда (этот феномен обозначен как «ишемия миокарда при реперфузии» или no-reflow). Развитие этого феномена является результатом действия многих факторов. К числу наиболее значимых относят необратимую агрегацию форменных элементов крови, тромбоз микрососудов и отек их стенки. Вместе с тем, нарастание степени нарушений энергоснабжения реперфузируемого миокарда после длительной ишемии миокарда свидетельствует о включении дополнительных факторов его альтерации. Это происходит за счет дальнейшего повреждения митохондрий, главным образом — в результате нарушения процессов транспорта энергии АТФ из митохондрий к эффекторным структурам кардиомиоцитов (сарколемме, миофибрил- лам и др.) и использования ими энергии. Электронно-микроскопическое исследование миокарда показало, что его 10- и 40-минутная реперфузия после 40 и 120 мин ишемии вызывает набухание и интенсивную деструкцию митохондрий. При этом степень реперфузионного повреждения органелл более выражена в сравнении с предшествующим периодом ишемии, а также в сопоставлении с продолжающейся ишемией той же длительности. Это обусловлено накоплением в кардиомиоцитах избытка Са\ значительная часть которого фиксируется в митохондриях в виде комплекса с фосфатами и липидами. Транспорт Са22+ в митохондрии, в свою очередь, способствует накоплению в них жидкости (по осмотическому градиенту), их набуханию и разрушению. Кроме того, репер- фузионное повреждение органелл потенцируется патогенным действием избытка свободных радикалов и продуктов свободнорадикального перекисного окисления липидов (СПОЛ). Известно, что интенсивность липопероксидации в период реперфузии существенно увеличивается. Реперфузия миокарда сопровождается также дальнейшим увеличением содержания в нем НАД • Н2 (см. табл. 4.1) и снижением концентрации норадреналина.
В совокупности указанные механизмы обусловливают низкий уровень ресинтеза АТФ и его дефицит в зоне реперфузии миокарда. Одновременно с этим усиливается повреждение механизмов транспорта, а также использования энергии АТФ эффекторными структурами клеток миокарда. При этом указанные факторы в период реперфузии становятся доминирующими. Об этом свидетельствует факт прогрессирующего увеличения активности в плазме крови кардио- миоцитарного изофермента МФ КФК (см. табл. 4.1). Следует отметить также, что реперфузия миокарда после 40 и 120 мин коронароокклюзии обусловливает более чем в 2 раза большую потерю клетками миокарда МФ КФК, чем продолжающаяся ишемия (длительностью соответственно 80 и 160 мин) без реперфузии. Это наблюдение свидетельствует о том, что на раннем этапе постокклюзи- онной реперфузии миокард (прежде всего его мембранный аппарат и ферментные системы) повреждается не в меньшей степени, чем при ишемии той же длительности.
Подтверждением факта существенной роли реперфузионной альтерации механизмов транспорта и утилизации энергии АТФ в кардиомиоцитах на начальном этапе возобновления коронарного кровотока являются также данные о том, что увеличение содержания АТФ в зоне реперфузии и незначительное его снижение в отдаленных от нее участках сердца не предотвращают прогрессирующего подавления сократимости сердца в целом при его регионарной реперфузии после 40 мин ишемии. Такая ситуация в большой мере обусловлена тем, что не вся энергия АТФ на начальном этапе постишемической реперфузии доставляется КФК-транспортной системой к эффекторным структурам клеток миокарда и не вся доставленная энергия утилизируется ими.Таким образом, в условиях ишемии миокарда процесс энергообеспечения кардиомиоцитов расстраивается в результате как подавления процессов ресинтеза АТФ, так и повреждения механизмов транспорта и усвоения его энергии. При реперфузии ишемизированного миокарда потенцируется нарушение транспорта энергии АТФ (в связи со значительной потерей КФК), а также использования его энергии эффекторными структурами (в результате подавления активности АТФаз), что имеет существенное патогенное значение.
Важно, что принципиально сходные изменения процесса энергетического обеспечения кардиоцитов на этапах ресинтеза АТФ, транспорта и усвоения его энергии наблюдаются при повреждении миокарда и другого генеза: при стрессе, миокардиодистрофиях, ряде интоксикаций, инфекционных и аллергических процессов. Это дает основания относить описанные выше механизмы расстройств энергоснабжения клеток миокарда к числу типовых звеньев патогенеза нарушений сердечной деятельности.
