
- •Введение
- •1. Вводные сведения
- •1.1. Предмет механики жидкости и газа
- •1.2. Краткие исторические сведения о развитии науки
- •2. Основные физические свойства жидкостей и газов
- •2.1. Физическое строение жидкостей и газов
- •2.2. Основные физические свойства: сжимаемость, текучесть, вязкость, теплоемкость, теплопроводность
- •2.3. Гипотеза сплошности
- •2.4. Два режима движения жидкостей и газов
- •2.5. Неньютоновские жидкости
- •2.6. Термические уравнения состояния
- •2.7. Растворимости газов в жидкостях, кипение, кавитация. Смеси.
- •2.8. Законы переноса
- •2.9. Требования к рабочим жидкостям
- •3. Основы кинематики сплошных сред
- •3.1. Два метода описания движения жидкостей и газов
- •3.2. Понятие о линиях и трубках тока. Ускорение жидкой частицы
- •3.3. Расход элементарной струйки и расход через поверхность
- •3.4. Уравнение неразрывности (сплошности)
- •3.5. Вихревое и безвихревое (потенциальное) движения
- •4. Силы, действующие в жидкостях
- •4.1. Массовые и поверхностные силы
- •4.2. Напряжения поверхностных сил
- •4.3. Напряженное состояние
- •5. Общие законы и уравнения статики и динамики жидкостей и газов
- •5.1. Уравнения движения в напряжениях
- •5.2. Уравнения гидростатики в форме Эйлера и их интегралы
- •5.3. Напряжения сил вязкости, обобщенная гипотеза Ньютона
- •5.4. Уравнение Навье-Стокса для вязкой жидкости
- •5.5. Примеры аналитических решений уравнений Навье-Стокса для ламинарного движения в цилиндрических трубах
- •6. Абсолютный и относительный покой (равновесие) жидких сред
- •6.1. Основная формула гидростатики
- •6.2. Определение сил давления покоящейся среды на плоские и криволинейные стенки
- •6.3. Относительный покой (равновесие) жидкости
- •Следовательно, вместо уравнения (6.5) можно записать:
- •7. Модель идеальной (невязкой) жидкости
- •7.1. Модель идеальной (невязкой) жидкости. Уравнения Эйлера
- •7.2. Интегралы уравнения движения жидкости для разных случаев движения. Баротропные и бароклинные течения
- •8. Общая интегральная форма уравнений количества движения и момента количества движения
- •8.1. Законы сохранения
- •8.2. Закон изменения количества движения
- •8.3. Закон изменения момента количества движения
- •8.4. Силовое воздействие потока на ограничивающие его стенки
- •9. Общее уравнение энергии в интегральной и дифференциальной формах
- •10. Турбулентность и ее основные статистические характеристики
- •10.1. Турбулентное течение
- •10.2. Осредненные параметры и пульсации. Стандарт пульсационной скорости и степень турбулентности
- •10.3. Двухслойная модель турбулентности
- •11. Подобие гидромеханических процессов
- •11.1. Числа и критерии подобия
- •11.2. Понятие о методе размерностей. Пи-теорема
- •11.3. Методы моделирования
- •11.4. Методы аналогий
- •12. Одномерные потоки жидкостей и газов
- •12.1. Уравнение д. Бернулли для струйки и потока реальной (вязкой) жидкости
- •12.2. Гидравлические потери (общие сведения)
- •13. Ламинарное течение в круглых трубах
- •13.1. Течение при больших перепадах давления
- •13.2. Ламинарное течение с облитерацией
- •13.3. Ламинарное течение с теплообменом
- •14. Потери напора при турбулентном течении в гидравлически гладких круглых трубах
- •14.1. Потери напора при турбулентном течении в шероховатых трубах. График и.И. Никурадзе
- •15. Местные гидравлические сопротивления
- •15.1. Внезапное расширение русла
- •15.2. Внезапное сужение русла
- •15.3. Местные сопротивления при ламинарном течении
- •16. Истечение жидкости через отверстие в тонкой стенке при постоянном напоре
- •16.1. Истечение через насадки при постоянном напоре
- •17. Истечение через отверстия и насадки при переменном напоре
- •17.1. Неустановившееся движение жидкости в трубах
- •17.2. Гидравлический удар
- •18. Расчет простых трубопроводов
- •18.1. Основные задачи по расчету простых трубопроводов
- •18.2. Последовательное соединение простых трубопроводов
- •18.3. Параллельное соединение простых трубопроводов
- •18.4. Разветвлённое соединение простых трубопроводов
- •19. Расчет сложных трубопроводов
- •19.1. Трубопроводы с насосной подачей жидкости
- •19.2. Основы расчета газопроводов
- •Заключение
- •Библиографический список
- •Оглавление
- •Гоувпо «Воронежский государственный технический университет»
- •394026 Воронеж, Московский просп., 14
2.7. Растворимости газов в жидкостях, кипение, кавитация. Смеси.
Растворимость газов в жидкостях характеризуется количеством растворенного газа в единице объема жидкости, различна для разных жидкостей и изменяется с увеличением давления.
Относительный объем газа, растворенного в жидкости до ее полного насыщения, можно подсчитать по закону Генри, т.е.
![]() ,
(2.44)
,
(2.44)
где
![]() - объем растворенного газа, приведенный
к нормальным условиям (
- объем растворенного газа, приведенный
к нормальным условиям (![]() );
);
![]() - объем жидкости;
- объем жидкости;
k - коэффициент растворимости;
р - давление жидкости.
При понижении давления выделяется растворенный в жидкости газ, причем интенсивнее, чем растворяется в ней. Это явление может отрицательно сказываться на работе гидросистем.
В результате испарения жидкость переходит в пар. Испаряемость свойственна всем капельным жидкостям и зависит от температуры и давления. Одним из показателей, характеризующих испаряемость жидкости, является температура ее кипения при нормальном атмосферном давлении; чем выше температура кипения (процесса парообразования в толще жидкости), тем меньше испаряемость жидкости. Однако интенсивность испарения неодинакова у различных жидкостей и зависит от условий, в которых они находятся. В гидросистемах нормальное атмосферное давление является лишь частным случаем; обычно приходится иметь дело с испарением, а иногда и кипением жидкостей в замкнутых объемах при различных температурах и давлениях.
Кипение капельной жидкости при заданной температуре может быть получено понижением давления. Давление, при котором происходит кипение жидкости, называют давлением парообразования. Наименьшее давление, при котором происходит кипение при нормальной температуре, называют давлением насыщенных паров. Чем больше давление насыщенных паров, тем больше испаряемость жидкости (рис. 2.7).
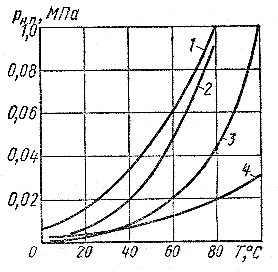
1 - бензин Б-70; 2 - спирт; 3 - вода; 4 - керосин
Рис. 2.7. Зависимость давления насыщенных паров
жидкостей от температуры
Кавитацией называется нарушение сплошности потока жидкости, обусловленное появлением в ней пузырьков или полостей, заполненных паром или газом. Кавитация возникает при понижении давления, в результате чего жидкость закипает или из нее выделяется растворенный газ. В потоке жидкости такое падение давления происходит обычно в области повышенных скоростей. В большинстве случаев жидкость настолько быстро проходит через область пониженного давления, что газ не успевает выделиться. В этом случае кавитацию часто называют паровой. Полости или пузырьки, заполненные паром, увлекаются потоком в область повышенного давления. Здесь пар конденсируется и полости, заполненные паром, замыкаются.
В качестве меры,
определяющей кавитационные свойства
профилей, применяют так называемое
число кавитации
![]()
![]() ,
(2.45)
,
(2.45)
где р и V - соответственно давление и скорость в набегающем потоке.
Появление кавитации всегда вызывает увеличение сопротивления, т.е. добавочную потерю энергии. Кроме этого, она влечет за собой кавитационную коррозию металла и появление кавитационных шумов. Все эти вредные действия кавитации настолько существенны, что обычно при проектировании насосов, турбин и винтов лопасти рассчитывают так, чтобы на них не возникала кавитация.
Смеси из нескольких
тел (газообразных или жидких) могут быть
получены одним из следующих трех основных
способов смешивания: смешивание в
объеме; смешивание в потоке и смешивание
в случае заполнения объема потоком.
Обычно приводят рассуждения о смешивании
лишь двух веществ или компонентов, а
другие более сложные случаи сводят
затем к последовательному добавлению
нового компонента к уже имеющейся смеси.
Для бинарной смеси, состоящей из
компонентов а
и b,
в единице объема смеси содержится масса
![]() компонента а
и масса
компонента а
и масса
![]() компонента b.
Величины
и
называют плотностями компонентов,
которые удовлетворяют соотношению
компонента b.
Величины
и
называют плотностями компонентов,
которые удовлетворяют соотношению
![]() ,
(2.46)
,
(2.46)
где
![]() - плотность смеси.
- плотность смеси.
Безразмерные
величины
![]() и
и
![]() представляют собой массовые концентрации
компонентов а
и b
в смеси и удовлетворяют соотношению
представляют собой массовые концентрации
компонентов а
и b
в смеси и удовлетворяют соотношению
![]() .
(2.47)
.
(2.47)
Парциальные
энтальпии компонентов газовых и жидких
смесей (количество теплоты в единице
массы компонента а
или b),
близких к идеальным (отсутствует заметная
теплота смешивания), равны значениям
энтальпий чистых веществ а
и b.
Энтальпия смеси h
(количество теплоты в единице массы
смеси) связана с величинами
![]() и
и
![]() соотношением
соотношением
![]() .
(2.48)
.
(2.48)
При смешивании компонент через контрольную поверхность пространства осуществляется перенос массы веществ а и b с разной интенсивностью. Количественной характеристикой таких процессов служит вектор плотности потока массы смеси (импульс единицы объема смеси), который складывается из векторов плотности потоков массы компонентов а и b. Вектор конвективной скорости движения смеси как сплошной среды (импульс единицы массы смеси) определяется отношением вектора плотности потока массы смеси к плотности смеси.
В случае фазовых смесей границы раздела фаз (в рамках представлений сплошной среды) интерпретируются как геометрические поверхности. Реальные межфазные границы - это тонкие переходные слои сложной структуры. Молекулы, составляющие переходный слой, взаимодействуют с молекулами обеих граничащих фаз, в силу чего свойства переходного слоя отличаются от свойств вещества в объемах фаз. Поэтому при интерпретации границы раздела фаз как геометрической поверхности ей приписываются некоторые феноменологические свойства.
Коэффициент теплопроводности смеси зависит от концентрации компонентов, а динамическая вязкость смеси - от вязкости чистых компонентов, концентрации и физической природы смеси. При смешивании идеальных газов параметры смеси определяют в соответствии с аддитивностью термодинамических величин газов, составляющих смесь.
