
- •А. П. Михайловская, е. С. Сашина, в. А. Голубихин
- •191028, Санкт-Петербург, ул. Моховая, 26 Введение
- •1. Токсикологическая характеристика растворителей
- •2. Пожароопасность растворителей
- •3. Правила безопасной работы с растворителями
- •4. Основные физические константы растворителей
- •Лабораторная работа № 1. Определение температуры кипения (ткип)
- •Лабораторная работа № 2. Определение относительной плотности (d420)
- •5. Летучесть органических растворителей
- •Лабораторная работа № 3. Измерение давления пара
- •6. Получение органических растворителей
- •Лабораторная работа № 4. Синтез циклогексанона
- •Лабораторная работа № 5. Синтез ацетона
- •Лабораторная работа № 6. Синтез хлороформа
- •Лабораторная работа № 7. Синтез диоксана
- •Лабораторная работа № 8. Синтез дибутилового эфира
- •7. Очистка растворителей
- •Лабораторная работа № 9. Контроль качества растворителей
- •8. Реакционная способность растворителей
- •Лабораторная работа № 10. Основные химические свойства растворителей
- •9. Определение растворимости
- •Лабораторная работа № 11. Определение вещества по его растворимости
- •Лабораторная работа № 12. Одно- и многокомпонентные растворители
- •10. Качественное определение растворимости полимеров
- •Лабораторная работа № 13. Растворимость синтетических карбоцепных полимеров
- •Лабораторная работа № 14. Растворимость целлюлозы и ее производных
- •11. Применение растворителей
- •Лабораторная работа № 15. Химическая чистка изделий с помощью растворителей
- •Краткие указания по приготовлению некоторых реактивов
- •Хлорное железо. Растворяют 17 г FeCl36 h2o в 1 л воды и добавляют 10 мл концентрированной соляной кислоты.
- •Библиографический список
8. Реакционная способность растворителей
В данном разделе вниманию студентов предлагаются только те химические свойства органических растворителей, которые характеризуют их растворяющую способность или могут служить для качественного анализа (цветные реакции) растворителей.
Лабораторная работа № 10. Основные химические свойства растворителей
Посуда и приборы: штатив с 13 пробирками, круглодонная колба, холодильник Либиха, водяная баня.
Реактивы: хлороформ, гидроксид натрия (2 н.), резорцин, β-нафтол, гидроксид калия (твердый), этиловый спирт, дистиллированная вода, сульфат меди (безводный), изопропиловый спирт, бутиловый спирт, амиловый спирт, подкрашенная вода, хромовая смесь, хлорное железо (0,1 н.), этиленгликоль, гидроксид натрия (10 %), сульфат меди (II) (5 %), ацетон, нитропруссид натрия (5 %), 2,40динитрофенилгидразин (3 %), гидросульфит натрия (?%).
Опыт 1. Цветные реакции хлороформа
В 1 мл 2 н. раствора гидроксида натрия растворяют кристалл резорцина. К раствору прибавляют 2–3 капли хлороформа и осторожно в течение нескольких секунд нагревают смесь на водяной бане.
Растворяют крупинку β-нафтола в 1 мл раствора щелочи, к раствору прибавляют 2-3 капли хлороформа и осторожно нагревают.
Отметьте происходящие изменения.
Опыт 2. Гидролиз хлороформа
В круглодонную колбу емкостью 20 мл, снабженную обратным холодильником, помещают 1 г гидроксида калия, растворенного в 5 мл этанола при нагревании на водяной бане. К охлажденному раствору щелочи добавляют 1 мл хлороформа, после чего колбу нагревают в течение 5 мин. Наблюдается быстрое выпадение осадка. Этот осадок должен растворяться в небольшом количестве (~2–3 мл) дистиллированной воды при нагревании.
![]()
Опыт 3. Присутствие воды в спирте-ректификате
Щепотку безводной соли сульфата меди добавляют к 2 мл спирта и встряхивают содержимое пробирки.
Отметьте изменение окраски раствора.
Опыт 4. Сопоставление растворимости спиртов в воде
В четыре пробирки наливают по 2–3 мл подкрашенной воды. Затем в первую пробирку добавляют 1 мл этилового спирта, во вторую – изопропилового, в третью – бутилового, в четвертую – амилового спиртов. Пробирки встряхивают и дают смесям отстояться.
Что в спиртах определяет их растворимость в воде?
Опыт 5. Окисление спирта хромовой смесью
Смешивают в пробирке 3 мл хромовой смеси и 0,5 мл изопропилового спирта и медленно нагревают смесь на водяной бане. (Внимание! Соблюдайте меры предосторожности работы с серной кислотой и сильными окислителями!)
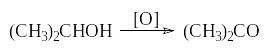
Отметьте изменение окраски.
Опыт 6. Реакция фенола с хлорным железом
Помещают в пробирку 0,5 мл водного раствора фенола, добавляют 0,5 мл 0,1 н раствора хлорного железа.
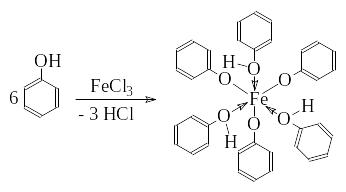
Опишите происходящие изменения.
Опыт 7. Взаимодействие этиленгликоля с гидроокисью меди
В пробирку наливают 2 мл 10%-го раствора гидроксида натрия и 0,5 мл 5 %-го раствора сульфата меди (II). Затем в пробирку добавляют 0,5 мл этиленгликоля и взбалтывают.

Опишите изменение окраски. Будет ли взаимодействовать с гидроксидом меди этиловый спирт, глицерин?
Опыт 8. Реакция ацетона с нитропруссидом натрия (проба Легаля)
В пробирку последовательно помещают 1 мл ацетона, 0,5 мл 5 %-го раствора нитропруссида натрия и 0,5 мл 10 %-го раствора гидроксида натрия.
Отметьте окраску содержимого в пробирке комплексного соединения.
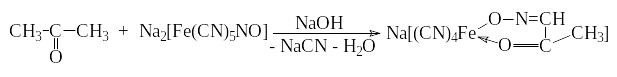
Опыт 9. Взаимодействие ацетона с 2,4-динитрофенилгидразином
В пробирку помещают 1 мл 3 %-го раствора 2,4-динитрофенил-гидразина и добавляют несколько капель ацетона.
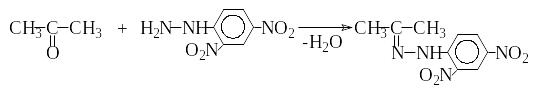
Опишите изменение окраски.
Опыт 10. Взаимодействие ацетона с гидросульфитом натрия
В пробирку наливают 1 мл ацетона и добавляют 5 мл гидросульфита натрия. Пробирку встряхивают.
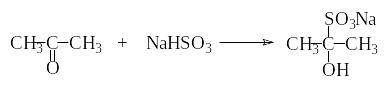
Опишите происходящие изменения.
