
- •Глава 8. Окислительно-восстановительные и электрохимические процессы
- •8.1. Окислительно-восстановительные реакции
- •Раздел I.
- •Раздел II
- •8.1.3. Лабораторная работа № 5 Окислительно-восстановительные реакции
- •Экспериментальная часть
- •8.2. Электродные процессы
- •3) Хлорный электрод.
- •Раздел I
- •Раздел II
- •8.3. Электрохимические системы
- •8.3.1.Химические источники тока.
- •8.3.1.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.1.2. Задания для текущих и промежуточных контролей.
- •8.3.2. Электролиз
- •8.3.2.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.2.2. Задания для текущих и промежуточных контролей.
- •8.3.3.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.3.2. Лабораторная работа №6
- •Теоретическое введение
- •Задания на ргр 3. Срок-15 мая 2014.
- •Задания на ргр 3. Срок-15 мая 2014.
Раздел I
Определите направления протекания окислительно-восстановительных процессов.
А. Определите, какое вещество в приведенных ниже парах веществ является более сильным окислителем:
HNO2; Br2 (
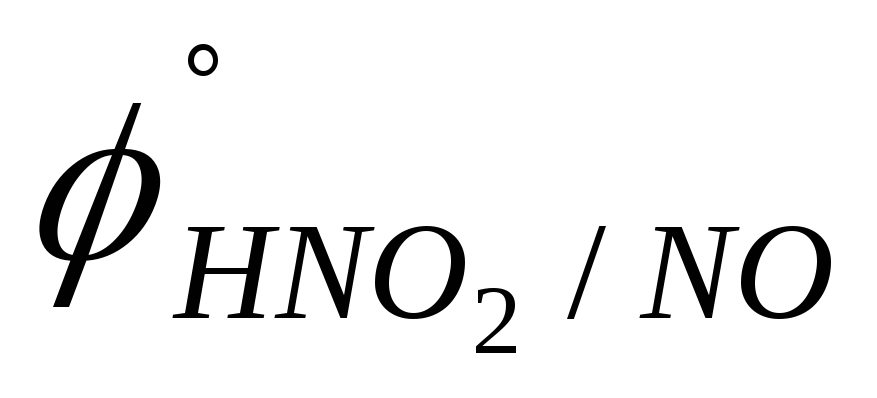 =
1,004
B;
=
1,004
B;
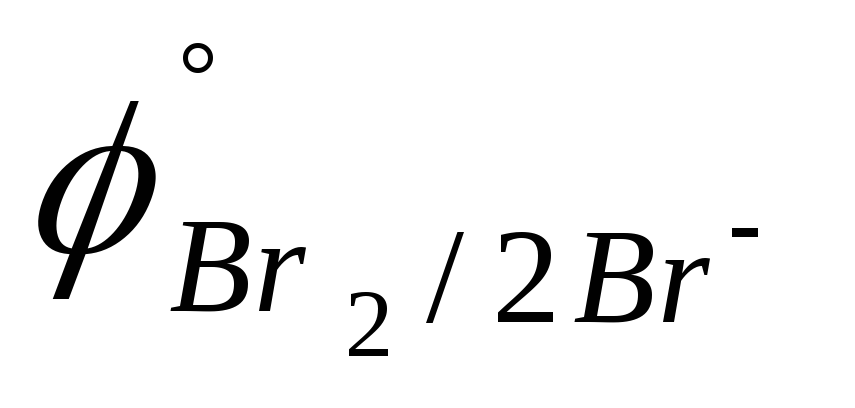 =
1,087
B).
=
1,087
B).HNO3; Bi3+ (
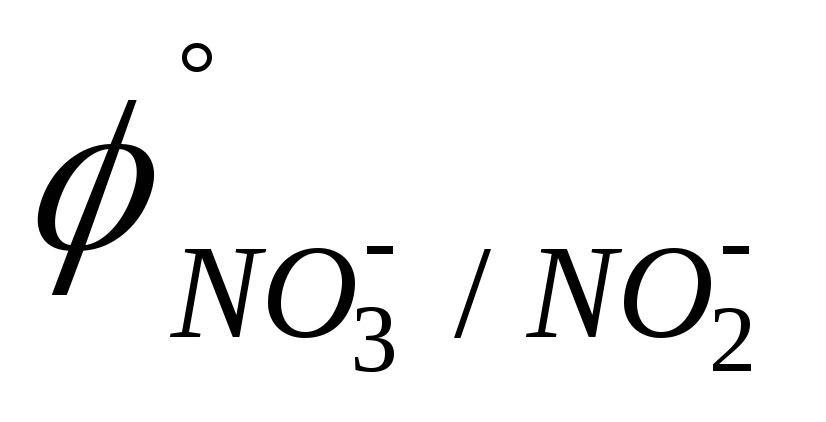 =
0,838
B;
=
0,838
B;
 =
0,317
B).
=
0,317
B).Cu2+; Fe3+ (
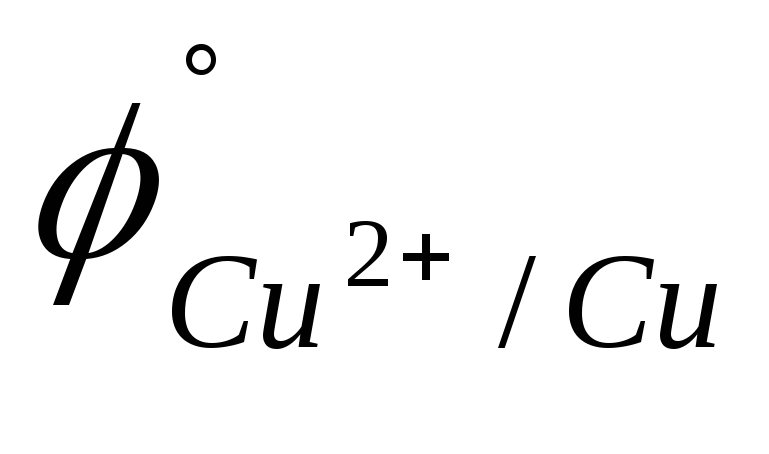 =
0,158
B;
=
0,158
B;
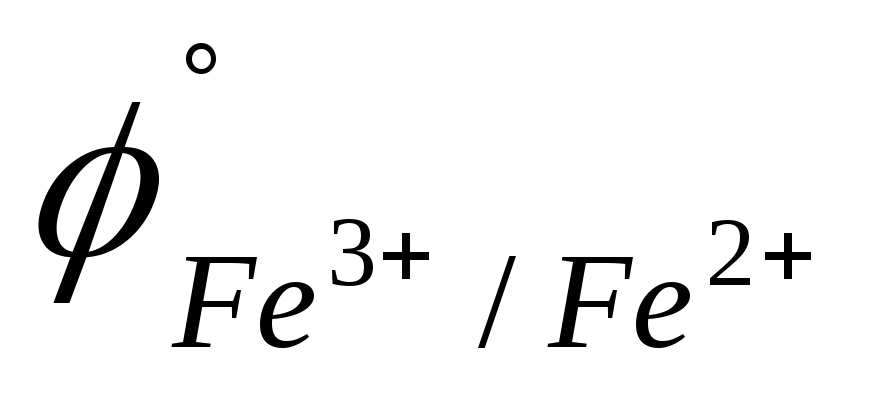 =
0,771
B).
=
0,771
B).HNO3; I2 (
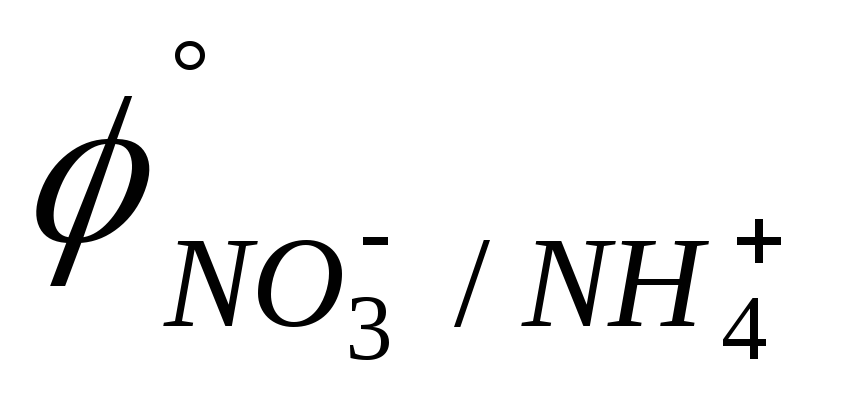 =
0,880 B;
=
0,880 B;
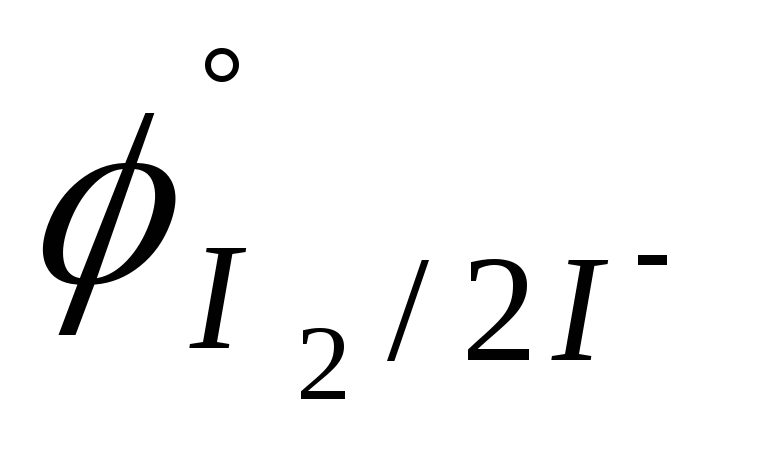 =
0,535 B).
=
0,535 B).HNO3; HClO (
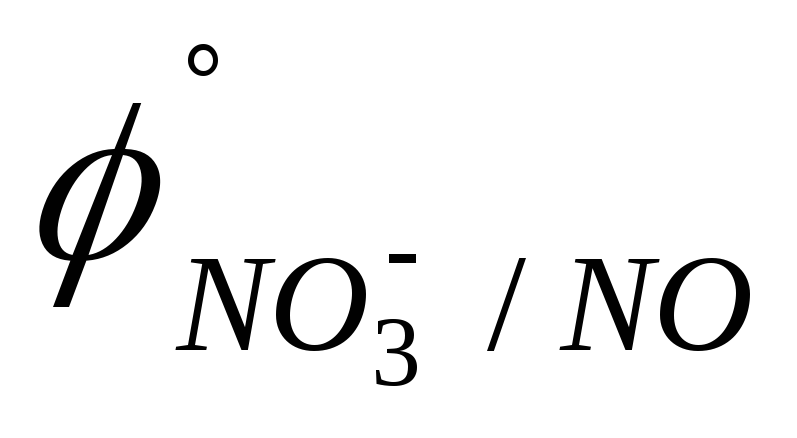 =
0,955
B;
=
0,955
B;
 =
1,494
B).
=
1,494
B).N2, Fe3+ (
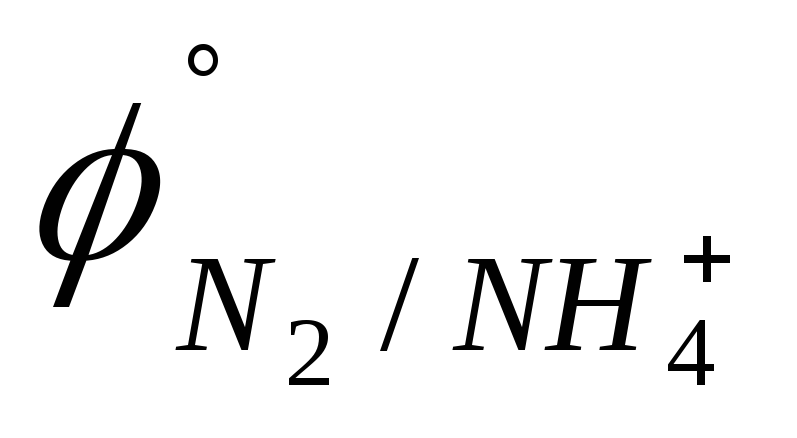 =
0,26 В;
=
0,26 В;
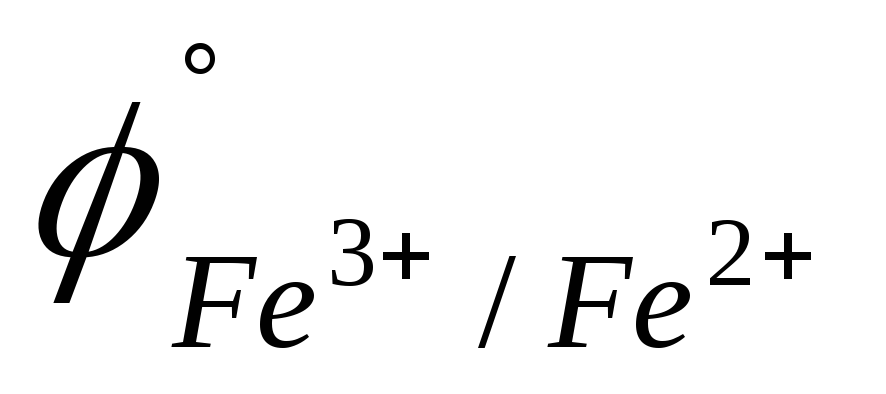 =
0,771 В).
=
0,771 В).
Б. Определите, какое вещество является более сильным восстановителем:
Mg или Zn (
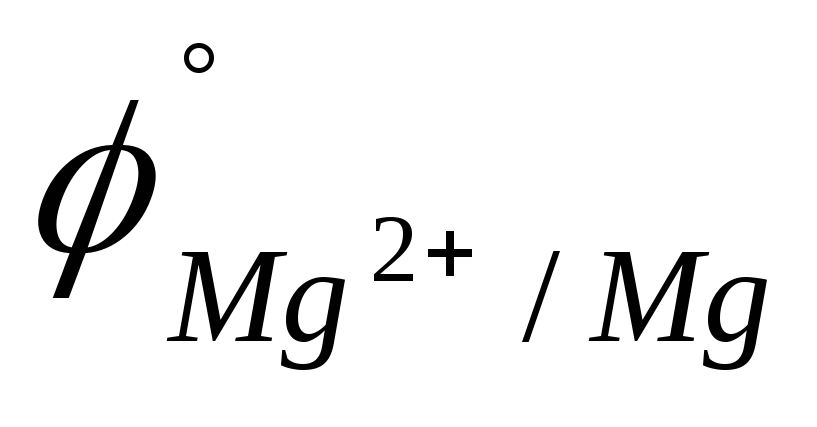 =
-2,370 B;
=
-2,370 B;
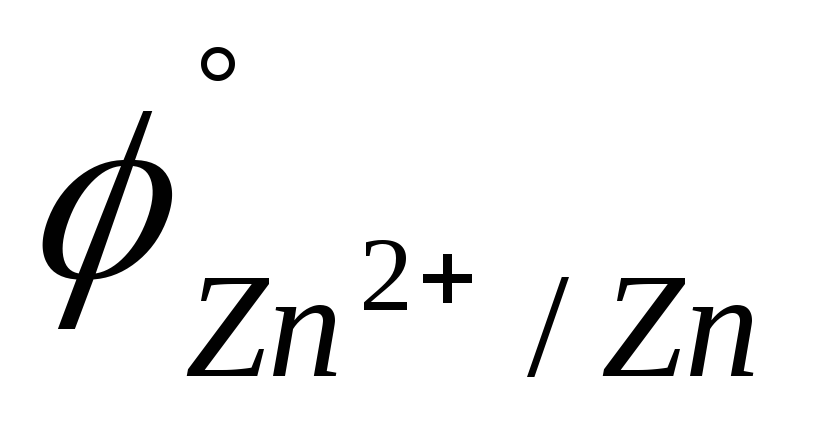 =
-0,763 B).
=
-0,763 B).H2S или H2 (
 =
0,144 B;
=
0,144 B;
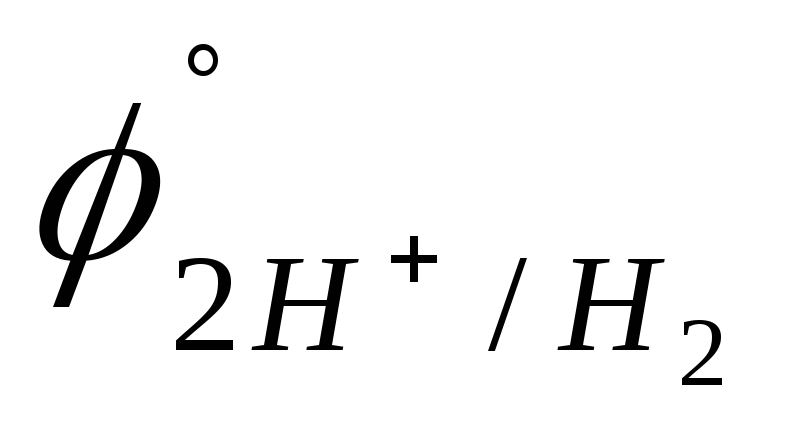 =
0,000
B).
=
0,000
B).SO2 или Cl2 (
 =
0,159
B;
=
0,159
B;
 =
0,476
B).
=
0,476
B).H2O2 или Cr (
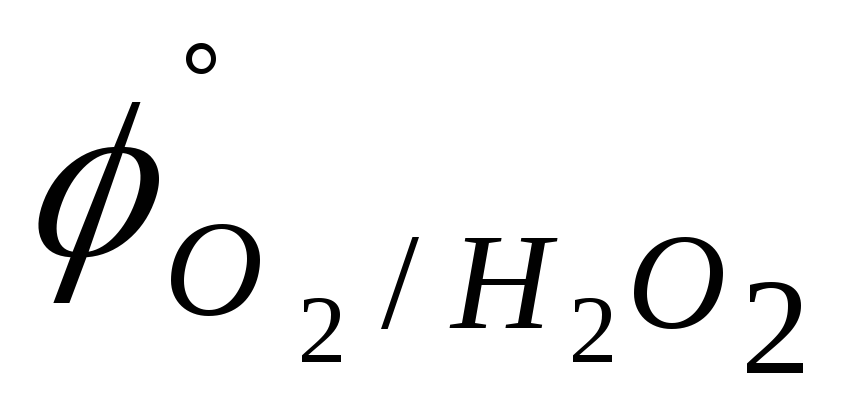 =
0,694
B;
=
0,694
B;
 =
-0,852
B).
=
-0,852
B).Pb или MnO2 (
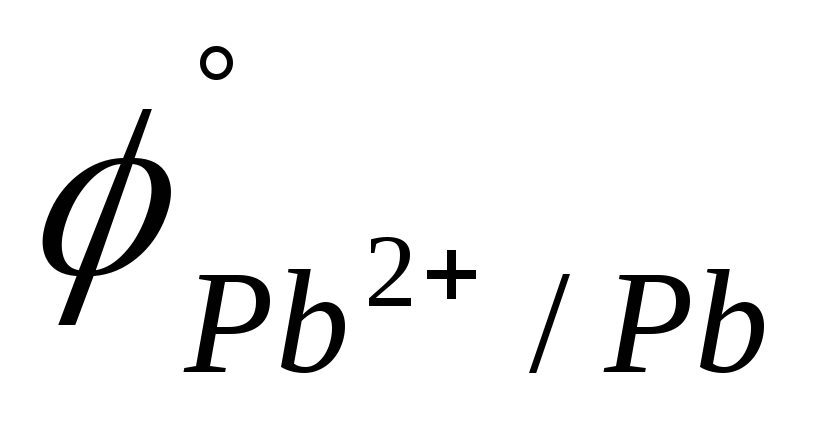 =
-0,126 B;
=
-0,126 B;
 =
0,621 B).
=
0,621 B).Fe или MnO2 (
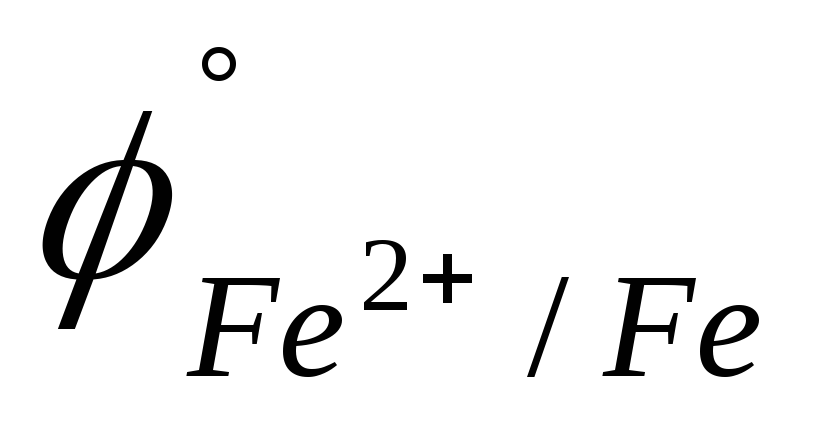 =
0,44 В;
=
0,44 В;
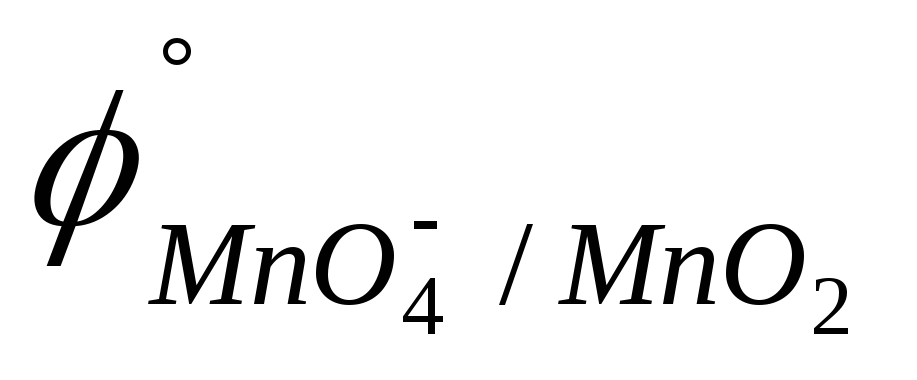 =
0,621 В).
=
0,621 В).
В. Определите, можно ли окислить первым из указанных в каждой паре веществом второе вещество:
HClO; Au (
 =
1,630
B;
=
1,630
B;
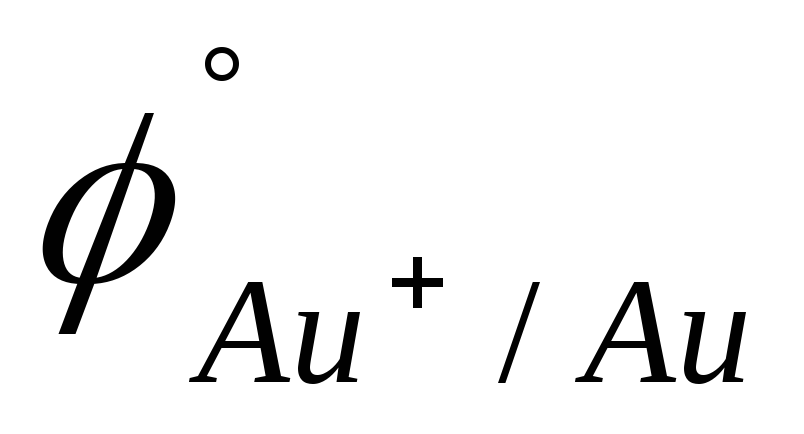 =
1,691
B).
=
1,691
B).MnO4-; Au (
 =
1,531
B;
=
1,531
B;
 =
1,498
B).
=
1,498
B).Cl2(г); Ag (
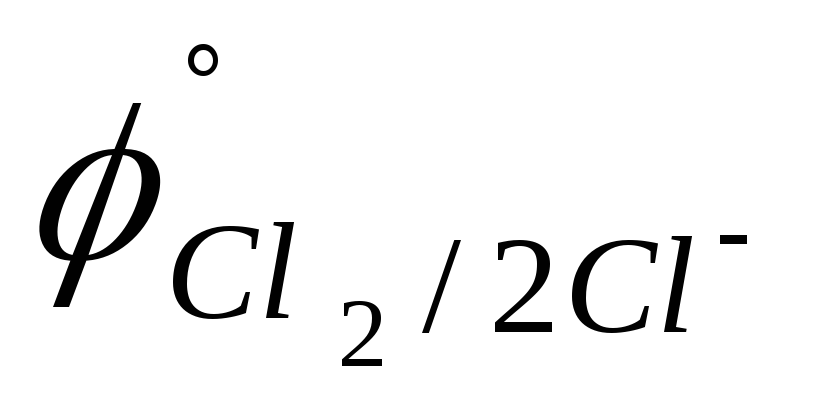 =
1,358 B;
=
1,358 B;
 =
0,779 B).
=
0,779 B).O2(г); Hg(ж) (
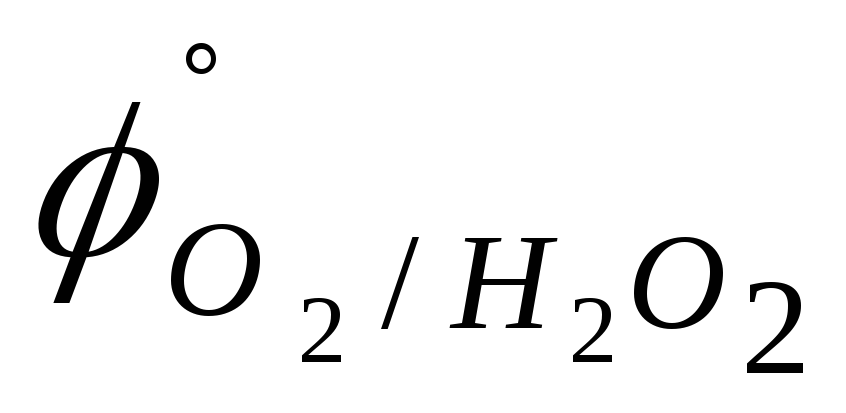 =
0,694 B;
=
0,694 B;
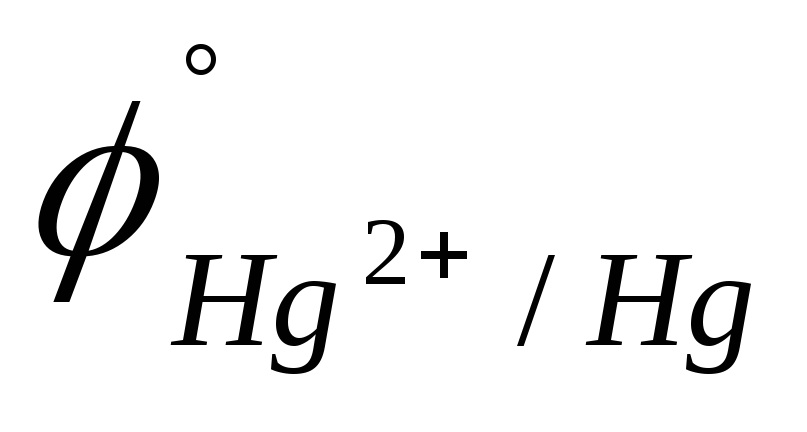 =
0,852 B).
=
0,852 B).SO42-; P(кр.) (
 =
-0,932
B;
=
-0,932
B;
![]() =
0,383
B).
=
0,383
B).
HBrO, Au (
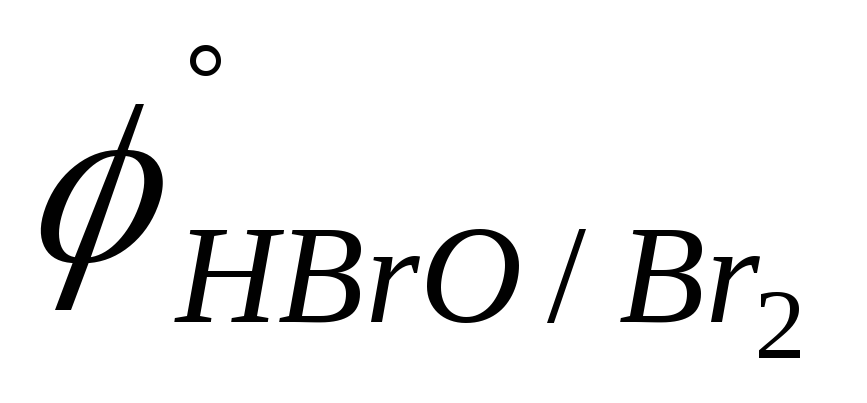 =
1,35 В;
=
1,35 В;
 =
1,42 В).
=
1,42 В).WO2, As (
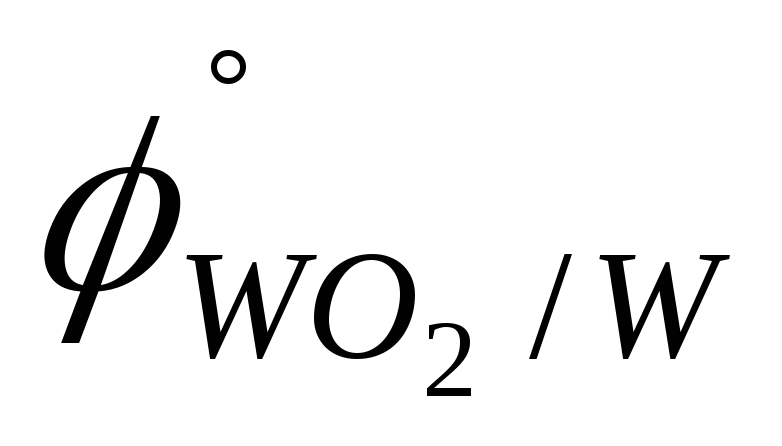 =
-0,05 В;
=
-0,05 В;
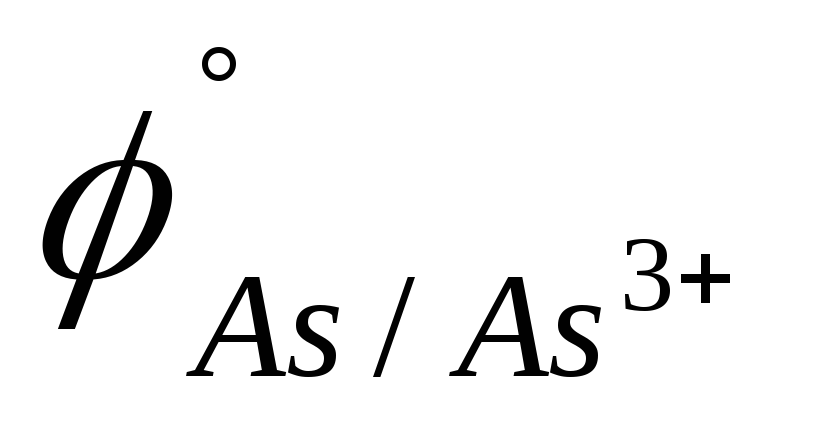 =
-0,54 В).
=
-0,54 В).BrO3-; IO3- (
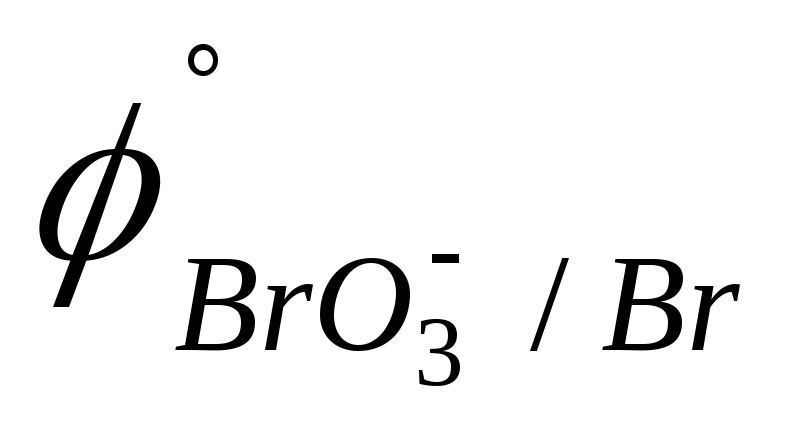 =
0,60
В;
=
0,60
В;
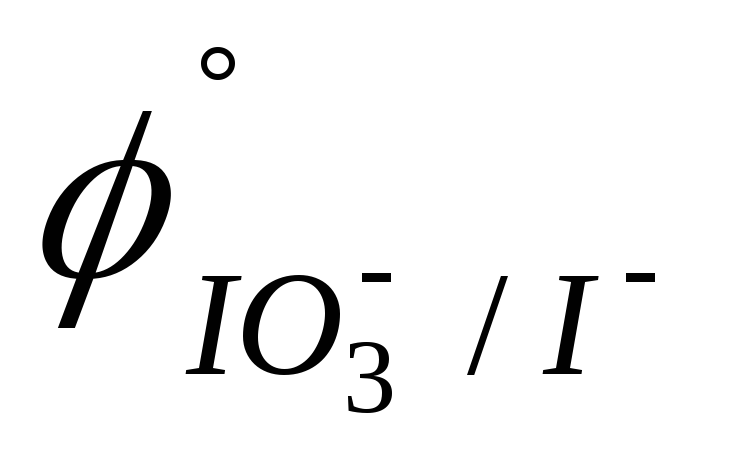 =
0,26 В).
=
0,26 В).
Г. Определите, можно ли осуществить следующие реакции:
Между Fe3+ и Сu с образованием ионов Fe2+ и Сu2+
(![]() =
0,771 B;
=
0,771 B;
![]() =
0,338 B).
=
0,338 B).
Между Fe и Сu2+ с образованием Cu
(![]() =
-0,441 B;
=
-0,441 B;
![]() =
0,338 B).
=
0,338 B).
Между KNO2 и KI с образованием I2
(![]() =
1,203 B;
=
1,203 B;
![]() =
0,535 B).
=
0,535 B).
Между KNO2 и КMnO4 с образованием KNO3 и MnSO4
(![]() =
0,838 B;
=
0,838 B;
![]() =
1,531 B).
=
1,531 B).
Между Na и Cl2 с образованием NaCl
(![]() =
-2,711 B;
=
-2,711 B;
![]() =
1,358 B).
=
1,358 B).
Между HClO и H2S с образованием элементарной серы (S)
(![]() =
1,494 B;
=
1,494 B;
![]() =
0,144 B).
=
0,144 B).
Между Na+ и Cl- c образованием Na и Cl2
(![]() =
-2,711 B;
=
-2,711 B;
![]() =
1,358 B).
=
1,358 B).
Между Al и очень разбавленной HNO3 c образованием Al3+ и NH4NO3
(![]() =
-1,700 B;
=
-1,700 B;
![]() =
0,880 B).
=
0,880 B).
Между Au и разбавленной HNO3 с образованием газообразного NO
(![]() =
1,498 B;
=
1,498 B;
![]() =
0,955 B).
=
0,955 B).
Между PbS и H2O2 с образованием Н2О и PbSO4
(![]() =
0,304 B;
=
0,304 B;
![]() =
1,764 B).
=
1,764 B).
Раздел II
Вычислите электродный потенциал системы Cu|CuSO4(0,1M) при температуре 25 С.
Ответ: 0,3075 В.
Вычислите электродный потенциал системы Ni|NiSO4(0,01M) при температуре 25 С.
Ответ: -0,295 В.
Вычислите электродный потенциал системы Fe|FeCl2(0,001M) при температуре 25 С.
Ответ: -0,5295 В.
Вычислите электродный потенциал системы Zn|ZnSO4(0,01М) при температуре 25 С.
Ответ: -0,82 В.
Вычислите электродный потенциал системы Cd|CdCl2(0,001М) при температуре 25 С.
Ответ: -0,4915 В.
Вычислите электродный потенциал водородного электрода в растворе с молярной концентрацией ионов водорода, равной 0,01 моль/л, при температуре 25 С.
Ответ: -0,118 В.
Вычислите электродный потенциал хлорного электрода в растворе с молярной концентрацией ионов хлора, равной 0,001 моль/л, при температуре 25 С.
Ответ: 1,535 В.
Вычислите электродный потенциал кислородного электрода в растворе с молярной концентрацией ионов водорода, равной 0,001 моль/л, при температуре 25 С.
Ответ: 1,053 В.
Вычислите электродный потенциал системы Ni|NiSO4(0,25M) при температуре 25 С, если кажущаяся степень диссоциации сульфата никеля равна 40 .
Ответ: -0,2655 В.
Вычислите электродный потенциал системы Cu|CuSO4(0,2М), если кажущаяся степень диссоциации сульфата меди при температуре 25 С равна 50 .
Ответ: 0,3075 В.
Электродный потенциал цинкового электрода в 0,2М растворе сульфата цинка при температуре 25 С равен -0,7905 В. Определите кажущуюся степень диссоциации сульфата цинка в этом растворе.
Ответ: 50 %.
Электродный потенциал системы Cu|CuSO4(0,25M) при температуре 25 С равен 0,3075 В. Чему равна кажущаяся степень диссоциации сульфата меди в этом растворе?
Ответ: 40 %.
Вычислите электродный потенциал водородного электрода в растворе с молярной концентрацией гидроксид-ионов, равной 0,001 моль/л, при температуре 25 С.
Ответ: -0,649 В.
Вычислите электродный потенциал кислородного электрода в растворе с молярной концентрацией гидроксид-ионов, равной 0,001 моль/л, при температуре 25 С.
Ответ: 0,581 В.
Определите концентрацию ионов водорода в растворе, в котором электродный потенциал водородного электрода равен -0,177 В при температуре 25 С.
Ответ: 10-3 моль/л.
Определите концентрацию ионов хлора в растворе, в котором электродный потенциал хлорного электрода при температуре 25 С равен 1,299 В.
Ответ: 0,1 моль/л.
Вычислите электродный потенциал водородного электрода в растворе с рН=12 при температуре 25 С.
Ответ: -0,708 В.
Вычислите электродный потенциал кислородного электрода в растворе с рН=10 при температуре 25 С.
Ответ: 0,64 В.
Электродный потенциал водородного электрода в 0,002М растворе соляной кислоты при температуре 25 С равен -0,177 В. Чему равна кажущаяся степень диссоциации соляной кислоты в указанном растворе?
Ответ: 50 %.
Электродный потенциал водородного электрода в 0,0002М растворе гидроксида натрия при температуре 25 С равен -0,59 В. Чему равна кажущаяся степень диссоциации гидроксида натрия в указанном растворе.
Ответ: 50 %.
Электродный потенциал кислородного электрода в 0,025М растворе серной кислоты при температуре 25 С равен 1,112 В. Чему равна кажущаяся степень диссоциации серной кислоты в указанном растворе.
Ответ: 20 %.
Электродный потенциал кислородного электрода в 0,025М растворе гидроксида калия при температуре 25 С равен 0,522 В.Чему равна кажущаяся степень диссоциации гидроксида калия в указанном растворе.
Ответ: 40 %.
Электродный потенциал алюминиевого электрода в растворе сульфата алюминия при температуре 25 С равен -1,6817 В. Какова молярная концентрация сульфата алюминия, если кажущаяся степень диссоциации соли равна 0,5.
Ответ: 0,1 моль/л.
Вычислите электродный потенциал системы Cu|CuSO4(0,04н) при температуре 25С, если кажущаяся степень диссоциации сульфата меди равна 0,5.
Ответ: 0,278 В.
Вычислите электродный потенциал системы Ni|NiSO4(0,5н) при температуре 25 С если кажущаяся степень диссоциации сульфата никеля равна 40 .
Ответ: -0,2655 В.
26. Вычислите электродный потенциал свинцового электрода в насыщенном растворе бромида свинца, если концентрация ионов брома в растворе равна 0,009 моль/л, а ПР(PbBr2) = 8,110-6.
Ответ:-0,1555 В.
27. Электродный потенциал системы Pt,H2|NaOH(x моль/л) при температуре 25 С равен -0,767 В. Какова молярная концентрация эквивалентов едкого натра, если степень диссоциации гидроксида натрия в растворе равна 1.
Ответ: 0,1 моль/л.
28. Электродный потенциал системы Pt,H2|HCl(x моль/л) при температуре 25 С равен -0,118 В. Какова молярная концентрация эквивалентов соляной кислоты, если степень диссоциации соляной кислоты в растворе равна 1.
Ответ: 0,01 моль/л.
29. Вычислите электродный потенциал системы Zn|ZnSO4 (0,002н) при температуре 25 С.
Ответ: -0,8495 В.
30. Вычислите электродный потенциал системы Al|Al2(SO4)3 (0,006н) при температуре 25С, если кажущаяся степень диссоциации сульфата алюминия равна 50 .
Ответ: -1,721 В.
