
8041
.pdf30
и, следовательно, основное уравнение первого закона, выраженное через
энтальпию, имеет вид
dq di vdp. |
(59) |
Для идеальных газов |
|
di cd dT . |
|
Следовательно, |
|
T |
|
i cpdT cpmT , |
(60) |
0 |
где cpm – средняя массовая теплоемкость при постоянном давлении в пределах от 0 до T.
В теплотехнических расчетах обычно требуется знать изменение энтальпии, а не ее абсолютное значение, поэтому начало отсчета (0 К или 0 °С)
для конечного результата (Δi) не имеет значения. |
|
Интегрируя уравнение (59) при р = const, получаем |
|
qp i2 i1. |
(61) |
Таким образом, количество теплоты в процессе р = const численно можно найти как разность энтальпии конечного и начального состояния.
5.2 Смешение газов
При смешении химически невзаимодействующих газов, имеющих различные давления и температуры, обычно приходится определять конечное состояние смеси. При этом различают два случая.
1. Смешение газов при V = const. Если суммарный объем, занимаемый газами до и после смешения, остается неизменным и газы до смешения занимают объемы V1, V2, …, Vn м3 при давлениях р1, р2, …, рп и температурах
Тl, Т2, …, Тп, а отношения теплоемкостей этих газов ср/сv равны k1, k2, …, kn, то параметры смеси определяют по формулам:
31
Температура
|
|
|
|
n |
|
p V |
|
|
||
|
|
|
|
|
i i |
|
|
|
||
|
|
|
ki 1 |
|
|
|||||
T |
|
|
1 |
|
; |
|||||
n |
|
|
|
piVi |
|
|||||
|
|
|
|
|
|
|
||||
|
|
(ki 1)Ti |
|
|
||||||
|
1 |
|
|
|
||||||
Давление |
|
|
|
|
|
|
|
|
|
|
|
T |
|
n |
|
p V |
|
|
|||
p |
|
|
|
|
|
i i |
; |
|
|
|
|
|
|
|
|
|
|||||
|
V |
|
1 |
|
Ti |
|
|
|||
Объем
n
V Vi .
1
(62)
(63)
Для газов, у которых мольные теплоемкости равны, а следовательно,
равны и значения k, формулы (62) и (63) принимают вид
|
|
n |
|
|
|
|
|
|
piVi |
|
|
|
|||
T |
1 |
|
|
; |
|
||
|
n |
p V |
|
||||
|
|
|
|
|
|||
|
|
i i |
|
|
|
|
|
|
Ti |
|
|
|
|||
|
1 |
|
|
(64) |
|||
|
|
n |
|
|
|
|
|
|
|
piVi |
|
|
|
||
p |
1 |
|
|
|
. |
(65) |
|
|
V |
|
|||||
|
|
|
|
|
|
||
2. Смешение газовых потоков. Если массовые расходы смешивающихся потоков равны M1, М2, …, Мn кг/ч, объемные расходы – V1, V2, …, Vn м3/ч,
давления газов – р1, р2, …, рп, температуры – Тl, Т2, …, Тп, а отношения теплоемкостей отдельных газов равны соответственно k1, k2, …, kn, то температуры смеси определяют по формуле
|
|
|
|
ki |
p V |
|
|||||||
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i i |
|
|||||
|
1 ki 1 |
|
|||||||||||
T |
|
|
|
|
|
|
|
|
|
|
. |
(66) |
|
n |
|
ki |
|
|
|
||||||||
|
|
|
piVi |
|
|
||||||||
|
ki |
|
1 |
Ti |
|
||||||||
|
1 |
|
|
||||||||||
Объемный расход смеси в единицу времени при температуре Т и |
|||||||||||||
давлении р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
n p V |
|
|||||||
V |
|
|
|
|
|
i i |
. |
(67) |
|||||
|
|
|
|
|
|||||||||
|
|
|
p 1 |
Ti |
|
||||||||

32
Для газов, у которых значения k равны, температуру смеси определяют по формуле (64). Если газовые потоки, помимо одинаковых значений k, имеют также равные давления, то формулы (66) и (67) принимают вид
|
n |
|
|
|
|
|
|
|
Vi |
|
|
|
|||
T |
1 |
|
|
|
; |
|
|
n |
V |
|
|||||
|
|
|
|
||||
|
|
|
i |
|
|
|
|
|
Ti |
|
|
|
|||
|
1 |
|
|
(68) |
|||
V T |
Vi |
. |
(69) |
||||
|
|||||||
|
|
|
T |
|
|
|
|
|
|
|
i |
|
|
|
|
Все уравнения, относящиеся к смешению газов, выведены при условии отсутствия теплообмена с окружающей средой.
Задача
В котельной электрической станции за 20 ч работы сожжены 62 т
каменного угля, имеющего теплоту сгорания 28900 кДж/кг.
Определить среднюю мощность станции, если в электрическую энергию превращено 18 % теплоты, полученной при сгорании угля.
Решение
Количество теплоты, превращенной в электрическую энергию за 20 ч
работы,
Q 62 1000 28900 0,18 322524000 кДж.
Эквивалентная ему электрическая энергия или работа
62 1000 28900 0,18 L 89590 кВт ч.
3600
Следовательно, средняя электрическая мощность станции
89500
N 4479 кВт. 20
33
6. ОСНОВНЫЕ ГАЗОВЫЕ ПРОЦЕССЫ
Основными термодинамическими процессами являются:
1) процесс сообщения или отнятия теплоты при постоянном объеме газа
(v = const) – изохорный процесс;
2) процесс сообщения или отнятия теплоты при постоянном давлении
(р =const) – изобарный процесс;
3) процесс сообщения или отнятия теплоты при постоянной температуре
(t = const) – изотермический процессе:
4) процесс без сообщения или отнятия теплоты извне (dq = 0) –
адиабатный процесс;
5) процесс, в котором изменение параметров подчиняется уравнению
pvm const,
где m – величина, постоянная для данного процесса, – политропный процесс.
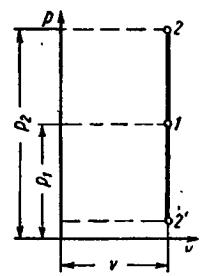
6.1Изохорный процесс
Вдиаграмме p-v этот процесс изображается прямой 1-2, параллельной оси ординат. Уравнение прямой 1-2 (рис. 4), называемой изохорой,
vconst.
Рис. 4
34
Зависимость между начальными и конечными параметрами процесса
|
|
|
|
p1 |
|
|
T1 |
. |
|
|
|
|
(70) |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
p2 |
|
|
T2 |
|
|
|
|
|
||
Изменение внутренней энергии |
|
|
|
|
|
|
|
|
|
|
||||
|
|
uv qv cv/n (t2 |
t1). |
|
|
|
(71) |
|||||||
Если в процессе участвует М кг или Vн м3 газа, то количество теплоты или |
||||||||||||||
изменение внутренней энергии газа |
|
|
|
|
|
|
|
|
|
|
||||
Q |
U |
v |
Mc (t |
2 |
t ) V c |
(t |
2 |
t ), |
(72) |
|||||
v |
|
vm |
|
1 |
н vm |
|
1 |
|
||||||
где Vн – количество газа в м3 при нормальных условиях.
Если количество теплоты необходимо подсчитать, пользуясь нелинейной зависимостью теплоемкости от температуры, то следует пользоваться формулой (41) или (43).
В изохорном процессе газ работы не совершает (L = 0).
Задача
В закрытом сосуде емкостью V = 0,6 м3 содержится воздух при давлении
р1 = 0,5 МПа и температуре t1 = 20° С. В результате охлаждения сосуда воздух,
содержащийся в нем, теряет 105 кДж.
Принимая теплоемкость воздуха постоянной, определить, какое давление и какая температура устанавливаются после этого в сосуде.
Решение
Пользуясь уравнением состояния, находим массу воздуха в сосуде:
M |
pV |
|
0,5 106 0,6 |
3,57 кг. |
||
RT |
287 |
293 |
||||
|
|
|
||||
Количество теплоты, отводимой от воздуха в процессе, определяется уравнением (72):
Q Mcvm (t2 t1),
откуда

|
|
|
|
|
|
|
35 |
t |
|
|
Q |
t |
|
105 |
20 40,7 20 20,7 C. |
2 |
|
|
|||||
|
|
Mcvm |
1 |
|
3,57 0,723 |
|
|
|
|
|
|
|
|
Значение сvт = 0,723 получено из выражения cvm μcμvm 28,9620,93 (для
двухатомных газов).
Из соотношения параметров в изохорном процессе имеем
p |
p |
T2 |
0,5 |
273 20,7 |
0, 43 МПа. |
|
|
||||
2 |
1 T |
|
293 |
|
|
|
|
1 |
|
|
|
6.2Изобарный процесс
Вдиаграмме p-v этот процесс изображается прямой 1-2, параллельной оси
абсцисс. Уравнение прямой 1-2 (рис. 3), называемой изобарой, p const.
Зависимость между начальными и конечными параметрами процесса
|
v1 |
|
T1 |
. |
|
|
|
|
|
||
|
v 2 |
T2 |
(73) |
||
Работа 1 кг газа |
|
|
|
||
l p(v2 |
v1) |
(74) |
|||
или |
|
|
|
||
l R(T2 |
T1). |
(75) |
|||
Рис. 3
36
Для М кг газа
L Mp(v2 |
v1) p(V2 V1) |
(76) |
или |
|
|
L MR(t2 t1). |
(77) |
|
Если в процессе р = const участвует М кг или Vн м3 газа, то количество |
||
теплоты |
|
|
Qp Mcpm (t2 |
t1) Vнсpm (t2 t1), |
(78) |
где Vн – количество газа в м3 при нормальных условиях.
Если количество теплоты необходимо подсчитать, пользуясь нелинейной зависимостью теплоемкости от температуры, то следует пользоваться формулой (42) или (44).
Изменение внутренней энергии газа определяют по формуле (71) или (41).
Задача
Какое количество теплоты необходимо затратить, чтобы нагреть 2 м3
воздуха при постоянном избыточном давлении р = 0,2 МПа от t1 = 100 °С до t2 = 500 °С? Какую работу при этом совершит воздух? Давление атмосферы принять равным 101325 Па.
Решение
Согласно уравнению (42):
qp cpm2t2 cpm1t1.
Определяем теплоемкости воздуха по справочным данным cpm1 1,0061 кДж/ (кг К); cpm2 1,0387 кДж/ (кг К).
Следовательно,
qp 1,0387 500 1,0061 100 418,7 кДж/ кг.
Массу воздуха определяем из характеристического уравнения
|
|
|
37 |
|
|
M |
pV |
|
(0, 2 0,1013) 106 2 |
5,63 кг. |
|
RT |
287 373 |
||||
|
|
|
Таким образом,
Qp Mqp 5,63 418,7 2357 кДж.
Количество теплоты можно получить не только по массе воздуха, но и по его объему. В этом случае уравнение (42) следует написать так:
qp cpm2t2 cpm1t1.
Пользуясь справочными данными, получаем
c |
(c |
)100 |
1,3004 |
кДж/ (м3 К); |
|
pm1 |
pm1 |
|
0 |
|
|
c |
(c |
|
)500 |
1,3427 |
кДж/ (м3 К). |
pm2 |
pm2 |
0 |
|
|
|
Тогда
qp 1,3427 500 1,3004 100 541,4 кДж/ м3 .
Объем воздуха должен быть приведен к нормальным условиям. Согласно уравнению (22)
V |
pVTн |
|
0,3013 2 273 |
4,35 м3 . |
|
|
|||
н |
Tpн |
373 0,1013 |
||
|
||||
Таким образом,
Qp qpVн 541,4 4,35 2356 кДж.
Работа газа по уравнению (77)
L MR(t2 t1) 5,63 287 400 646,3 кДж.
6.3 Изотермический процесс
Кривая изотермического процесса, называемая изотермой, в
диаграмме p-v изображается равнобокой гиперболой (рис. 5). Уравнение изотермы в координатах p-v
pv const.
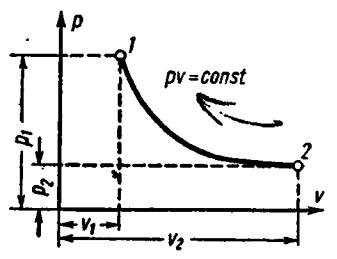
38
Рис. 5
Зависимость между начальными и конечными параметрами
определяется формулами: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
p1 |
|
v2 |
; |
|
|
|
(79) |
|||||||
|
|
|
|
|
|
||||||||||
|
p2 |
|
|
v1 |
|
||||||||||
|
p1 |
|
|
V2 |
. |
|
|
|
(80) |
||||||
|
|
|
|
|
|
|
|||||||||
|
p2 |
|
|
V1 |
|
||||||||||
Работу 1 кг идеального газа находят из уравнений: |
|||||||||||||||
l RT ln |
v2 |
; |
|||||||||||||
v1 |
|||||||||||||||
|
|
|
|
|
|
|
|
(81) |
|||||||
l RT ln |
|
|
|
p1 |
; |
||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
p2 |
(82) |
||||||||
l p v ln |
v2 |
|
|
; |
|||||||||||
|
|||||||||||||||
1 |
1 |
|
|
|
|
v1 |
|
||||||||
|
|
|
|
|
|
|
|
(83) |
|||||||
l p v ln |
p1 |
. |
|||||||||||||
|
|||||||||||||||
1 |
1 |
|
|
|
p2 |
|
|||||||||
|
|
|
|
|
|
|
(84) |
||||||||
Если в процессе участвуют М кг газа, то полученные из формул (81) -
(84) значения нужно увеличить в М раз. Можно также для этого случая в формулах (83) и (84) заменить удельный объем v полным объемом V. Тогда получим
39
L p V ln |
v2 |
; |
(85) |
|||
|
||||||
1 |
1 |
|
v1 |
|
|
|
|
|
|
|
|
|
|
L p V ln |
p1 |
. |
(86) |
|||
|
||||||
1 |
1 |
|
p2 |
|
|
|
|
|
|
|
|
|
|
Так как в изотермическом процессе t = const, то для идеального газа
u cvm (t2 t1) 0. |
|
Количество теплоты, сообщаемой газу или отнимаемой от него, |
|
qt l |
(87) |
или для М кг газа |
|
Qt L. |
(88) |
Натуральный логарифм, входящий в формулы, может быть заменен десятичным по соотношению
ln N 2,303lg N.
Задача
1 кг воздуха при температуре t1 = 30 °С и начальном давлении р1 = 0,1 МПа сжимается изотермически до конечного давления р2 = 1 МПа.
Определить конечный объем, затрачиваемую работу и количество теплоты, отводимой от газа.
Решение
Найдем начальный объем воздуха из уравнения состояния:
v |
RT1 |
|
287 303 |
0,87 м3 / кг. |
|
|
|||
1 |
p |
|
0,1 106 |
|
|
|
|||
|
1 |
|
|
|
Так как в изотермическом процессе p1v1 p2v2 ,
то конечный объем
v |
v |
p1 |
0,87 |
1 |
0,087 м3 / кг. |
|
|
|
|
||||
2 |
1 p |
|
10 |
|
||
|
|
2 |
|
|
|
|
Работа, затрачиваемая на сжатие 1 кг воздуха, получается из уравнения
