
- •ГЛАВА 1
- •ГЛАВА 2
- •МОРФОЛОГИЯ РАНЕВОГО ПРОЦЕССА
- •2.2.1 МОРФОЛОГИЯ ОГНЕСТРЕЛЬНОЙ РАНЫ
- •2.2.2. МОРФОЛОГИЯ ГНОЙНОЙ РАНЫ, ЗАКРЫТОЙ ШВАМИ
- •ГЛАВА 3
- •3. 1. МИКРОЦИРКУЛЯЦИЯ ПРИ РАНЕВОМ ПРОЦЕССЕ
- •3.2.1 КАЛЛИКРЕИН-КИНИНОВАЯ СИСТЕМА
- •3.2.2. БИОГЕННЫЕ АМИНЫ
- •3.2.3 СИСТЕМА КОМПЛЕМЕНТА
- •3.3. ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ В РАНЕ
- •3.3.2. ГЛИКОЗАМИНОГЛИКАНЫ (МУКОПОЛИСАХАРИДЫ)
- •ГЛАВА 4
- •СИСТЕМА ГЕМОСТАЗА ПРИ РАНЕВОЙ ИНФЕКЦИИ
- •4.1. РОЛЬ ОБЩИХ И МЕСТНЫХ ФАКТОРОВ ГЕМОСТАЗА ПРИ РАНЕВОМ ПРОЦЕССЕ
- •4.2. ЛОКАЛЬНАЯ ГНОЙНАЯ ИНФЕКЦИЯ И СИСТЕМА ГЕМОКОАГУЛЯЦИИ
- •4.3. ХИРУРГИЧЕСКИЙ СЕПСИС И СИСТЕМА ГЕМОКОАГУЛЯЦИИ
- •ГЛАВА 5
- •5.1. МИКРОБИОЛОГИЧЕСКИЕ АСПЕКТЫ РАНЕВОЙ ИНФЕКЦИИ
- •5.2.3. СЛУЧАЙНЫЕ РАНЫ
- •5.3. ХАРАКТЕРИСТИКА ОСНОВНЫХ ВОЗБУДИТЕЛЕЙ РАНЕВОЙ ИНФЕКЦИИ
- •5.4. КОМПЛЕКСНОЕ БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ БИОПТАТОВ ГНОЙНЫХ РАН
- •5.4.1. БАКТЕРИОЛОГИЧЕСКИЙ КОНТРОЛЬ МИКРОФЛОРЫ ПРИ ХИРУРГИЧЕСКОЙ ОБРАБОТКЕ ГНОЙНЫХ РАН
- •ГЛАВА 6
- •6.2.2. ОПСОНИЗАЦИЯ
- •6.2.3. ФАГОЦИТОЗ
- •6.2.4. ФУНКЦИЯ ЛИМФОЦИТОВ
- •6.2.5. СЫВОРОТОЧНЫЕ ФАКТОРЫ
- •ГЛАВА 7
- •КЛИНИКА РАНЕВОГО ПРОЦЕССА
- •7.1. КЛАССИФИКАЦИЯ РАН
- •7.2. КЛАССИФИКАЦИЯ РАНЕВОГО ПРОЦЕССА
- •7.4. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •7.4.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.4.2. СКОРОСТЬ ЗАЖИВЛЕНИЯ РАНЫ
- •7.4.3. БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
- •7.4.5. МЕСТНАЯ ГЕМОСТАТИЧЕСКАЯ РЕАКЦИЯ
- •7.4.6. БИОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ РАНЕВОГО ЭКССУДАТА
- •7.4.7. ИССЛЕДОВАНИЕ ЭЛЕКТРОПОТЕНЦИАЛОВ ОБЛАСТИ РАНЫ
- •7.4.8. ИНФРАКРАСНАЯ ТЕРМОГРАФИЯ РАНЫ
- •7.4.9. СОСТОЯНИЕ МИКРОЦИРКУЛЯЦИИ
- •7.4.10. КРИТЕРИИ ЖИЗНЕСПОСОБНОСТИ ТКАНЕЙ РАНЫ
- •7.4.11. СИЛА НАТЯЖЕНИЯ РАНЫ
- •7.4.12. НАПРЯЖЕНИЕ РЕСПИРАТОРНЫХ ГАЗОВ В ОБЛАСТИ РАНЫ
- •7.4.14. ФЕРМЕНТАТИВНЫЕ ИЗМЕНЕНИЯ
- •7.5. ЗАЖИВЛЕНИЕ РАНЫ ПЕРВИЧНЫМ НАТЯЖЕНИЕМ
- •7.5.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.6. ЗАЖИВЛЕНИЕ ГНОЙНОЙ РАНЫ, ЗАКРЫТОЙ ШВАМИ
- •7.6.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.6.2. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •7.7 ЗАЖИВЛЕНИЕ РАНЫ ВТОРИЧНЫМ НАТЯЖЕНИЕМ
- •7.7.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.7.2. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •ГЛАВА 8
- •МЕСТНОЕ ЛЕЧЕНИЕ ГНОЙНЫХ РАН
- •8.1. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •8.1.1. ХИРУРГИЧЕСКАЯ ОБРАБОТКА ГНОЙНОЙ РАНЫ
- •8.1.1.1. Терминология и основные понятия
- •8.1.1.3. Предоперационная подготовка и обезболивание
- •8.1.1.4. Техника хирургической обработки гнойного очага
- •8.1.2.3. Обработка гнойной раны лучами лазера
- •8.1.2.4. Обработка гнойной раны ультразвуком
- •8.1.4. ЗАКРЫТИЕ ГНОЙНОЙ РАНЫ
- •8.1.4.1. Наложение швов на гнойную рану
- •8.1.4.2. Кожная пластика гнойной раны
- •8.2. МЕСТНАЯ ЛЕКАРСТВЕННАЯ ТЕРАПИЯ
- •8.2.1. ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ГНОЙНОЙ РАНЫ В I ФАЗЕ РАНЕВОГО ПРОЦЕССА
- •8.2.1.1. Антимикробные препараты
- •8.2.1.2. Некролитические препараты
- •8.2.2. ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ГНОЙНОЙ РАНЫ ВО II ФАЗЕ РАНЕВОГО ПРОЦЕССА
- •ОБЩЕЕ ЛЕЧЕНИЕ РАНЕВОЙ ИНФЕКЦИИ
- •9.1 ХИМИОТЕРАПИЯ РАНЕВОЙ ИНФЕКЦИИ
- •9.1.2. ВЫБОР АНТИБИОТИКА
- •9.1.3. КРИТЕРИИ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
- •9.1.4. ОСЛОЖНЕНИЯ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
- •9.2. ИММУНОТЕРАПИЯ РАНЕВОЙ ИНФЕКЦИИ
- •9.2.1. ОБЩИЕ ПРИНЦИПЫ ИММУНОТЕРАПИИ ГНОЙНОЙ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
- •9.2.3. ИММУНОКОРРЕКЦИЯ КЛЕТОЧНЫМИ ПРЕПАРАТАМИ КРОВИ
- •9.2.4. АКТИВНАЯ ИММУНИЗАЦИЯ
- •9.2.5. ИММУНОМОДУЛЯЦИЯ
- •9.3.2. ПРИМЕНЕНИЕ ИНГИБИТОРОВ ПРОТЕАЗ
- •9.3.4. ПРИМЕНЕНИЕ ГЕМОСТАТИЧЕСКИХ ПРЕПАРАТОВ
- •10.1. ИСТОРИЯ ВОПРОСА
- •10.2. МЕТОДИКА ЛЕЧЕНИЯ
- •10.4. ЛЕЧЕНИЕ РАН РАЗЛИЧНОЙ ЭТИОЛОГИИ
- •10.4.1. ОБШИРНЫЕ ГНОЙНЫЕ РАНЫ
- •10.4.2. ЛОКАЛЬНЫЕ ОЖОГИ
- •10.4.7. РОЖИСТОЕ ВОСПАЛЕНИЕ
- •10.5. РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
- •ГЛАВА 11
- •ОСОБЫЕ ВИДЫ РАНЕВОЙ ИНФЕКЦИИ
- •11.1. КЛОСТРИДИАЛЬНАЯ РАНЕВАЯ ИНФЕКЦИЯ
- •11.2. АНАЭРОБНАЯ НЕКЛОСТРИДИАЛЬНАЯ ИНФЕКЦИЯ
- •11.4. СТОЛБНЯК
- •11.5. РОЖА
- •11.6. АКТИНОМИКОЗ
- •11.7. СИБИРСКАЯ ЯЗВА
- •11.8. ДИФТЕРИЯ РАН
- •11.9. СИФИЛИС РАН
- •11.10. ТУБЕРКУЛЕЗ РАН
- •ГЛАВА 12
- •12.2.1. ВОЗБУДИТЕЛИ
- •12.3. МОРФОЛОГИЯ
- •12.5. ОСЛОЖНЕНИЯ СЕПСИСА
- •12.6. ЛЕЧЕНИЕ
- •12.6.1. АКТИВНОЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ГНОЙНЫХ ОЧАГОВ
- •12.7. ИНТЕНСИВНАЯ ТЕРАПИЯ БОЛЬНЫХ С ТЯЖЕЛОЙ ГНОЙНОЙ ИНФЕКЦИЕЙ
- •12.7.1. ОБЩИЕ ПРИНЦИПЫ
- •12.7.2. ПРЕДОПЕРАЦИОННАЯ ПОДГОТОВКА И ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •12.7.3.3. Детоксикация при тяжелой гнойной инфекции
- •12.7.3.5. Коррекция нарушений системы гемокоагуляции
- •12.7.3.6. Коррекция функций жизненно важных органов
- •12.7.5. ЛЕТАЛЬНОСТЬ ПРИ СЕПСИСЕ
- •ГЛАВА 13
- •ИЗМЕНЕНИЯ НЕРВНОЙ СИСТЕМЫ ПРИ ТЯЖЕЛОЙ РАНЕВОЙ ИНФЕКЦИИ
- •14.1. ОСОБЕННОСТИ ТЕЧЕНИЯ ГНОЙНОЙ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
- •14.2. НАРУШЕНИЯ ОБМЕНА
- •14.3. АКТИВНОЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •14.4. КОМПЛЕКСНАЯ ТЕРАПИЯ
- •ГЛАВА 15
- •ОБЩИЕ ПРИНЦИПЫ АКТИВНОГО ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ГНОЙНЫХ РАН И ГНОЙНЫХ ХИРУРГИЧЕСКИХ ЗАБОЛЕВАНИЙ
РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
8
9
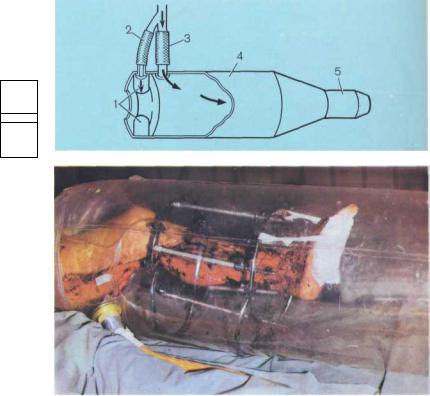
Рис. 10.8. Индивидуальный пластиковый изолятор с оригинальным уплотнением (схема).
1 — уплотнение; 2 — воздуховод к |
уплотнению; 3 — воздуховод изолятора; |
4 — стенки изолятора; 5 — выходной |
фильтр. |
Рис. 10.9. Фиксация конечности в изоляторе на спицах в аппарате Илизарова.
Для стерилизации изоляторов после механической очистки с применением моющих средств используют 1 % раствор надмуравьиной кислоты, 2% раствор диоцида или 0,5% раствор хлоргексидина.
10.2. МЕТОДИКА ЛЕЧЕНИЯ
Перед началом лечения в УАС больного в обязательном порядке моют под душем. При этом обмывают и рану, предварительно сняв повязку. После этого проводят тщательный туалет пораженной конечности с гексахлорофе-
новым мылом или 0,5% раствором хлоргексидина.
Первым и чрезвычайно важным этапом лечения в управляемой среде является тщательная и радикальная хирургическая обработка раны. Управляемая среда, как мы убедились, ни в коей мере не заменяет хирургической обработки и не снижает требования к ее качеству и радикальности. Обработку можно не делать только при «чистых» поверхностных плоских ранах небольших размеров во II фазе раневого процесса и небольших трофических язвах. Во всех остальных случаях при лечении в УАС хирурги-
ческая обработка раны необходима. Хирургическую обработку производят под общим обезболиванием. В процессе операции удаляют по возможности все нежизнеспособные ткани, вскрывают затеки и карманы. Образовавшиеся при этом кожные лоскуты целесообразно отвернуть и подшить к
здоровой коже.
В результате хирургической обработки конфигурация раны должна упроститься и в идеале приблизиться к плоской или иметь вид неглубокого конуса, широко открытого наружу. Только в таком случае раневая поверхность будет доступна воздействию потока воздуха. При узких карманах этого добиться нельзя; следует вводить в них полихлорвиниловые перфорированные дренажи для длительного проточного промывания.
После иссечения особенно сильно загрязненные раны с большим количеством нежизнеспособных тканей дополнительно обрабатывают пульсирующей струей раствора антисептика или вакуумированием.
Сразу после хирургической обработки, в операционной конечность помещают в пластиковый изолятор и фиксируют ее так, чтобы стенки мешка не касались раны. Если этого не сделать, то пленка прилипает к ране и нарушается весь принцип открытого лечения в регулируемой среде. Снижения количества микробов в ране в таких случаях не происходит, рана нагнаивается.
Правильное положение конечности в зависимости от размеров и локализации раны достигается или соответствующим ее укладыванием, или созданием ограждающих конструкций из крамеровских шин, или иммобилизацией (при обширных и циркулярных ранах) на спицах Киршнера, фиксированных в аппарате Илизарова (рис. 10.9). Последний способ предпочтительнее, так как кольца аппарата надежно ограждают раны от прилипания пленки. Мы применяем этот способ при всех обширных ранах.
В процессе лечения в абактериальном изоляторе при необходимости
производят дополнительно хирургическую обработку или этапную некрэктомию и периодически (один раз в 2— 3 дня) во время перевязки удаляют с поверхности раны рыхлый пористый струп из подсохшего экссудата. Эти манипуляции выполняют с соблюдением правил асептики в операционной или перевязочной на извлеченной из изолятора конечности, после чего конечность снова помещают в изолятор и подключают мешок к току стерильного воздуха. Систематический микробиологический контроль показал, что при таком методе не нарушается асептичность воздушной среды внутри изолятора.
В первые дни после хирургической обработки УАС обеспечивает: 1) создание внутри изолятора микроклимата, оптимального для течения раневого процесса и неблагоприятного для жизнедеятельности микроорганизмов; 2) подавление роста микрофлоры; 3) уменьшение воспалительной реакции в ране; 4) предупреждение развития внутригоспитальной инфекции. Эти задачи решаются путем целенаправленного изменения основных параметров микроклимата.
Во время лечения в УАС через изолятор постоянно продувают стерильный воздух. Изменением скорости его потока, давления, температуры и влажности создают микроклимат, благоприятный для заживления раны. Раневая поверхность подсыхает, количество микробов в тканях уменьшается. В определенной степени регулируются местный кровоток и лимфоток. Раны ограждаются от внутригоспитального инфицирования.
При регулировании параметров среды необходимо иметь в виду следующее. По данным Н. Lamke (1977), потеря воды за счет испарения с поверхности гранулирующей раны в 28 раз превышает перспирацию нормальной кожи, поэтому над обширной раной для получения подсушивающего эффекта необходимы достаточный поток воздуха и низкая относительная влажность. При обширных дефектах кожи иногда возникает потребность в увели-
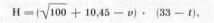
чении потока воздуха для снижения относительной влажности, что достигается также уменьшением объема изолятора и повышением температуры воздуха в нем. Однако чрезмерное подсушивание раневой поверхности приводит к образованию трудно удаляемого струпа и подсушиванию вполне жизнеспособных участков раны. Чрезмерным подсушиванием раневой поверхности, по-видимому, можно объяснить неудовлетворительные результаты заживления экспериментальных ран при использовании аппаратов, предложенных G. Winter (1961), G. Winter и J. Scales (1963), С. D. Hinman и Н. Majbach (1963), и в клинике при лечении ожогов [Lowburry Е. J. L., 1978].
Эффективность воздействия температуры и относительной влажности воздуха на раны во многом зависит от скорости потока. Для характеристики температуры движущегося воздуха существует понятие «эквивалентно-штилевая температура» [Тихомиров И. И., 1965]. При увеличении скорости воздуха теплопотери возрастают. Величину теплопотери можно подсчитать по формуле:
где Н — тепловая потеря, ккал/(м2- ч); и — скорость воздушного потока, м/с; t — температура, ° С. При большом потоке воздуха снижение температуры в эквивалентно-штилевом выражении возможно до 80° С по сравнению с исходным, поэтому, используя в изоляторе воздух комнатной температуры, можно вызвать гипотермию конечности.
Не меньшее влияние, чем температура и относительная влажность, на патологический процесс оказывает положительное давление внутри изолятора. По данным S. Sabry и соавт. (1971), Н. Aston (1975), положительное давление 10—15 мм рт. ст. улучшает артериальный и венозный кровоток в конечности, а более высокое давление, наоборот, замедляет его. Поэтому положительное давление выше 15 мм рт. ст. в постоянном режиме нежелательно, особенно у больных с нарушением кровообращения конечностей, так как нарушается капиллярный кровоток. Пульсирующее давление до 30—35 мм рт. ст. (в течение 20—30 с) прекращает кожный крово-
ток и ведет к постишемической гиперемии [ Holloway К., 1976]. Пульсирующее давление с кратковременной ишемией тренирует вегетативные рефлексы и улучшает условия микро-
циркуляции |
в конечности [Whitesi- |
des J., 1975; |
Kegel В., 1976]. |
Кроме воздействия на патологический процесс, положительное давление способствует постоянному потоку воздуха изнутри наружу и тем самым препятствует проникновению микробов из окружающей среды, т. е. внутригоспитальному инфицированию.
Все параметры регулируемой среды взаимно влияют друг на друга. Например, при обширных ранах, когда трудно обеспечить подсушивание за счет увеличения потока воздуха, можно увеличить температуру в изоляторе и, следовательно, добиться большего снижения относительной влажности. Если же продувание холодного воздуха нежелательно (при нарушении артериального кровотока), то снижение потока до минимума дает желаемый результат.
Наиболее целесообразны следующие параметры регулируемой среды для лечения гнойных ран: давление в изоляторе 5—15 мм рт. ст., температура воздуха 26—32° С, относительная влажность 50—65%, поток воздуха в начале лечения не менее одного объема изолятора в минуту.
При обширных ранах температуру воздуха поддерживают на уровне 30— 32° С. При меньших размерах поверхности ран целесообразно снизить температуру до 26—30ц'С. Более высокая температура нарушает процесс образования струпа: он становится плотным и трудно удаляемым, под ним скапливается гной. Кроме того, при высокой температуре подсушиваются окружающие ткани.
К о ж н у ю п л а с т и к у мы выполняем по общепринятой методике перфорированным дерматомным кожным лоскутом.
В операционной конечность извлекают из изолятора, рану механически очищают от засохшего экссудата (рыхлый струп) и имплантируют на
раневую |
поверхность |
перфорирован- |
Благоприятным изменениям общего |
||||||||
ный аутотрансплантат толщиной 0,2— |
состояния обычно соответствует про- |
||||||||||
0,4 мм. Забор трансплантата произво- |
грессивное |
уменьшение |
симптомов |
||||||||
дят электродерматомом ДЭП-100, по |
воспаления в ране (гиперемия, отек, |
||||||||||
возможности с той же конечности |
боль) в течение 1—3 дней. В УАС вид |
||||||||||
(чтобы поместить донорское место в |
раны быстро меняется: раневая по- |
||||||||||
изолятор) или с других участков тела. |
верхность через 15—30 мин покры- |
||||||||||
Первый |
вариант |
предпочтительнее, |
вается тонким рыхлым струпом засох- |
||||||||
так как помещение донорских участ- |
шего экссудата, который частично от- |
||||||||||
ков в изолятор практически исклю- |
деляется сам, а в основном его уда- |
||||||||||
чает их нагноение. |
|
|
|
ляют в «чистой» перевязочной (с из- |
|||||||
Перфорирование |
трансплантируе- |
влечением конечности из изолятора). |
|||||||||
мого лоскута мы считаем обязатель- |
Струп необходимо удалять |
ежедневно |
|||||||||
ным, ибо это обеспечивает беспрепят- |
в течение 2—3 дней, затем количество |
||||||||||
ственный отток экссудата из-под него. |
экссудата |
прогрессивно уменьшается |
|||||||||
Перфорации наносим |
при |
помощи |
и надобность в этом отпадает. |
|
|||||||
перфоратора. Косметический |
эффект |
Отек окружающих тканей и гипере- |
|||||||||
перфорирования лоскута, по |
нашим |
мия |
кожи |
заметно |
уменьшаются |
в |
|||||
наблюдениям, существенно не ухуд- |
1-й день и обычно исчезают в тече- |
||||||||||
шается, так как в условиях УАС следы |
ние 3 дней. В связи с исчезновением |
||||||||||
перфорации быстро (в течение 20— |
отеков конечности больные отмечают |
||||||||||
30 дней) становятся почти не разли- |
уменьшение или полное исчезновение |
||||||||||
чимыми. Это явление не совсем по- |
болей в ране. Одновременно количе- |
||||||||||
нятно, но наблюдается постоянно. |
ство |
отделяемого резко уменьшается, |
|||||||||
После кожной пластики все меро- |
гипертрофированные и отечные гра- |
||||||||||
приятия по регулированию микрокли- |
нуляции становятся мелкозернистыми. |
||||||||||
мата в изоляторе должны быть на- |
Однако |
такое |
течение |
заживления |
|||||||
правлены на увеличение относитель- |
наблюдается только в тех случаях, |
||||||||||
ной влажности среды (до 80%), не- |
когда отсутствуют затеки, карманы и |
||||||||||
которое |
снижение |
температуры (до |
некроз в поверхностной и «плоской» |
||||||||
28° С) по сравнению |
с той, |
которая |
ране если удалось иссечь все нежизне- |
||||||||
была установлена во время подготов- |
способные ткани, вскрыть и дрениро- |
||||||||||
ки, и значительное уменьшение пото- |
вать все затеки. Если на протяжении |
||||||||||
ка воздуха (до 1 м3/мин). Изменение |
2—3 дней от начала лечения в УАС |
||||||||||
параметров среды должно проводиться |
общее состояние больного (температу- |
||||||||||
под контролем измерения относитель- |
ра тела, пульс, число лейкоцитов) не |
||||||||||
ной влажности воздуха и в зависи- |
улучшается и местные изменения в |
||||||||||
мости от состояния кожного транс- |
ране (количество экссудата, отек, ги- |
||||||||||
плантата. При наличии экссудата в |
перемия) не исчезают, то необходима |
||||||||||
ране или скопления его под транс- |
ревизия раны, а при наличии некроза, |
||||||||||
плантатом поток воздуха должен быть |
затеков или полостей повторная хи- |
||||||||||
несколько увеличен. |
|
|
|
рургическая обработка. |
|
|
|||||
10.3. ТЕЧЕНИЕ |
|
|
|
Для контроля за течением раневого |
|||||||
|
|
|
процесса во время лечения в УАС, по- |
||||||||
РАНЕВОГО ПРОЦЕССА |
|
мимо общеклинических данных целе- |
|||||||||
После помещения конечности в изо- |
сообразно |
использовать |
некоторые |
||||||||
объективные критерии: площадь раны |
|||||||||||
лятор с УАС общее состояние боль- |
и локальную температуру раны и ко- |
||||||||||
ного в течение 2—3 дней обычно за- |
жи конечности, данные эластографии, |
||||||||||
метно улучшается, уменьшаются явле- |
качественного и количественного ис- |
||||||||||
ния гнойной интоксикации, снижаются |
следования микрофлоры раны, показа- |
||||||||||
температура тела и частота пульса, |
тели |
тканевого |
гемостаза, |
результаты |
|||||||
нормализуются показатели перифери- |
цитологического |
и |
морфологического |
||||||||
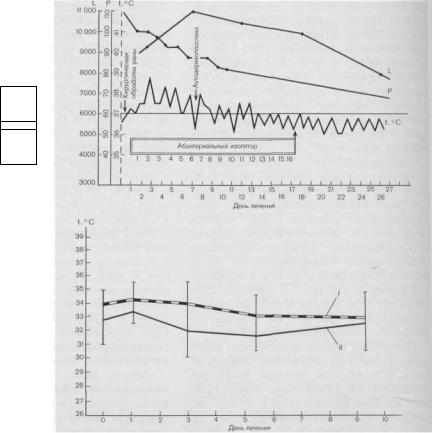
ческой крови (рис. 10.10). |
|
исследования раны. |
Кроме того, |
мы |
|||||||
РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
10
11
|
|
Рис. 10.10. |
Типичное |
изменение температурной |
кривой |
ft, |
° С), частоты |
|||||||
|
|
пульса |
(Р) |
и |
количества лейкоцитов |
(L) в |
процессе |
лечения ран |
||||||
|
|
в управляемой |
абактериальной |
среде. |
|
|
|
|
|
|
|
|||
|
|
Рис. 10.11. Типичное изменение локальной температуры раны (I) и |
||||||||||||
|
|
кожи (II) конечности в процессе лечения в управляемой абактери- |
||||||||||||
|
|
альной среде. |
|
|
|
|
|
|
|
|
|
|
||
производим |
фотографирование |
раны |
сти |
тела, |
а |
нижняя конечность — |
||||||||
на цветную пленку в стандартных по- |
18%). Для более точных измерений |
|||||||||||||
ложениях до, во время и после лече- |
мы применяем таблицы, составленные |
|||||||||||||
ния. |
|
|
|
|
|
Г. Д. Вилявиным и соавт., и разра- |
||||||||
О п р е д е л е н и е |
п л о щ а д и |
ра- |
ботанную В. Ф. Хотиняном (1983) ме- |
|||||||||||
ны. В клинической практике для |
тодику (см. главу 7). |
|
|
|
|
|||||||||
определения площади раны исполь- |
И з м е р е н и е |
л о к а л ь н о й |
тем- |
|||||||||||
зуют либо |
правило |
ладони |
(площадь |
п е р а т у р ы |
|
р а н ы |
и |
|
конечности |
|||||
ее составляет 1 —1,5% поверхности |
электротермометром |
показывает, |
что |
|||||||||||
тела, или 150—200 см2), либо правило |
во время лечения в УАС температура |
|||||||||||||
девятки (голова и шея, верхняя ко- |
в течение 24—28 ч снижается до 31 — |
|||||||||||||
нечность, область живота, передняя и |
29° С. Это указывает на уменьшение |
|||||||||||||
задняя половина грудной клетки сос- |
артериального |
кровотока |
|
и стихание |
||||||||||
тавляют каждая около 9% |
поверхно- |
явлений воспаления |
в |
тканях |
(рис. |
|||||||||
ЛЕЧЕНИЕ РАН В УПРАВЛЯЕМОЙ АБАКТЕРИАЛЬ НОЙ СРЕДЕ
12
13
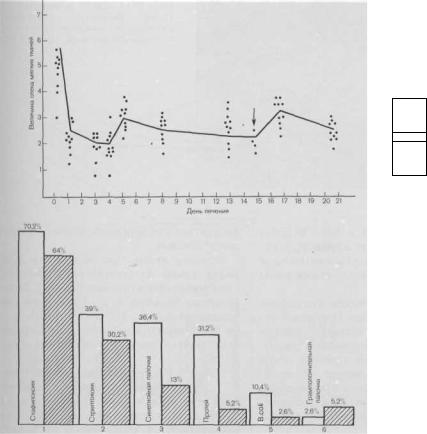
Рис. 10.12. Изменение степени отека (в условных единицах) по данным эластографии в процессе лечения ран в управляемой абактериальной среде. Стрелкой указан момент прекращения лечения.
Рис. 10.13. Частота выделения микрофлоры из ран до лечения (светлые столбики) и через 5—7 сут после его начала (заштрихованные столбики).
10.11). Такое снижение температуры на поверхности раны и тканей задерживает развитие патогенной микрофлоры, особенно грамотрицательнои [Cullen С, 1971; Benfer J., 1976; Lowburry E. L., 1978].
Объективное исследование методом эластографии [Костюченок Б. М. и др., 1983] показало, что под воздействием положительного давления в изоляторе (10 мм рт. ст.) отечность мягких тканей в течение суток от начала лечения в УАС резко уменьшается, и лишь при извлечении конечности
из изолятора, при атмосферном давлении отек мягких тканей временно увеличивается (рис. 10.12). Обращаем внимание на то, что исчезновение отека под влиянием положительного давления предшествует положительным изменениям в состоянии раны, оцениваемым другими объективными методами исследования.
Большое значение мы придаем бак- т е р и о л о г и ч е с к о м у контро - лю. У всех больных после хирургической обработки перед помещением в местный изолятор и во время лече-

РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
ния (в 1-й, на 3—5-й и 8—9-й день) в динамике определяют характер микробной флоры на поверхности раны и количество микробов в 1 г ткани раны (методику см. в главе V).
Через 5—10 сут лечения микрофлора раны резко меняется. Особенно это касается грамотрицательных микробов: высеваемость синегнойной палочки, протея и кишечной палочки резко падает, часто они исчезают. В меньшей степени сказанное относится к кокковой флоре, но частота высеваемости и этих микробов заметно уменьшается (рис. 10.13).
Угнетение микрофлоры в ране, особенно грамотрицательной, при лечении в УАС некоторые исследователи объясняют подсушивающим эффектом продуваемого воздуха [Гинодман Г. А., 1977; Исаков Ю. Ф., 1982]. Это подтверждается данными Е. L. Lowburгу и соавт. (1953), которые установили губительное действие подсушивания на раневую микрофлору, прежде всего грамотрицательную, особенно синегнойную палочку.
Наши исследования показали, что дело не только в прямом высушивании. При гистологическом изучении струпа, образующегося на поверхности раны на 2—5-й день лечения в УАС, в нем обнаружено большое скопление микроорганизмов (рис. 10.14); в глубжележащих тканях микробов практически не оказалось [Костюченок Б. М. и др., 1982]. При перевязке струп с поверхности раны уда-
Рис. 10.14. Струп с окраской по
Граму — Вейгерту. |
Скопления |
патогенных микробов |
окрашены |
в темно-фиолетовый цвет. ХКИ).
ляется вместе с основной массой микроорганизмов.
Помимо этого, при лечении в УАС значительно уменьшалось и количество микробов в тканях раны. У большинства больных к 5—10-му дню оно снизилось с 108—106 до 103—101, т. е. на 2—3 порядка и более. У 58% больных раны стали стерильными (рис. 10.15).
Лишь у 6% лечившихся не наступило существенного снижения количества микробов в ране, а еще у 6% их число даже увеличилось. Во всех этих наблюдениях в дальнейшем были найдены нераспознанные или возникшие вновь гнойные очаги в глубине раны (затеки, плохо дренируемые карманы, участки некроза). В таких случаях необходимо срочно произвести повторную хирургическую обработку с тщательным удалением нежизнеспособных тканей, рассечением карманов и активным проточным дренированием.
Описанные качественные и количественные изменения микрофлоры являются ценным критерием для определения срока выполнения кожной пластики. Мы производили пластику, когда исчезала грамотрицательная микрофлора, а количество микробов в 1 г ткани раны уменьшалось на 3—4 порядка, т. е. оказывалось на
уровне 102—10].
Другим важным критерием течения раневого процесса и методом контроля подготовки раны к аутодермопластике

ЛЕЧЕНИЕ РАН В УПРАВЛЯЕМОЙ АБАКТЕРИАЛЬНОЙ СРЕДЕ
15
16
Рис. 10.15. Изменение количества микробов в ране в процессе лечения в УАС.
I — на поверхности раны; II — по данным биопсии.
Рис. 10.16. Изменение показателей тканевого гемостаза грануляционной ткани.
А — до лечения; Б — на 1-3-и сутки лечения; В — 5—7-е сутки; Г—10— 15-е сутки.
является |
динамическое |
исследование |
|
п о к а з а т е л е й |
т к а н е в о г о ге- |
||
м о с т а з а |
г р а н у л я ц и о н н о й |
||
ткани |
(см. главу 4). |
По данным |
|
Ю. А. Амирасланова (1978), полноценная грануляционная ткань с преобладанием новообразованных сосудов и фибробластов характеризуется низкой
фибринолитической активностью, низким содержанием ПДФ и высокой активностью фибринстабилизирующего фактора (XIII фактор). Напротив, в грануляционной ткани с выраженной лейкоцитарно-лимфоидной инфильтрацией и обилием микробов отмечается повышение фибринолити-
РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
ческой активности, значительное увеличение концентрации ПДФ и низкая активность фактора XIII, что указывает на высокий протеолиз в ране. Визуально в такой ране обнаруживаются вялые бледные грануляции без признаков краевой эпителизации, обильное гнойное отделяемое.
У больных с высоким локальным протеолизом при лечении ран в УАС
в1-й день после помещения в изолятор обнаружено резкое повышение протеолиза в ране, о чем свидетельствовали еще более выраженное повышение фибринолитической активности, увеличение концентрации ПДФ
в2 раза, заметное падение активности фактора XIII. Параллельно снижалось количество микробных тел. Это указывает на высвобождение в ране (вследствие гибели микробов) микробных протеаз и, по-видимому, лизосомальных протеолитических ферментов, что в свою очередь является причиной усиления протеолитических процессов в ране. Со 2-го дня отмечалась тенденция к снижению локального протеолиза в ране. На 5— 7-й день лечения фибрйнолитическая активность снижалась вдвое по сравнению с исходными значениями, ПДФ — в 3 раза, активность фактора XIII восстанавливалась до нормаль-
ного уровня |
или повышалась в 2— |
|
3 раза |
(рис. |
10.16). |
При |
гистологическом исследовании |
|
грануляционной ткани в этот период обнаружено увеличение количества
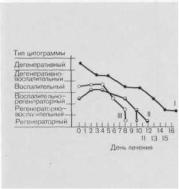
Рис. 10.17. Динамика цитологических отпечатков в процессе лечения в УАС.
I — трофические язвы; II — обширные гнойные гранулирующие раны: III — первичные гнойные раны.
новообразованных сосудов и фибробластов. Заметно уменьшалась лейко- цитарно-лимфоидная инфильтрация. Такие изменения показателей тканевого гемостаза свидетельствуют о нормализации протеолитических процессов в гнойной ране и благоприятны в прогностическом отношении.
Кроме перечисленных методов, мы для контроля за течением раневого
процесса широко применяли |
метод |
р а н е в ы х о т п е ч а т к о в , |
разрабо- |
танный М. П. Покровской и М. С. Макаровым (1942), а для морфологического изучения — биопсию раны. В зависимости от клеточного состава и степени выраженности воспалительных изменений различали 6 типов цитограммы, согласно схеме, предположенной М. Ф. Камаевым (1956), в модификации О. С. Сергель (1978) (см. главу 7). Результаты исследований, проведенных у 285 больных (О. С. Сергель, 3. Г. Гончарова) представлены на рис. 10.17. В зависимости от характера раны до лечения имели место два типа цитограммы: у больных с трофическими язвами и длительно не заживающими ранами она носила дегенеративный или дегенеративно-вос- палительный характер; при гнойных ранах и острых процессах отмечены различные сочетания воспалительных
ирегенераторных изменений.
Врезультате лечения в УАС наблюдались два вида изменений цитограммы: 1) прогрессивная смена дегенеративной и дегенеративно-воспалитель-
