
2 курс / Нормальная физиология / Клиническая_физиология_и_патофизиология_для_анестезиологов_Черний
.pdf
10. Для профилактики набухания головного мозга в стадию разрешения отека мозга использовали препараты для улучшения микроциркуляции (трентал, дипиридамол) и метаболизма мозга (актовегин, неотон). В случаях редукции мозгового кровотока (по данным РЭГ и КТ) применялись препараты для его улучшения (кавинтон, сермион, нимодипин).
11. В комплексе терапии больных с преобладающим отеком мозга может использоваться гипербарическая оксигенация, проведение гемодиализа с ультрафильтрацией.
При диагностике преобладания набухания головного
мозга терапия имела определенные отличия.
1.В связи с нарушением функции дыхания больные переводятся на ИВЛ, причем, по сравнению с пациентами с преобладанием отека мозга, ИВЛ проводится в режиме нормовентиляции,таккакпринабуханиимозгавазоконстрикторный эффект гипокапнии может усугубить гипоксию мозга.
2.На первом этапе развития критического состояния начинается терапия, направленная на снижение энергетических потребностей мозга и защиты его от вторичной гипоксии. Применяют сочетание оксибутирата натрия 40-120 мг/кг в сутки
стиопенталом натрия 4-12 мг/кг в сутки, при нестабильной гемодинамике, одновременно с капельной инфузией допамина.
3.Целенаправленная патогенетическая терапия набухания головного мозга: одновременно с гемодиллюцией и гепаринизацией применяются препараты для улучшения микроциркуляции (реополиглюкин 3-6 мл/кг в сутки, трентал 2-3 мг/кг в сутки, компламин 5-10 мг/кг в сутки.)
4.Затем используется группа препаратов для улучшения мозгового кровотока: кавинтон 0,25-0,45 мг/кг в сутки, сермион 0,1-0,2 мг/кг в сутки; в ряде случаев применяют антагонисты кальция (нимодипин).
5.Для восстановления проницаемости клето-ных мембран применяют L-лизин эсцинат, в некоторых случаях гормональные препараты: дексазон 0,2-0,4 мг/кг в сутки.
6.После медикаментозной подготовки препаратами, улучшающими микроциркуляцию и мозговой кровоток, вводятся
56
медикаментозные средства для восстановления метаболизма головного мозга: Цито-Мак по 1-2 ампулы 1-2 раза в день или цитохром-С 0,5-0,8 мг/кг в сутки, неотон -1 -2 г в сутки, сочетанное применение актовегина 10-80 мг/кг в сутки и инстенона 2-4 мл в сутки, рекогнан Е (цитиколин) 4-20 мг/кг в сутки.
7.Для профилактики нарушений проницаемости гематоэнцефалического барьера использовали L-лизин эсцинат и препараты, снижающие активность калликреин-кининовой системы и трипсинемии, антигистаминные препараты, проводилась антиоксидантная терапия.
8.Дегидратационная терапия у больных с набуханием головного мозга не проводилась. Это связано с несколькими причинами.
Во-первых, применение дегидратационных препаратов при набухании головного мозга патогенетически не обосновано. При набухании осмолярность в клетках мозга резко повышается, отмечается массивный переход жидкости во внутриклеточный сектор и связь ее с внутриклеточными биоколлоидами, а мозг в целом находится в состоянии водного дефицита. Основу терапии должны составлять препараты для улучшения микроциркуляции, мозгового кровотока и метаболизма мозга.
Во-вторых, на ранних этапах развития критического состояния, при нарушении микроциркуляции и мозгового кровотока осмодиуретики просто не достигнут места своего приложения, развитие феномена невосстановления кровотока приведет к выведению воды из участков мозга с частично восстановленным кровотоком и скоплению осмотически активных препаратов в наиболее поврежденных участках мозга, что будет сопровождаться развитием "феномена отдачи" с еще большей дислокацией ствола мозга.
В-третьих, при повышении осмолярности плазмы введение осмотических диуретиков противопоказано. У больных с набуханием мозга осмолярность плазмы повышается, что связано с накоплением значительного количества недоокисленных продуктов.
В-четвертых, согласно литературным данным, введение гиперосмолярных растворов приводит к нарушению
57

гематоэнцефалического барьера за счет увеличения межэндотелиальных щелей. Учитывая все выше сказанное, осмотерапия у больных с преобладанием набухания головного мозга не проводится.
9. Учитывая, что при набухании головного мозга отмечается массивный переход жидкости во внутриклеточный сектор, на первом этапе, и связь ее с внутриклеточными биоколлоидами, на втором, а мозг в целом находится в состоянии водного дефицита, объем инфузионной терапии составляет 1,5-2 литра, иногда несколько превышает эти значения.
Таким образом, терапия преобладающего набухания головного мозга отличается от терапии преобладающего отека мозга также, как патогенез развития отека от патогенеза набухания. Это и режимы ИВЛ, и объем инфузионной терапии, и ее качественный состав, и отказ от применения осмодиуретиков при набухании головного мозга и, наконец, первичность применения определенных групп препаратов: при набухании - улучшающих микроциркуляцию, мозговой кровоток и метаболизм мозга, а при отеке - нормализующих нарушенную функцию гематоэнцефалического барьера, одновременно с дегидратационной терапией.
Терапия сочетанной формы отек-набухание включает
весь комплекс лечения преобладающего отека и преобладающего набухания мозга со следующей этапностью мероприятий.
1 .Создание охранительного торможения мозга и снижение его энергетических потребностей: препараты, влияющие на ГАМКэргическую систему, барбитураты,
2.Восстановление функции клеточных и сосудистых мембран: L-лизин эсцинат, гормональные препараты, антигистаминные препараты, препараты для снижения активности калликреин-кининовойсистемыитрипсинемии,антиоксиданты.
3.Восстановление мозгового кровообращения: препараты для улучшения микроциркуляции и мозгового кровотока, лекарственные средства, повышающие тонус венозных сосудов, улучшающие венозный отток из полости черепа - L-лизин эсцинат.
4.Дегидратация ткани мозга: осмотические диуретики (с осторожностью), салуретики.
5.Оксигенация нервной ткани и дренирование продуктов распада из мозга; активные методы детоксикации.
6.Восстановление метаболизма мозга.
Терапия отека-набухания требует наиболее тщательного динамического контроля с помощью нейрофизиологических методов исследования, особенно при проведении дегидратационной терапии, выборе инфузионного режима, подборе параметров гипербарической оксигенации и во время диализного лечения.
Основу терапии гиперемии мозга (повышения мозгового
кровотока) составляют:
1. Препараты повышающие тонус венозных сосудов и улучшающие венозный отток из полости черепа - L-лизин эсцинат.
2.Стабилизация функции гематоэнцефалического барьера
-L-лизин эсцинат.
3.Препараты для снижения активности калликреинкининовой системы, антиоксиданты.
4.Гипербарическая оксигенация.
Динамический контроль с помощью нейрофизиологических методов за проведением сеансов ГБО позволяет оценить результаты лечения и провести раннюю диагностику острой кислородной интоксикации. Ранняя диагностика преобладающего отека и набухания головного мозга у больных с острой почечной недостаточностью позволяет, в случаях диагностики преобладающего отека, своевременно поставить показания к проведению гемодиализа с ультрафильтрацией, а при определении преобладающего набухания - предупредить развитие летальных осложнений, каким является синдром Кеннеди.
Необходимо отметить, что проблема отека и набухания головного мозга еще далека от разрешения, в том числе и по вопросам, которые рассматривались в данных методических рекомендациях. Будем надеяться, что будущие исследования приблизят ее решение.
59

Список литературы
1.Акино Т., СамуэльсМ. Нарушения сознания //Неврология /Под ред. М. Самуэльса; Пер. с англ.- М.: Практика, 1997.-С. 19-39.
2.Ворлоу Ч.П., Деннис М.С., Ж. ван Гейн и др. Инсульт: Практическое руководство для ведения больных; Пер. с англ.- СПб.: Политехника, 1998-629с.
3.Гурвич A.M. Гипоксический отек мозга и его роль в развитии острых постгипоксических нарушений неврологического статуса // Журн. невропатологии и психиатрии.-1971.— Т.71, №8.-
С.1262-1268.
4.Гурвич A.M. Отек головного мозга: V Международный симпозиум по мозговому кровообращению.- Тбилиси: Мецниереба, 1986.- 176с.
5.Квитнщкий-Рыжов Ю.Н. Отек и набухание головного мозга-К.: Здоров'я, 1978183с.
6.Квитницкий-Рыжов Ю.Н. Современное учение об отеке и набухании головного мозга.- К.: Здоров'я, 1988.- 184с.
7.Клатцо И. Отек головного мозга: V Международный симпозиум по мозговому кровообращению.- Тбилиси: Мецниереба, 1986.- 176с.
8.Лечение отека мозга при острой цереброваскулярной недостаточности/П.В.Волошин,В.И. Тайцлин,Н.Н. Бровина,Д.А. Романов // Методические рекомендации: Харьков, НИИ неврологии и психиатрии.-Харьков: Б.и., 1983.- 17с.
9.Потапов А.А. Внутричерепное давление // Нейротравматология / Под ред. А.Н. Коновалова, Я.Б. Лихтермана, А.А. Потапова- М.: ИПЦ "Вазар-Ферро", 1994.- 37с.
10.Сервос-Наварро Й. Первичные нарушения микроциркуляции, вызывающие отек мозга // Отек головного мозга: V Международный симпозиум по мозговому кровообращению.-Тбилиси: Мецниереба, 1986.-43с.
11.Хоссманн К.А. Первичные нарушения микроциркуляции, вызывающие отек мозга // Отек головного мозга: V Международный симпозиум по мозговому кровообращению.- Тбилиси: Мецниереба, 1986.-43с.
12.Черный В.И., Кардаш A.M., Городник Г.А., Дроботько
В.Ф. Диагностика и лечение отека и набухания головного мозга.- К.: Здоров'я, 1997,-228с.
13.Черный В.И. Постгипоксическая энцефалопатия.- К.: Здоров'я, 1997.-336с.
14.Bmder N et al. A comparison of extradural and intraparenchymatous intracranial pressure in head injured patients // Int. Care Med.- 1995.- Vol.21, №10.- P.850-852.
75.Klatzo I. Presidential address: Neuropathological aspects of brain edema. J. Neuropathol. Exp. Neurol.- 967- №26.- P. 1-13.
16.Р1ыт К, Posner J.B. The Diagnosis of Stupor and Coma.Philadelphia: Davis F.A. Company, 1985,-P. 96-100.
60

Глава 3. КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ
И ПАТОФИЗИОЛОГИЯ ОРГАНОВ ДЫХАНИЯ
Физиологию и патофизиологию органов дыхания можно рассматривать лишь только в контексте жизнедеятельности целого анатомо-физиологического комплекса, обеспечивающего процесс внешнего дыхания, в состав которого входят внелегочные и легочные структуры.
Квнелегочным структурам относятся:
1.регуляторные структуры ЦНС (определенные зоны коры большого мозга, ретикулярная формация, продолговатый мозг);
2.проводящие нервный импульс образования (спинной мозг);
3.мышечный аппарат, обеспечивающий работу дыхания;
4.реберный каркас.
Клегочным структурам принадлежат:
1.воздухоносные пути и легкие;
2.система легочного кровообращения.
Изолированное или сочетанное повреждение любой из перечисленных структур приводит к развитию дыхательной недостаточности.
Строение и функции дыхательных путей
Дыхательные пути включают: носовые ходы, ротовую полость, гортань, трахею, которая делится на 2 главных бронха, каждый из которых в свою очередь также последовательно и многократно дихотомически делится. От зубов до бифуркации трахеи длина дыхательных путей составляет 22 - 24 см. Диаметр голосовой щели в поперечнике - 7 мм, продольный - 17 - 20 мм. Голосовые связки открываются при вдохе и смыкаются при выдохе. Длина трахеи, в среднем, - 12 см, ее диаметр - 16-27 мм. Бифуркация трахеи находится на уровне Tv . Правый главный бронх является анатомическим продолжением трахеи, левый отходит под углом 25 - 35°. В результате последовательного деления бронхи образуют 23 генерации. Весь объем дыхательных путей делится на 3 зоны.
62
Верхние дыхательные пути, трахею и бронхи до 16-го порядка включительно относят к проводящей зоне. Бронхи 17- 19-го порядка называют респираторными бронхиолами, так как на их стенках уже появляются альвеолы, а их зона называется переходной. Респираторные бронхиолы 20-23-го порядка называются дыхательной зоной, преимущественно в этой зоне протекает газообмен. Количество альвеол на стенке бронхиол возрастает, а бронхиолы 23-го порядка заканчиваются альвеолярными мешочками из 20-25 альвеол. Общее количество альвеол у взрослого человека достигает 300 млн, площадь газообмена при этом - 50-100 м2.
В результате многократного деления бронхов общая площадь их поперечного сечения резко возрастает и составляет 1,1 м2 на уровне 23-й генерации. Такое увеличение поперечного сечения приводит к постепенной смене конвекционного движения воздуха в проводящей зоне на диффузионный тип газообмена в переходной и дыхательной зонах.
Косновным функциям воздухоносных путей относят:
1)обеспечение струйного поступления воздуха;
2)согревание воздуха, благодаря широкой сети кровеносных капилляров подслизистого слоя;
3)увлажнение (вне зависимости от влажности атмосферной смеси, воздух в легких насыщен до 100% парами воды);
4)очищение (задержка и удаление плотных частиц).
Строение альвеолы
Альвеолы представляют собой множество взаимосообщающихся пузырьков. Средний диаметр альвеолы - 0,2 мм. Каждая альвеола окутана сетью легочных капилляров, имеет асимметричное строение. Более тонкая часть ее стенки называется респираторной, или служебной (толщина -0,4 мкм). В ней альвеолярный эпителий отделяется от капиллярного эндотелия лишь базальной мембраной. Именно в этой зоне альвеолокапиллярной мембраны происходит газообмен. Более толстая поддерживающая часть стенки (1-2 мкм) обеспечивает альвеоле опору за счет альвеолярного интерстициального пространства, которое вклинивается между альвеолярными и эндотелиальными
63

слоями мембраны. Легочный интерстиций по своей массе занимает около 40% альвеоло-капиллярной мембраны (по 30% приходится на долю эпителиального и эндотелиального слоев). Основу интерстиция составляют:
-коллаген (60 % массы интерстиция) - обладает способностью связывать воду;
-эластин (около 25-30 % массы) - обусловливает эластичность легочной ткани;
-гликозоаминогликаны (1 %) и фибронектин (0,5 %) - обеспечивают непроницаемость мембраны для воды и белков.
Повреждение агрессивными факторами легочного интерстиция приводит к его отеку и потере эластичности легочной ткани.
Обращенный внутрь альвеол слой эпителиальных клеток неоднороден и представлен:
-альвеоцитами I типа, основной задачей которых является газообмен между кровью и воздухом;
-альвеоцитами II типа, ответственными за синтез сурфактанта, регенерацию легочного эпителия (способны при делении образовывать пневмоциты I типа), защиту легких от микробного и гипероксического повреждения;
-альвеоцитами III типа (так называемыми щеточными, или ворсинчатыми клетками). Роль их недостаточно изучена. Предполагают, что они предназначены для хеморецепции и абсорбции из альвеол различных жидкостей.
Синтезируемое альвеоцитами II типа поверхностно-активное вещество фосфолипидной природы сурфактант выстилает внутреннюю поверхность альвеолы, снижая поверхностное натяжение, препятствуя полному спадению альвеол и облегчая их раскрытие при вдохе. Приобретенный дефицит сурфактанта наблюдается при гипоксии, гипероксии, ацидозе, воспалении, аспирации рвотных масс и других жидкостей, после искусственного кровообращения и гемотрансфузий. Поверхностная активность сурфактанта нарушается при длительном (4-6 ч) фторотановом наркозе. Клинически это проявляется нарушением легочной растяжимости и образованием ателектазов.
64
Кроме регуляции поверхностного натяжения, сурфактантная система легких выполняет ряд важных функций:
-поддерживает проходимость респираторных бронхиол;
-принимает участие в процессе кондиционирования воздуха
влегких (особенно активна реакция системы при вдыхании воздуха низких температур);
-участвует в абсорбции кислорода и регуляции его транспорта через аэрогематический барьер;
-способствует поддержанию нормального уровня фильтрационного давления в системе легочной микроциркуляции.
Учитывая важность системы сурфактанта для нормального функционирования легких, в интенсивнойтерапииразрабатываются направления по восстановлению и поддержанию ее активности.
Внастоящее время используют несколько способов:
1.Эндотрахеальное введение природных сурфактантов, полученных из легких крупного рогатого скота (Alveofact, Германия; сурфактант-BL, Россия) и легких свиней (Curosurf, Италия).
2.Эндотрахеальное введение синтетических (Exosurf, США) и полусинтетических (Survanta, США) поверхностноактивных веществ.
3.Внутривенное применение средств, стимулирующих выработку эндогенного сурфактанта (амброксол).
4.Внутривенное введение препаратов, содержащих отдельные фосфолипиды - структурный компонент сурфактанта (липин, Украина).
При использовании такой терапии наблюдаются улучшение показателей легочной растяжимости и газового состава крови, положительная рентгенологическая динамика.
Иннервация аппарата внешнего дыхания
Диафрагма иннервируется диафрагмальными нервами, берущими начало в нервных корешках сегментов С3 -С5 . Односторонний блок диафрагмального нерва уменьшает показатели легочной вентиляции на 25%.
Межреберные мышцы иннервируются грудными спинномозговыми нервами.
65

Различают афферентную, эфферентную вагусную и эфферентную симпатическую иннервацию легких. Афферентные волокна начинаются с «рецепторов раздражения» и участвуют в осуществлении кашлевого рефлекса, регуляции ритма и амплитуды дыхания.
Трахеобронхиальное дерево имеет симпатическую и парасимпатическую (блуждающий нерв) иннервацию.
Действие симпатической нервной системы
В легких имеются р^-и (32-адренорецепторы. Стимуляция Р^адренорецепторов вызывает:
-уменьшение бронхиальной секреции;
-бронхоспазм;
-незначительную констрикцию легочных сосудов. Стимуляция р2-адренорецепторов обеспечивает:
-бронходилатацию;
-снижение секреции;
-дилатацию сосудов легких.
Действие парасимпатической нервной системы Активация блуждающего нерва проявляется:
-бронхоконстрикцией;
-усилением бронхиальной секреции;
-вазодилатацией, реализуемой через оксид азота.
Особенности легочного кровообращения
Легкие, в отличие от других органов, в результате сердечного сокращения получают не определенную фракцию сердечного выброса, а полный его объем, поступающий в легочную артерию из правого желудочка. Соответственно суммарный кровоток через сосуды малого круга кровообращения равен минутному объему крови. Этому способствует низкое сопротивление легочных сосудов: общее сопротивление сосудов малого круга в 6-8 раз меньше, чем большого. В легких имеется двойная сеть капилляров. Легочная артерия, повторяя деление бронхов, распадается на густую капиллярную сеть, окутывающую альвеолы. В последнее время изменилось представление о кровоснабжении легких. Альвеолярная часть легких дистальнее
66
респираторных бронхиол питается кровью легочных артерий, а дыхательные пути проксимальнее респираторных бронхиол кровоснабжаются бронхиальными артериями, в которых циркулирует только 1-2% всей крови легких. В норме в сосудах малого круга находится 10-12% всей крови, имеющейся в организме. Бронхиальное и легочное русло сообщаются между собой. В норме наличие этих прямых артерио-венозных шунтов, идущих в обход легочных капилляров, не имеет функционального значения.
Капиллярное русло легких - самое большое среди органных сосудистых сетей тела, его площадь - около 70 м2. Эндотелиальные клетки составляют почти половину всех эндотелиальных клеток организма [4]. Столь развитая микроциркуляция необходима для осуществления газообменной и многочисленных метаболических функций легких. Наличие в легких огромной эндотелиальной поверхности делает этот орган «мишенью №1» для воздействия патологических медиаторов воспаления и других биологически активных веществ при различных критических состояниях.
Дренажная система легких
В течение суток в норме вырабатывается от 10 до 100 мл трахеобронхиального секрета. Образующийся слизистый секрет на 95% состоит из воды, остальные 5% содержат мукопротеины, сурфактант, иммуноглобулины, лизоцим, электролиты и клеточные элементы. Синтез слизи осуществляется бокаловидными клетками. Перемещение секрета по направлению от респираторных бронхиол к трахее называется мукоцилиарным
клиренсом. Эта работа выполняется реснитчатыми
эпителиальными клетками. Высыхание слизистой оболочки, воспаление, ожог дыхательных путей, травматизация эпителия эндотрахеальной или трахеостомической трубкой нарушают процессы выделения мокроты, что способствует развитию бронхообтурации. Для поддержания нормальной влажности слизистой оболочки при проведении ИВЛ объемом 10 л/мин ежесуточно необходимо добавлять во вдыхаемую смесь 600 мл воды.
67

При избыточном количестве слизи эвакуацию ее дополнительно обеспечивает кашель. В механизме кашля важная роль принадлежит коллатеральной вентиляции. Последняя представляет собой вентиляцию, осуществляемую через поры Кона - воздухоносные ходы между соседними альвеолами, выстланные альвеолярным эпителием. При спокойном дыхании они не функционируют. При кашле, в момент резкого повышения внутригрудного давления поры Кона обеспечивают поступление воздуха позади слизистой пробки, значительно облегчая ее отхождение. При дефиците сурфактанта этот путь коллатеральной вентиляции полностью перекрывается, что объясняет причины нарушения откашливания мокроты при таких патологических состояниях, как острый респираторный дистресс-синдром.
Дыхательная функция легких
Дыхательная функция легких обеспечивается тремя основнымипроцессами:
1 транспортом воздуха (вентиляция);
2)циркуляцией крови в легких (перфузия);
3)обменом газов через альвеоло-капиллярную мембрану
(диффузия).
Вентиляция
Вентиляцией легких называют процесс обновления газового состава альвеолярного воздуха, обеспечивающий поступление кислорода и удаление избыточного количества углекислого газа. Интенсивность вентиляции определяется глубиной вдоха
(дыхательным объемом; ДО) и частотой дыхания (ЧД). В
практике анестезиологов используется также расчетная величина вентиляции - минутный объем дыхания (МОД): произведение величины дыхательного объема на частоту дыхания в 1 мин. В состоянии покоя у взрослого человека МОД составляет 6-10 л, при работе МОД увеличивается до 30-100 л.
Регуляция дыхания
Регуляция внешнего дыхания представляет собой физиологический процесс управления легочной вентиляцией,
68
основная цель которой - обеспечение оптимального газового состава внутренней среды организма (крови, интерстициальной, спинномозговой жидкости) при постоянно изменяющихся условиях жизнедеятельности.
Управление дыханием осуществляется по принципу обратной связи: отклонение от оптимальных величин регулируемых параметров (рН, РаО9 и РаСО2) вызывает изменения вентиляции, направленные на их нормализацию. Например, ацидоз приводит к усилению вентиляции, алкалоз - к уменьшению интенсивности дыхания.
Регуляция внешнего дыхания осуществляется путем рефлекторных реакций, возникающих в результате возбуждения специфических рецепторов (механорецепторов и хеморецепторов), находящихся в легочной ткани и сосудистых рефлексогенных зонах.
Дыхание инициируется в дыхательном центре, расположенном на дне IV желудочка продолговатого мозга. Дыхательным центром называют совокупность взаимно связанных нейронов ЦНС, обеспечивающих координированную ритмическую деятельность дыхательных мышц и постоянное приспособление внешнего дыхания к изменяющимся условиям внутри организма и в окружающей среде. Дыхательный центр состоит из 2 отделов: инспираторного и экспираторного. Источниками информации для попеременной активации этих отделов являются механорецепторы трахеи, бронхов и легких, а также хеморецепторы.
Роль механорецепторов в регуляции дыхания
Механорецепторы расположены в гладких мышцах, в подслизистом слое и эпителии дыхательных путей. В зависимости от локализации и характера рефлекторных ответов выделяют 3 типа рецепторов:
1. Рецепторы растяжения - находятся в гладких мышцах трахеи и бронхов. Раздувание легких вызывает торможение вдоха и активацию усилий выдоха. Активная аспирация воздуха из дыхательных путей приводит к активации вдоха. Эти реакции по саморегуляции дыхания называются рефлексом Геринга-
69

Брайера. Однако этот рефлекс может нарушаться. Раздражение рецепторов растяжения при ИВЛ с повышенным давлением - одна из самых частых причин продленного апноэ в анестезиологии.
2.Ирритантные рецептары - находятся на всем протяжении эпителиального и субэпителиального слоев трахеи и бронхов. Раздражение этих рецепторов возникает при резком изменении объема легких (например, при пневмотораксе) и при химическом или механическом воздействии на слизистую оболочку трахеи и бронхов. Ответная рефлекторная реакция: кашель и рефлекторная бронхоконстрикция.
3.J-рецепторы («юкстакапиллярные» рецепторы) -
расположены в интерстиции альвеол и респираторных бронхиол вблизи капилляров. Раздражителями этих рецепторов являются повышение давления в малом круге кровообращения и избыточное количество жидкости в интерстиции легких. Рефлекторный ответ
-появление частого поверхностного дыхания и бронхоконстрикция. Клинические состояния, для которых характерно раздражение J- рецепторов - отек легких, застой крови в малом круге кровообращения, пневмония, эмболия мелких сосудов легких.
,Ролъ хеморецепторов в регуляции дыхания
Хеморецепторы в зависимости от локализации делятся на 2 группы:
1.Центральные - расположены в продолговатом мозге, чувствительны к напряжению СО2 и рН спинномозговой жидкости.
2.Периферические - расположены в дуге аорты и в области бифуркации общей сонной артерии, чувствительны к газовому составу артериальной крови. В этих зонах расположены барорецепторы, реагирующие на изменение АД. Периферические хеморецепторы представляют собой самостоятельные образования, заключенные в особых тельцах - клубочках, которые находятся вне сосуда. В ответ на снижение напряжения кислорода
вкрови они вызывают рефлекторное увеличение легочной вентиляции. Эти рецепторы находятся в состоянии возбуждения даже в условиях нормоксии, и только при вдыхании чистого кислорода их возбуждение купируется. Кроме того, артериальные хеморецепторы чувствительны и к повышению напряжения СО2.
Они ответственны за начальную быструю фазу гипервентиляции
вответ на гиперкапнию.
Врегуляции дыхания функции центральных и периферических рецепторов дополняют друг друга и проявляют синергизм. Особое значение периферические хеморецепторы приобретают в условиях гипоксии головного мозга, когда чувствительность центральных хеморецепторов продолговатого мозга ослабевает или полностью утрачивается. В такой ситуации артериальные хеморецепторы служат «аварийным» механизмом реакции дыхания на изменение газового состава крови.
Характер дыхания может изменяться и под действием высших отделов головного мозга, включая кору. Эмоциональный стресс, ожидание физической нагрузки, как и сама нагрузка, увеличивают частоту дыхания.
Таким образом, повреждение регуляторных структур на любом уровне приводит к развитию наиболее яркого симптома центрогенного вида дыхательной недостаточности в виде
патологических ритмов дыхания. Патологические ритмы дыхания:
-дыхание Чейна — Стокса (признак гипоксии головного мозга) характеризуется нарастанием амплитуды дыхания до выраженного гиперпноэ, а затем уменьшением ее вплоть до апноэ, после чего цикл дыхательных движений повторяется по описанной схеме;
-центральная нейрогенная гипервентиляция (при повреждении гипоталамуса), дыхание «машинного» типа;
-апнейстическое дыхание (повреждение нижних отделов покрышки мозга) характеризуется судорожным непрекращающимся усилием вдохнуть, изредка прерываемым выдохом;
-групповое периодическое дыхание (повреждение нижних отделов покрышки мозга);
-биотовское дыхание, или атактическое дыхание
(поражение верхних отделов ствола);
-дыхание агоналъного типа (гаспинг от англ. «gasp» - ловить воздух, задыхаться) характеризуется единичными,
70 |
71 |

редкими, убывающими по силе «вздохами», которые наблюдаются при повреждении продолговатого мозга и в атональный период.
Кроме патологических ритмов дыхания, к центрогенным нарушениям дыхания относятся:
-потеря дыхательного автоматизма с сохраненным произвольным контролем (центральные формы синдрома сонного апноэ, в частности, синдром «проклятия Ундины». Синдром характеризуется утратой дыхательного автоматизма и остановкой дыхания во сне);
-полная утрата произвольной регуляции дыхания при сохраненном дыхательном автоматизме (синдром деэфферентации - "locked-in" - при обширных инфарктах ствола мозга).
Мышечный аппарат и процесс дыхания
Давление в легких (альвеолярное давление) к концу вдоха или выдоха при открытой голосовой щели соответствует атмосферному, а вне легкого (внутриплевральное давление) меньше атмосферного, т. е. отрицательное. Разница внутриплеврального и внутриальвеолярного давления обеспечивает движение потока воздуха. Перемещение воздушного потока осуществляется благодаря работе мышц дыхания.
Важнейшей мышцей вдоха является диафрагма. При сокращении диафрагмы ее купол опускается на 1,5-7 см, при этом легкие растягиваются. Движение диафрагмы обычно обеспечивает 75% изменения объема грудной полости. При спокойном дыхании диафрагма является единственной активной инспираторной мышцей. При необходимости увеличения вентиляции (физическая нагрузка или при патологии) активизируются наружные межреберные мышцы, а также группы мышц, называемые дополнительными, или вспомогательными дыхательными мышцами: грудинно-ключично-сосцевидные и лестничные. В отличие от вдоха, выдох в нормальных условиях в состоянии покоя проходит пассивно. Эластическая тяга легких и грудной стенки обеспечивает возникновение градиента экспираторного процесса. При обструкции или констрикции
72
воздухоносных путей выдох становится активным процессом, требующим работы экспираторных мышц: внутренних межреберных и брюшных (наружная и внутренняя косые, поперечная брюшная и прямая брюшная). Дополнительными мышцами выдоха являются мышцы голосовой щели и диафрагмы.
Дыхательные мышцы, сокращаясь, выполняют определенную работу, которую можно представить как произведение объема и давления. Во время вдоха мышечная энергия расходуется на преодоление сопротивления дыхательных путей и легочное эластическое сопротивление.
Увеличение любого из видов сопротивления приводит к увеличению работы дыхания. Эластическое сопротивление возрастает при вентиляции большими объемами, при снижении растяжимости легких (пневмония, острый респираторный дистресс-синдром, эмфизема). Рост сопротивления дыхательных путей возникает при учащении дыхания, нарушении проходимости дыхательных путей в результате обструктивно-констриктивных процессов (см. «Сопротивление дыхательных путей»). На работу дыхательных мышц в норме приходится от 2 до 5% потребляемого организмом кислорода. При патологии энергетические затраты возрастают в 5-10 раз и более, при этом соотьетственно резко увеличивается потребление кислорода дыхательными мышцами. Уменьшение работы дыхания является одной из основных задач вспомогательной искусственной вентиляции легких (ВИВЛ).
Легочные объемы и емкости
К важнейшим статичным показателям, характеризующим внешнее дыхание, относятся легочные объемы и емкости (рис.11).
Легочные емкости представляют собой сумму двух и более объемов. Исследование статичных объемов проводится при спокойномдыхании.
Дыхательный объем - количество воздуха, поступающего в легкие за один спокойный вдох (ДО » 500 мл).
Резервный объем вдоха - максимальное количество воздуха, которое человек может вдохнуть после нормального вдоха (РОвд. » 2 500 мл).
73
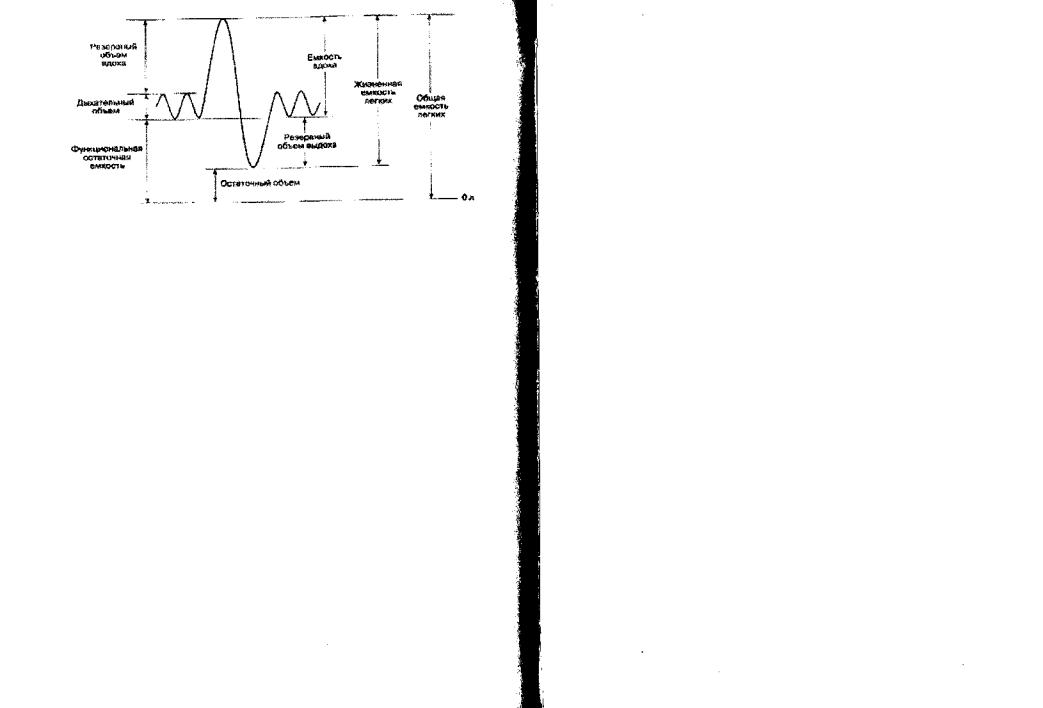
Рис. 11. Спирограмма статических легочных объемов (J.F. Nunn Applied Respiratory Physilogy, 3rd ed.Butterworths, 1987)
Резервный объем выдоха - максимальное количество воздуха, которое человек может выдохнуть после спокойного выдоха (РОвыд. » 1 500 мл).
Жизненная емкость легких - наибольшее количество воздуха, которое человек может выдохнуть после максимального глубокого вдоха (ЖЕЛ » 60 - 70 мл/кг).
ЖЕЛ = ДО + РОвд. + РОвыд.
ЖЕЛ зависит от возраста, роста, массы тела, физического развития, общей растяжимости легких и грудной клетки.
Остаточный объем - количество воздуха, которое остается в легких после максимально глубокого выдоха (00 » 1 000 мл).
Общая емкость легких - количество воздуха, содержащегося в легких на высоте максимального вдоха.
ОЕЛ = ЖЕЛ + ОО.
Функциональная остаточная емкость - количество воздуха, которое остается в легких в конце спокойного выдоха.
ФОЕ = РОвыд. + ОО.
Величина ФОЕ имеет большое значение при индукции в наркоз и интубации, а также тесно связана с понятием
кислородного резерва организма. Кислородный резерв (КР) состоит из:
74
-остатка кислорода в легких;
-кислорода, находящегося в связи с гемоглобином;
-растворенного кислорода.
Основным источником кислорода является дыхательная смесь, находящаяся в легких (при апноэ эта величина равна ФОЕ). Если пациент до наступления апноэ дышал атмосферным воздухом (FiO2= 0,21), то при ФОЕ = 2 300 мл объем кислорода в легких составит:
КР = ФОЕ * FiO2 = 2 300 мл * 0,21= 480 мл кислорода. При таком кислородном резерве тяжелая гипоксемия
разовьется через 90 с.
Если пациент перед апноэ дышал чистым кислородом (FiO2 = 1), то запас кислорода в легких будет равен величине ФОЕ:
КР = ФОЕ * FiO2= 2 300 мл * 1 = 2 300 мл кислорода. Такой объем кислородного резерва позволит отсрочить
развитие гипоксемии на 4-5 мин. Эта концепция лежит в основе проведения преоксигенации перед индукцией анестезии.
На величину ФОЕ влияют:
-рост - ФОЕ прямо пропорционально росту;
-ожирение - ФОЕ снижается за счет уменьшения растяжимости грудной стенки;
-пол - у женщин ФОЕ на 10% ниже, чем у мужчин;
-положение тела - ФОЕ уменьшается при горизонтальном положении тела;
-рестриктивные заболевания легких - снижают ФОЕ;
-тонус диафрагмы - хороший тонус и подвижность диафрагмы способствуют увеличению ФОЕ.
Одной из ведущих причин этих изменений ФОЕ является феномен экспираторного закрытия дыхательных путей (ЭЗДП). Во время выдоха, когда объем легких уменьшается и приближается к остаточному, часть воздуха задерживается и остается в альвеолах вследствие ЭЗДП. Закрытие дыхательных путей происходит на уровне мелких бронхиол, не имеющих хрящевой основы, и в том месте, где плевральное давление в какойто момент выдоха превышает внутрибронхиальное. В связи с тем, что различные зоны легких вентилируются асинхронно, с разной объемной скоростью и, следовательно, при различных градиентах
75
