
- •3.1. Онкогены
- •4.2. Выявление и мониторинг химических канцерогенов
- •5.1. Общая характеристика онкогенных вирусов
- •5.2. Онкогенный потенциал вирусов и механизмы его проявления
- •5.3. Вирусы папиллом и их роль в канцерогенезе шейки матки
- •5.4. Роль вируса гепатита в развитии рака печени
- •5.8. Ретровирусы типа D (SRV)
- •5.9. Эндогенные ретровирусы человека
- •5.10. О возможном участии ретровирусов в индукции рака молочных желез человека
- •7.1. Цитоскелет
- •7.2. Распластывание и локомоция нормальных клеток
церогенеза, идентификации онкоге нов и поиска их клеточных предшест венников. Нормальные клеточные ге ны, которые в составе вирусного ге нома превращаются в v-onc, обознача ются как протоонкогены. Следует от метить, что в результате мутаций, включая перестройку хромосом, про тоонкогены могут превращаться в он когены и без участия вируса. В этом случае говорят о клеточных онкогенах (с-опс): На основе изучения вирусных онкогенов разработаны подходы к вы явлению клеточных онкогенов в неви русных опухолях (см. раздел 3.1).
Канцерогенез, вызываемый низкоонкогенными (лейкемогенными) ви русами, отличается по своему меха низму от канцерогенеза, вызываемого высокоонкогенными ретровирусами. Эти вирусы не имеют онкогенов и должны создать их по крайней мере в некоторых зараженных клетках. На модели вируса лимфоидного лейкоза птиц было показано, что вызываемый этим вирусом лейкоз моноклонален, т. е. возникает из одной клетки, кото рая приобрела опухолевые свойства. В Д Н К лейкемических клеток был вы явлен ретровирусный ДНК-провирус, встроившийся в клеточный геном ря дом с протоонкогеном туе. Экспрес сия этого гена осуществлялась при помощи сильного вирусного промото ра, локализованного в LTR, и в 50— 100 раз превышала уровень его обыч ной экспрессии. При такой регуляции протоонкоген превратился в клеточ ный онкоген с-тус, ответственный за появление опухолевого фенотипа ис ходной клетки и ее потомства. По скольку встройка провируса носит случайный характер и достаточно ред ка, этот феномен объясняет низкую онкогенность, моноклональность и длительный латентный период заболе вания.
* * *
Многие вирусы обладают способ ностью вызывать опухоли in vivo и/ или индуцировать неопластическую
трансформацию клеток in vitro. Такие вирусы считаются опухолеродными. Они принадлежат к нескольким груп пам ДНК-содержащих (папова-, аде- но-, герпес-, покс- и гепаднавирусы) и к одной группе РНК-содержащих вирусов (ретровирусы). Некоторые из вирусов в естественных условиях вы зывают онкогенные инфекции, веду щие к возникновению опухолевых за болеваний человека и животных (па пиллома-, герпес-, покс-, гепадна- и ретровирусы), в том числе часто встре чающихся опухолей человека (аногенитальный рак, гепатома). Онковиру сологические исследования сыграли выдающуюся роль в открытии онкоге нов — генов, непосредственно отве чающих за опухолевую трансформа цию клетки. Важной нерешенной за дачей онковирусологии является раз работка подходов к профилактике он когенных инфекций человека и сель скохозяйственных животных.
Рекомендуемая литература
Филдс Б., Найл Д. (ред.) // Вирусология. — Т. 1. - М.: Мир, 1989.
Gross L. Oncogenic viruses. — Oxford: Pergamon Press, 1970.
Weiss R., Teich N., Varmus H., Coffin J. (eds). RNA tumor viruses. — CSHL, 1982.
5.2. Онкогенный потенциал вирусов и механизмы его проявления
Ф. Л. Киселев
Вопрос о роли вирусов в канцеро генезе — один из наиболее интерес ных вопросов современной онколо гии. Опухоли, у которых вирусы иден тифицированы в качестве этиологиче ских факторов, выявлены у многих видов млекопитающих и птиц. Эти вирусы оказались способны вызывать злокачественную трансформацию кле ток in vitro, что позволило получить прекрасные модели для изучения кан церогенеза in vitro и для изучения взаимодействия клеточных и вирус ных генов, контролирующих проли-
274
феративную активность клеток, что имеет и общебиологическое значение.
Исторический аспект проблемы освещен в предыдущем разделе. Здесь мы сконцентрируем внимание читате лей на общих 1;ринципах перестройки генетической программы клеток под действием вирусов таким образом, что клетка перестает контролировать соб ственное деление. Основное внима ние будет уделено вопросам транс формации клеток in vitro, поскольку именно на этих моделях возможно по лучение адекватного ответа на вопрос о том, какие клеточные и вирусные гены вовлечены в этот процесс.
Рассмотрение в настоящем разделе только данных, касающихся роли ви русов в канцерогенезе у человека, объясняется двумя обстоятельствами: во-первых, это одна из наиболее акту альных проблем онкологии, исследо вания в которой привели к созданию эффективных вакцин против некото рых форм рака, а во-вторых, вирусы, которые этиологически связаны с опухолями человека, принадлежат к различным группам как ДНК - , так и РНК-содержащих вирусов, и на их примере могут быть рассмотрены многие вопросы вовлеченности вирус ных и клеточных генов в процессы канцерогенеза in vivo.
5.2.1. Трансформация клеток вирусами in vitro
Вирусы, которые индуцируют опу холи, принадлежат к нескольким так сономическим группам. Все РНК - со - держащие вирусы относятся к семей ству ретровирусов, а ДНК-содержа- щие вирусы происходят из 7 различ ных групп (см. раздел 5.1).
Среди РНК-содержащих вирусов, различающихся по морфологии внут реннего ядра вириона, наиболее мно гочисленной является группа вирусов С-типа млекопитающих и птиц, кото рые вызывают лейкозы, саркомы, лимфомы и некоторые другие виды опухолей. Эти вирусы можно условно разделить на две группы по структуре
18*
генетического материала, но предста вители обеих групп имеют одну сход ную структуру в составе своей Р Н К — на обеих концах молекулы имеются так называемые LTR, выполняющие регуляторную функцию и содержащие промоторные и энхансерные последо вательности. Кроме того, LTR играют ключевую роль в процессах интегра ции вирусного генома в клеточный. Сюда же относятся еще две группы вирусов — В-тип MMTV, а также BLV и HTLV I. Для этих вирусов также ха рактерно наличие LTR на обеих кон цах РНК .
Среди ДНК-содержащих вирусов наиболее представительны аденовиру сы, которые вызывают опухоли раз личных типов у многих животных (кроме человека). Среди других групп ДНК-содержащих вирусов лишь от дельные обладают онкогенным потен циалом, и среди них наибольший ин терес вызывают вирус гепатита В, ас социированный с опухолями печени, вирус Эпштейна—Барр, выявляемый в лимфомах Беркитта и опухолях носо глотки, и вирус папилломы человека — этиологический агент рака шейки матки.
Независимо от таксономической принадлежности генетическая страте гия указанных вирусов сводится к проявлению онкогенного потенциа ла, т. е. к изменению генетической программы клеток, приводящей в ко нечном итоге к их неконтролируемо му росту. Репликация онкогенных ретровирусов не является цитопатогенной, и, следовательно, злокачест венная трансформация на клеточном уровне конкурирует с продукцией ин фекционных вирусных частиц, а про дукция вирионов не является необхо димой для онкогенеза. Для ДНК-со держащих вирусов синтез инфекцион ного потомства приводит, как прави ло, к клеточной гибели; следователь но, в этом случае онкогенная транс формация возможна только тогда, ко гда инфекционный вирусный цикл прерван. Это достаточно четко прояв ляется у аденовирусов и вирусов по-
275
лиомы, где в нечувствительной систе ме происходит абортивный цикл раз множения, сопровождающийся транс формацией клеток. У вирусов папил лом ситуация сложнее, поскольку для этих вирусов фактически отсутствуют чувствительные клеточные системы инфицирования вирусами этой группы.
Некоторые вирусы могут функцио нировать в качестве опухолеродных факторов в природных условиях, дру гие проявляют свой онкогенный по тенциал только у неприродных хозяев. Возможности вирусов как индукторов опухолей сильно варьируют. Наиболее активные ретровирусы могут иниции ровать опухолевый рост у животных в течение нескольких дней. Для боль шинства других вирусов характерен более длительный латентный период, и лишь у небольшого процента зара женных хозяев возникают неоплазии. Все опухоли человека, ассоциирован ные с вирусными инфекциями, при надлежат к этой категории. Тот факт, что образование опухоли не есть пря мой результат только вирусной ин фекции, свидетельствует о многосту пенчатой природе онкогенеза, при ко тором каждый этап представляет со бой независимое и необратимое гене тическое событие, которое в той или иной степени связано с нарушениями в регуляции клеточного размножения. Вирусная инфекция представляет со бой один из этих этапов; только в том случае, если проявляются остальные, возможно возникновение опухоли. Частичным подтверждением этому яв ляется тот факт, что в культурах in vit ro вирус может трансформировать клетки как до полностью трансфор мированного фенотипа (и такие клет ки вызывают опухоли у чувствитель ных животных), так и вызывать не полную трансформацию, которая со провождается изменениями в морфо логии клеток и ростовых характери стик, но такие клетки не способны формировать опухоль in vivo.
Открытие вирусиндуцированной трансформации сыграло решающую
роль в переходе онкологических ис следований на молекулярно-генетиче- ский уровень. Большинство осново полагающих факторов, которые нам известны и которые важны для пони мания молекулярных механизмов кан церогенеза, в основном получены при изучении опухолеродных вирусов. Эти исследования привели к созданию унифицированной гипотезы о том, что трансформация клеток с после дующим формированием опухолевого фенотипа возникает в результате му тационных изменений в генах, кон тролирующих размножение клеток.
Механизмы вирусиндуцированной трансформации могут отличаться в де талях, но все они имеют следующие общие свойства: 1) для трансформации достаточно единственной вирусной частицы. Вирусиндуцированная трансформация является "одноударным" процессом; 2) полностью или частично вирусный геном должен присутствовать в опухолевых клетках, при этом, как правило, продукция ви русных частиц отсутствует; 3) вирус ный геном в опухолевых клетках дол жен экспрессироваться; 4) трансфор мация приводит к нарушению кон троля деления клеток.
Изменения в клеточных парамет рах, сопровождающих трансформа цию, являются множественными и ка саются в основном изменений в рос товых свойствах и клеточной морфо логии (подробнее см. в главе 6). Сле дует лишь подчеркнуть, что критерии трансформации, индуцируемой виру сами, сходны с теми, которые прояв ляются при индукции другими факто рами.
5.2.2. Вирусиндуцированная трансформация как модель для изучения контроля клеточного цикла и пути передачи сигнала
До недавнего времени изучение ре гуляции клеточного цикла было в зна чительной степени ограничено из-за отсутствия адекватного генетического
276
анализа, однако изучение онкогенного действия белков, кодируемых опу холевыми вирусами (прежде всего ДНК-содержащими), внесло весомый вклад в понимание механизмов, кон тролирующих размножение клеток млекопитающих. Именно эти иссле дования способствовали пониманию роли супрессорных белков — продук тов гена ретинобластомы и р53 как ре гуляторов клеточной пролиферации. Каждый из этих белков обеспечивает блок в прогрессии клеточного цикла на стадии G 1 . Ген ρ53 является также ключевым в запуске программируе мой клеточной гибели (апоптоза) в ответ на различные сигналы. Белки ДНК-содержащих вирусов ингибируют активность обоих указанных бел ков — супрессоров, индуцируя тем са мым переход покоящихся клеток в S- фазу.
Анализ онкогенов, выявленных в РНК-содержащих вирусах, позволил прояснить многие механизмы переда чи сигнала, связывающего клеточную поверхность с генетическим аппара том в составе ядра. Наиболее впечат ляющим оказался тот факт, что онко гены, идентифицированные в составе РНК-содержащих вирусов, кодируют белки, участвующие практически в каждом этапе передачи сигнала. Кро ме того, изучение этих вирусных он когенов позволило идентифициро вать много новых участников этого сложного пути. В отличие от онкоге нов ДНК-содержащих вирусов онко гены РНК-содержащих вирусов не яв ляются истинно вирусными генами — они представляют собой клеточные гены, которые приобретаются в про цессе репликации вируса с последую щей селекцией по трансформирован ному фенотипу, поскольку именно трансформированные клетки обеспе чивают возможность их длительного размножения в культуре.
Таким образом, изучение опухоле родных вирусов имеет важное значе ние для понимания механизма кон троля клеточного роста и является не обходимым инструментом для после
дующего детального анализа молеку лярных механизмов этого процесса. Влияние ДНК-содержащих и Р Н К - содержащих вирусов различно, каж дая группа имеет уникальные возмож ности для расшифровки механизмов онкогенеза. Сочетание этих двух ви русных онкогенных систем может обеспечить широкий эксперименталь ный подход к изучению контроля кле точной пролиферации, дифференцировки и нарушений этого контроля, которые происходят при злокачест венной трансформации.
5.2.3. Механизмы трансформации клеток РНК-содержащими вирусами
РНК-содержащие вирусы обладают рядом специфических особенностей, позволяющих им осуществлять свой онкогенный потенциал: 1) обратная транскрипция однонитчатой вирусной Р Н К в двунитчатую Д Н К ; 2) интегра ция этой Д Н К в клеточную хромосо му; 3) экспрессия интегрированного провируса под контролем регуляторных последовательностей вирусного генома. Ретровирусные гены могут попадать в терминальные клетки и за тем передаваться в потомство по зако нам Менделя. Особое значение для онкогенеза имеют еще две особенно сти ретровирусного цикла: 1) способ ность приобретать и трансдуцировать клеточный генетический материал и 2) инсерционная активация (а часто и инактивация) клеточных генов в ре зультате интеграции провируса.
В настоящее время ретровирусы выявлены у нескольких видов живот ных: птиц, мышей, кошек, крупного рогатого скота и обезьян. У человека один из сравнительно редких видов лейкоза (Т-клеточный лейкоз взрос лых) также ассоциирован с ретровирусом Т-клеточного лейкоза (HTLV I). Анализ ретровирусиндуцированной трансформации привел к открытию спектра клеточных генов, получивших название онкогены, которые являются основным действующим началом в
277
ретровирусном |
канцерогенезе |
и |
С х е м а 5.2. Общий принцип взаимодействия |
|
играют ключевую роль в процес |
РНК-содержащих вирусов с клетками |
|||
сах клеточного |
размножения |
и |
РНК-содержащие вирусы |
|
дифференцировки. |
|
|||
|
|
|||
Ретровирусы |
индуцируют |
|
||
опухоли |
и |
трансформируют |
|
|
клетки с помощью трех различ
ных механизмов.
• Большинство ретровирусов индуцируют онкогенез че рез действие онкогенов. Эти вирусы могут быть раз делены на две четко разли чимые группы: 1 ретрови русы, несущие онкоген в составе генома, которые могут быть охарактеризо ваны как трансдуцирующие ретровирусы (об этих вирусах подробно в разделе 2.1), и 2) ретровирусы, не содержащие онкогена, но индуцирующие трансфор мацию путем интеграции в
соседстве с клеточным онкоге ном с последующей его актива цией. Такие вирусы можно оха рактеризовать как цисдействующие. Практически все трансдуцирующие ретровирусы утрати ли часть вирускодирующей ин формации в обмен на клеточные последовательности. Как резуль тат этого они дефектны по спо собности синтезировать потом ство, и для их репродукции не обходим родственный вирус-по мощник, который при совмест ной инфекции обеспечивает синтез необходимых компонен тов вирусной частицы (белков оболочки вириона). Такие виру сы являются "эффективным кан церогеном", способны транс формировать клетки в культуре и вызывать опухоли с коротким латентным периодом (несколько дней). Возможный механизм действия вирусов этой группы представлен на схемах 5.2, 5.3.
Φ Все цисактивирующие ретрови русы (см. ниже) содержат полный
278

С х е м а 5.3. Общий принцип взаимодействия ДНК-содержащих
вирусов с клетками
Вирусная ДНК
кодируют |
неструктурные |
(т. е. |
протоонкогенов, или с-onc, сохраня |
||||||||||||||
не входящие в состав вирусной |
ются на протяжении длительного эво |
||||||||||||||||
частицы) |
регуляторные |
|
белки. |
люционного периода. К примеру, он |
|||||||||||||
Эти белки |
могут |
активировать |
когены ras |
и jun выявлены у эукариот — |
|||||||||||||
как собственные энхансерные и |
от дрожжей до человека. Это позволя |
||||||||||||||||
промоторные |
последовательно |
ет предполагать, что они выполняют |
|||||||||||||||
сти |
внутри |
регуляторной |
облас |
важные функции у различных жиз |
|||||||||||||
ти вирусного генома (LTR), так |
ненных форм, не требующие сущест |
||||||||||||||||
и |
регуляторные |
последователь |
венных изменений в процессе эволю |
||||||||||||||
ности, контролирующие |
|
актив |
ции. Эти функции онкогенов осуще |
||||||||||||||
ность клеточных генов, |
контро |
ствляют их продукты, называемые он- |
|||||||||||||||
лирующих |
пролиферацию, спо |
кобелками. |
Онкобелки |
|
по |
определе |
|||||||||||
собствуя |
тем |
самым |
бескон |
нию должны обладать |
потенциальны |
||||||||||||
трольному |
делению |
клеток и |
ми |
возможностями |
индукции |
клеточ |
|||||||||||
формированию |
опухоли. |
Этот |
ной |
трансформации. Канцерогенный |
|||||||||||||
феномен |
получил |
название |
потенциал онкогенов возникает в ре |
||||||||||||||
трансактивации. Ярким |
приме |
зультате изменения |
их |
нормальной |
|||||||||||||
ром являются РНК-содержащий |
физиологической функции. Из этого |
||||||||||||||||
вирус Т-клеточного лейкоза че |
следует, что для понимания онкоге- |
||||||||||||||||
ловека (HTLV I) и ДНК-содер- |
ниндуцированного |
канцерогенеза не |
|||||||||||||||
жащий вирус гепатита В (HBV). |
обходимо |
знание |
нормальных |
функ |
|||||||||||||
|
|
|
|
|
|
|
|
|
ций клеточных онкогенов. Для этого |
||||||||
5.2.4. Онкогены |
|
|
|
|
существуют три принципиальных под |
||||||||||||
как компоненты |
|
|
|
|
хода: 1) анализ нуклеотидной и ами |
||||||||||||
регуляторной |
системы |
нокислотной последовательности для |
|||||||||||||||
клетки, |
контролирующей |
выявления |
уровней гомологии |
между |
|||||||||||||
клеточным |
и вирусным |
геном; |
2) ис |
||||||||||||||
пролиферацию |
|
|
|
|
|
||||||||||||
|
|
|
|
|
следование |
специфичности |
экспрес |
||||||||||
и дифференцировку |
|
|
|
||||||||||||||
|
|
|
сии протоонкогена; 3) анализ специ |
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
Онкогены, обнаруженные в геноме |
фических биохимических свойств он- |
||||||||||||||||
ретровирусов, |
происходят |
из |
клеточ |
кобелка, таких, к примеру, как фер |
|||||||||||||
ного генома. |
Большинство |
клеточных |
ментативная активность, связывание с |
||||||||||||||
279
гормонами, ростовыми факторами, лигандами, или сиквенс-специфиче- ский аффинитет для нуклеиновых ки слот. Данные, полученные в этом на правлении, позволили классифициро вать все онкогены как единую группу регуляторов клеточного размноже ния. Они являются компонентами сигнальной сети, которая получает информацию вне клетки и переносит ее в ядро, где эта информация отра жается в форме активности различных генов, контролирующих пролифера цию.
Типичный ростовый сигнал прояв ляется на клеточной поверхности в форме полипетидного ростового фак тора и связывается с собственным специфическим рецептором. Этот ре цептор, часто являющийся интеграль ным белком мембраны, обладающим тирозинспецифической киназной ак тивностью, подвергается активации в результате связывания с лигандом (к примеру, он может димеризоваться, что приводит к возрастанию его ки назной активности с последующим аутофосфорилированием специфиче ских остатков на молекуле рецептора, но локализованных в цитоплазме). Сигнал далее передается путем после довательных и специфических белокбелковых взаимодействий, доходя до ядра. Конечным результатом входя щих сигналов должны быть транс крипционные факторы, способные направлять работу определенных кле точных генов.
Далее мы представим возможные общие пути участия онкогенов в регу ляции клеточной пролиферации.
Вне клетки наиболее известным является онкоген sis, который проис ходит из гена, кодирующего P D G F . Онкоген int2, который отсутствует в геноме ретровирусов, но может быть цисактивирован вирусом опухолей молочных желез мышей, кодирует бе лок, родственный ростовому фактору фибробластов. Гены Erb В, fins, kit ко дируют измененные рецепторы росто вых факторов с известными лиганда ми; несколько других онкогенов про
дуцируют белки, которые имеют структуру, сходную со структурой ре цепторов ростовых факторов, лиганды которых еще предстоит идентифици ровать. Продукты генов семейства ras находятся в цепи передачи сигнала. Точные функции src, abl и других нерецепторных киназ до сих пор окон чательно не установлены, возможно, они необходимы для амплификации поступающего сигнала. Некоторые из онкогенов кодируют цитоплазматические киназы, которые специфичны для тирозина (fps) или для серина и треонина (rаf, mos). Все ядерные он когены контролируют транскрипцию. Некоторые из них (fos, jun, rel) явля ются транскрипционными факторами, другие (онкогены семейства туc) час то активируются в опухолях человека.
Следует подчеркнуть, что в опухо лях разного происхождения в гистоге незе могут наблюдаться изменения в онкогенах без какой-либо специфич ности, но тем не менее можно пред положить, что качественные и коли чественные изменения в этих генах, контролирующих пролиферацию кле ток, являются одним из ключевых мо ментов, приводящих клетки к некон тролируемому размножению.
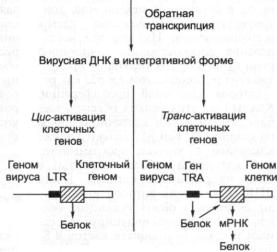
5.2.5. Цис-активация под действием вирусов
Многие ретровирусы, которые не содержат в своем составе онкогена, тем не менее способны к индукции опухолей у животных, причем спектр опухолей, вызванных этими вирусами, фактически не отличается от таковых, вызываемых транедуцирующими рет ровирусами: это саркомы, различные виды лейкозов и карциномы. Основ ное же отличие состоит в продолжи тельности латентного периода, кото рый в случае вирусов без онкогена может варьировать от нескольких не дель до нескольких месяцев. Кроме того, эти вирусы не способны вызы вать онкогенную трансформацию кле ток в культуре. Опухоли, вызванные нетранедуцирующими ретровируса-
280
ми, имеют несколько важных свойств для понимания их функционирова ния. Все они содержат интегрирован ный провирус. Провирусные последо вательности обнаруживаются в одном и том же хромосомальном сайте во всех клетках одной определенной опу холи, следовательно, каждая опухоль является моноклональной, т. е. про исходит из одной трансформирован ной клетки. Хотя инфекция иниции руется недефектным вирусом, кото рый проходит множественные циклы репликации, провирусы, идентифици рованные в опухолевых клетках, как правило, являются дефектными и со держат лишь часть вирусного генома. Основным фрагментом, который все гда сохраняется в опухолях, является "левый" LTR, а часть кодирующих по следовательностей (а иногда и все) могут быть утеряны. Это свидетельст вует о том, что последовательности, кодирующие белки вириона, не явля ются необходимыми для поддержания трансформированного фенотипа. Но наиболее важным является тот факт, что имеются предпочтительные сайты клеточного генома, куда интегрирует ся вирусный геном. В нескольких ти пах опухолей эти сайты локализуются в непосредственной близости от кле точного онкогена, что является харак терным и для трансдуцирующих рет ровирусов.
В результате интеграции ретровируса поблизости от онкогена наблюдает ся повышение его экспрессии. Такой феномен получил название инсерционной (вставочной), или цисактивации. Идентифицировано два принци пиальных механизма такого типа акти вации: инсерция промотора и инсерция энхансера. В случае инсерции про мотора происходит образование химер ной РНК, содержащей LTR ретровируса с последовательностями клеточного онкогена. Естественно, что если акти вация происходит с 5'-LTR, то в состав химерной Р Н К могут входить и после довательности кодирующих вирусных генов. Если же активация инициирует ся с З'-LTR (что бывает чаще), то ви
русные последовательности в химер ной Р Н К отсутствуют. Предпочтитель ный интеграционный сайт при инсер ции промотора локализуется внутри онкогена, что сопровождается редук цией кодирующих последовательно стей онкогена или удалением некодирующих доменов, которые содержат негативные регуляторные элементы. В случае инсерции энхансера интеграция провируса в правильной ориентации по отношению к клеточному онкогену не является обязательной, и он может локализоваться "down stream" по отно шению к клеточному гену. В случае инсерции энхансера транскрипты он когена не содержат вирусных последо вательностей.
Классическим примером цисактивации является лимфолейкоз птиц, вызванный вирусом ALV. При этом провирус (вирус, ассоциированный с вирусом саркомы Рауса RAV1 или RAV2)
интегрируется в В-клеточных лимфомах, возникающих через не сколько месяцев после инокуляции, в соседстве с онкогеном тус и резко ак тивирует его экспрессию. Другим примером такого рода является эритролейкоз, возникающий у некоторых линий кур, также вызываемый виру сом RAVI. В этом случае провирус интегрируется в соседстве с геном erb В1, экспрессия которого возрастает в опухолевых клетках.
Еще одним вирусом, который функционирует по типу инсерционного мутагенеза, является вирус опу- холй молочных желез (ММТV). Этот вирус имеет несколько предпочти тельных сайлюв итеграции. Среди них наиболее часто встречаются та кие, которые локализуются в непо средственной близости к трем клеточ ным генам: int1, int2 и int3. Эти гены локализованы на разных хромосомах, и гомология в нуклеотидных последо вательностях этих генов отсутствует. В опухолях молочных желез, индуцируе мых MMTV, вирус повышает транс крипцию соседних локусов int, и именно этот феномен играет ключе вую роль в развитии опухолей.
281
|
Ген Intl (или wntl), по-видимому, |
SV40 и полиомы вызывают образова |
|||||||||||||||||||||
играет роль в развитии, int2 принадле- |
ние опухолей у многих эксперимен |
||||||||||||||||||||||
жит к семейству ростовых факторов, а |
тальных животных, но не у природ |
||||||||||||||||||||||
intЗ |
— также к генам, участвующим в |
ных хозяев. |
|
|
|
|
|
|
|
|
|
|
|||||||||||
развитии. |
|
|
|
|
|
|
|
|
Выше |
отмечалось, |
что |
трансфор |
|||||||||||
|
|
|
|
|
|
|
|
|
мирующий потенциал РНК-содержа- |
||||||||||||||
|
5.2.6. Онкогенность, |
|
щих онкогенных вирусов |
фактически |
|||||||||||||||||||
|
|
не |
связан |
с |
продукцией |
вирусных |
|||||||||||||||||
|
индуцируемая транс- |
||||||||||||||||||||||
|
частиц. |
В |
противоположность |
этому |
|||||||||||||||||||
|
активирующими |
|
|||||||||||||||||||||
|
|
онкогенные |
свойства |
ДНК-содержа- |
|||||||||||||||||||
|
ретровирусами |
|
|||||||||||||||||||||
|
|
щих вирусов тесно связаны со спо |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
Еще один механизм, по которому |
собностью этих вирусов к продуктив |
|||||||||||||||||||||
ретровирусы могут индуцировать он- |
ной инфекции. Онкогены ДНК - со - |
||||||||||||||||||||||
когенез, состоит в продукции белко |
держащих |
вирусов |
являются |
необхо |
|||||||||||||||||||
вых продуктов, кодируемых вирусным |
димыми вирусными генами и в отли |
||||||||||||||||||||||
геномом, |
которые |
способны активи |
чие от РНК-содержащих не имеют |
||||||||||||||||||||
ровать клеточные |
гены, |
необходимые |
клеточных |
|
гомологов. |
Следователь |
|||||||||||||||||
для |
контроля |
клеточной |
пролифера |
но, инфекция клеток, которая явля |
|||||||||||||||||||
ции. |
|
|
|
|
|
|
|
ется |
пермиссивной |
для |
репликации |
||||||||||||
|
Наиболее |
ярким |
представителем |
вируса, будет приводить к продуктив |
|||||||||||||||||||
этой группы |
вирусов |
является |
вирус |
ной |
инфекции, выделяя |
значитель |
|||||||||||||||||
Т-клеточного лейкоза человека (НТ- |
ное количество вирусных частиц, что |
||||||||||||||||||||||
LV), содержащий в составе своего ге |
часто приводит к гибели клеток. В |
||||||||||||||||||||||
нома последовательность, которая мо |
этом |
случае |
трансформирующий |
по |
|||||||||||||||||||
жет кодировать несколько белков, об |
тенциал не может быть выражен. |
||||||||||||||||||||||
ладающих |
трансактивирующими |
по |
Только в том случае, если инфекция |
||||||||||||||||||||
тенциями. |
|
|
|
|
|
|
|
вирусом происходит в непермиссив- |
|||||||||||||||
|
|
|
|
|
|
|
|
|
ных условиях, при которых процесс |
||||||||||||||
|
5.2.7. Механизм |
|
|
|
репликации вируса ограничен, |
фено |
|||||||||||||||||
|
|
|
|
мен |
трансформации |
|
может |
прояв |
|||||||||||||||
|
трансформации клеток |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
ДНК-содержащими вирусамиляться. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
Эффективность |
|
трансформации |
|||||||||||
|
В каждом семействе ДНК-содер- |
после |
|
инфекции |
|
непермиссивных |
|||||||||||||||||
жащих вирусов выявлены |
представи |
клеток |
аденовирусом, |
вирусом |
SV40 |
||||||||||||||||||
тели, обладающие онкогенным потен |
или полиомы очень низка, как прави |
||||||||||||||||||||||
циалом. Среди них имеются вирусы, |
ло, ниже 10-5. Эта неэффективность, |
||||||||||||||||||||||
вызывающие |
опухоли |
|
у |
природных |
по-видимому, связана с тем, что воз |
||||||||||||||||||
хозяев, в том числе и у человека, в |
можность |
|
сохранения |
интактности |
|||||||||||||||||||
других случаях они способны к ин |
вирусных |
генов, |
интегрированных |
в |
|||||||||||||||||||
дукции трансформации |
в |
клеточных |
клеточный геном с последующей их |
||||||||||||||||||||
культурах и к образованию опухолей у |
активной экспрессией, достаточно ма |
||||||||||||||||||||||
неприродных |
хозяев. |
|
Классическим |
ла. |
Трансформирующие |
потенциалы |
|||||||||||||||||
примером вирусов первого типа явля |
ДНК-содержащих вирусов проявля |
||||||||||||||||||||||
ется вирус папилломы человека, этио |
ются прежде всего в их способности |
||||||||||||||||||||||
логически связанный с раком шейки |
стимулировать |
покоящиеся |
клетки |
к |
|||||||||||||||||||
матки у человека, а вирусов второго |
вхождению в клеточный цикл, т. е. |
||||||||||||||||||||||
типа — аденовирусы, которые инду |
нарушению |
контроля |
клеточного |
де |
|||||||||||||||||||
цируют опухоли у грызунов, а их ви |
ления, и этот процесс осуществляется |
||||||||||||||||||||||
русные гены Е1А и Е1В трансформи |
в |
результате |
|
функционирования |
ви |
||||||||||||||||||
руют клетки млекопитающих в куль |
русных онкогенов. Следовательно, ко |
||||||||||||||||||||||
туре (хотя отсутствуют какие-либо |
нечным |
результатом |
является |
приоб |
|||||||||||||||||||
данные, что эти вирусы ассоциирова |
ретение клетками способности к авто |
||||||||||||||||||||||
ны |
с опухолями у |
человека). Вирусы |
номной репликации. |
|
|
|
|
|
|
|
|||||||||||||
282

5.2.8. Онкогены |
|
|
|
чием в геноме этих вирусов собствен |
|||||||
ДНК-содержащих |
|
|
|
ного |
онкогена |
(онкогенов), |
которые |
||||
вирусов |
|
|
|
|
индуцируют |
синтез белковых |
продук |
||||
|
|
|
|
|
тов, |
способных |
взаимодействовать с |
||||
Вирусная инфекция |
|
делится |
на |
различными клеточными |
генами или |
||||||
раннюю и позднюю стадии, и в каж |
их продуктами, |
которые |
осуществля |
||||||||
дой из этих стадий действуют разные |
ют контроль за пролиферацией кле |
||||||||||
вирусные гены. Ранние гены кодиру |
ток. |
|
|
|
|
|
|
||||
ют белки, участвующие в репликации |
Кроме |
того, |
может |
проявляться |
|||||||
вирусной Д Н К , |
в то время как позд |
еще один механизм, связанный с ин |
|||||||||
ние гены осуществляют синтез белков |
теграцией вирусного генома в клеточ |
||||||||||
вирусной оболочки. Для ДНК-содер |
ный, который может приводить к |
||||||||||
жащих вирусов только ранние вирус |
формированию |
нового "слитного" ге |
|||||||||
ные гены ответственны за трансфор |
на, содержащего как вирусные, так и |
||||||||||
мацию клеток. |
|
|
|
|
клеточные |
последовательности |
с не |
||||
Что касается |
молекулярных меха |
известными |
функциями |
(см. |
схему |
||||||
низмов действия, то он связан с нали |
5.4). Однако количество таких новых |
||||||||||
С х е м а |
5.4. Функции вирусных онкогенов |
|
|
|
|
|
|||||
|
|
|
Вирусы папиллом . |
|
|
|
|
|
|||
Ген Е6 |
- |
инактивация гена - супрессора р53 |
|
|
|
|
|||||
Ген |
E7 |
- |
инактивация гена - супрессора pRb |
105 |
|
|
|
||||
|
- |
взаимодействие |
с циклинами |
|
|
|
|
|
|||
|
|
(регуляторы |
клеточного |
цикла) |
|
|
|
|
|
||
Вирус Эпстайна-Барр
Гены EBNA-LP - взаимодействие с циклином D2,
иEBNA 2 взаимодействие с геном резистентности
кинтерферону (IFN)
Гены LMP и EBNA 3 - взаимодействие с геном bcl 2
Вирус герпеса 8-го типа (HHV 8)
Гены EBNA 2
и EBNA - LP - взаимодействие с циклином D2 Гены LMP 1 и EBNA 3 - взаимодействие с bcl 2
Ген gp340/220 - взаимодействие с интерлейкином 6 (IL 6) Ген EBNA 2 - ген резистентности к интерферону (INF)
Вирус гепатита В
Ген Х- активация транскрипции собственных и других
вирусных генов, трансактивация некоторых факторов транскрипции
Вирус Т-клеточного лейкоза человека (HTLV I)
Ген Tax - транс-активация генов нескольких факторов роста,
интерлейкинов, протоонкогенов
283
идентифицированных "слитных" генов |
лот), |
которые |
|
синтезируются |
со |
|||||||||||||||
невелико и их роль в канцерогенезе |
сплайсированных Р Н К и, по-видимо |
|||||||||||||||||||
неизвестна. |
|
|
|
|
|
|
му, осуществляют разные функции. |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
Белок большего размера участвует в |
||||||||||
5.2.8.1. Аденовирусы |
|
|
транспорте |
вирусных м Р Н К из ядра в |
||||||||||||||||
|
|
цитоплазму и, кроме того, может |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
Для |
клеток, |
трансформированных |
взаимодействовать с продуктом гена- |
|||||||||||||||||
аденовирусами, |
характерно |
присутст |
супрессора |
опухолевого |
роста р53, |
что |
||||||||||||||
вие большей части вирусных последо |
позволяет |
предполагать |
|
важную |
роль |
|||||||||||||||
вательностей в интегрированной фор |
этого белка в процессах канцероге |
|||||||||||||||||||
ме, но во всех типах трансформиро |
неза. |
|
|
|
|
|
|
|
|
|
|
|||||||||
ванных |
клеток |
всегда |
присутствуют |
|
|
|
|
|
|
|
|
|
|
|
||||||
только |
последовательности, |
локализо- |
5.2.8.2. Вирусы группы |
|
|
|||||||||||||||
ванные в "левой" части вирусной |
полиомы |
|
|
|
|
|
|
|
||||||||||||
ДНК . Данные по трансформации раз |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
личных |
фрагментов |
вирусного |
генома |
Два |
основных |
представителя |
этой |
|||||||||||||
четко показали, что именно последо- |
группы — вирус полиомы мышей и |
|||||||||||||||||||
вательности "ранней" |
части |
генома |
SV40 обезьян — высокородственны по |
|||||||||||||||||
контролируют |
процесс |
трансформа |
структуре генома, но различаются по |
|||||||||||||||||
ции. Последующие исследования вы |
его организации и функциям ранних |
|||||||||||||||||||
явили внутри этого участка две разли- |
генов, |
ответственных за |
трансформа |
|||||||||||||||||
чающиеся |
транскрипционные |
едини |
цию. Оба вируса кодируют мульти- |
|||||||||||||||||
цы, |
кодирующие стабильные |
мРНК, |
функциональный |
белок, |
получивший |
|||||||||||||||
которые обнаруживаются в |
цитоплаз |
название большой Т-антиген, кото |
||||||||||||||||||
ме трансформированных клеток и на |
рый участвует в инициации реплика |
|||||||||||||||||||
ранних |
фазах |
продуктивной |
инфек |
ции вирусной Д Н К путем специфиче |
||||||||||||||||
ции. Эти две транскрипционные еди |
ского связывания с участком начала |
|||||||||||||||||||
ницы, обозначаемые как Е1А и Е1В, |
репликации (origin of replication). Хотя |
|||||||||||||||||||
кодируют два основных типа м Р Н К |
такая способность является |
необходи |
||||||||||||||||||
путем |
альтернативного |
сплайсинга |
мой для |
репликации Д Н К |
и |
продук |
||||||||||||||
двух первичных транскриптов. Основ- |
тивной инфекции, эта активность не |
|||||||||||||||||||
ные продукты гена Е1А представлены |
является |
необходимой |
для |
трансфор |
||||||||||||||||
белками, состоящими из 289 и 243 |
мации. Другие же активности Т-анти- |
|||||||||||||||||||
аминокислот, |
которые |
идентичны по |
гена и, в частности, способность свя |
|||||||||||||||||
первичной структуре, но один из бел |
зываться |
с |
различными |
клеточными |
||||||||||||||||
ков имеет дополнительные 43 амино |
белками, |
контролирующими |
проли |
|||||||||||||||||
кислоты в середине белковой после |
ферацию |
клеток, |
являются |
опреде |
||||||||||||||||
довательности. Белок большего разме |
ляющей |
для |
трансформации, |
при |
||||||||||||||||
ра необходим для активации транс |
этом функции Т-антигена SV40 и ви |
|||||||||||||||||||
крипции при литической инфекции, и |
руса полиомы хотя и перекрываются, |
|||||||||||||||||||
за это ответственны |
последовательно |
но тем не менее отличны друг от дру |
||||||||||||||||||
сти, локализованные в 3'-области это- |
га. Так, оба из них способны связы |
|||||||||||||||||||
го |
гена |
(домен |
CR3). |
Указанная ак- |
ваться с Rb, но только большой Т-ан |
|||||||||||||||
тивность |
не |
является |
необходимой |
тиген |
SV40 |
способен |
связываться с |
|||||||||||||
р53. |
|
|
|
|
|
|
|
|
|
|
||||||||||
для проявления трансформации. Дру |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
гие домены белка Е1А способны взаи |
Оба вируса кодируют также низко |
|||||||||||||||||||
модействовать |
со многими |
клеточны |
молекулярный белок (малый t-анти- |
|||||||||||||||||
ми белками, включая продукт гена ре- |
ген), который содержит как последо |
|||||||||||||||||||
тинобластомы |
(Rb), |
однако |
прямых |
вательности, общие с таковыми на N- |
||||||||||||||||
доказательств |
роли |
такого |
взаимодей |
конце большого Т-антигена, так и |
||||||||||||||||
ствия пока не получено. Ген Е1В ко |
уникальные. Одной из основных ми |
|||||||||||||||||||
дирует два белка — 55 кДа (495 ами- |
шеней его действия является транс |
|||||||||||||||||||
нокислот) |
и |
19 |
кДа (175 |
аминокис- |
крипционный |
фактор |
E2F. |
Именно |
||||||||||||
284
малый t-антиген играет ключевую роль в трансформации, которая с большей эффективностью проявляет ся при взаимодействии с большим Т- антигеном.
В отличие от SV40 вирус полиомы кодирует еще один ранний белок — средний Т-антиген, который играет ключевую роль в трансформации кле ток под действием вируса полиомы. Средний Т-антиген также имеет на Ν- конце общие последовательности с большим Τ и малым t-антигенами. В отличие от других трансформирующих белков вирусов полиомы и аденовиру са, которые локализованы в ядре, средний Т-антиген вируса полиомы является интегральной частью плазма тической мембраны и способен акти вировать некоторые киназы, участ вующие в передаче сигнала.
5.2.8.3.Вирусы папиллом
Увирусов папиллом в отличие от вируса полиомы и SV40 считывание информации происходит только с од ной нити Д Н К , при этом синтезиру ются различные типы Р Н К . Образо
вание различных форм Р Н К связано с тем, что в процессе их синтеза ис пользуются альтернативные сайты инициации транскрипции, альтерна тивный сплайсинг и альтернативные сайты полиаденилирования. Эти ви русы содержат 7 генов, два из кото рых (LJ и L2) кодируют белки вирус ной оболочки, а пять других (E1, Е2, Е4, Е5, Е6, Е7) относятся к группе ранних, причем только два гена (Е6 и Е7) связаны со злокачественной трансформацией клеток. Механизм действия этих генов сводится к взаи модействию с продуктами двух ге- нов-супрессоров р53 и Rb и после дующей их инактивации, что приво дит к неконтролируемому росту. По скольку вирусы этой группы играют ключевую роль в развитии опухолей шейки матки у человека, детально вирусы этой группы и механизм их действия рассмотрены в специальном разделе 5.3.
5.2.9. Общие механизмы действия онкобелков ДНК-содержащих вирусов
5.2.9.1. Инактивация функций белка гена ретинобластомы
Как было описано выше, белок Е1А аденовирусов, Т-антиген вируса SV40 и белок Е7 вируса папиллом способны взаимодействовать с белком гена ретинобластомы. В это взаимо действие вовлечены полипептидные последовательности, нужные и для проявления трансформирующего по тенциала. Исследование роли белков Е1А в транскрипционной активации вирусных генов позволило идентифи цировать вирусный транскрипцион ный фактор E2F, который оказался необходимым для транскрипции аде новирусного гена Е2. Этот транскрип ционный фактор находится в боль шинстве клеток в комплексе с други ми белками, и в таких комплексах фактор E2F не функционирует. Белок Е1А разрушает такие комплексы, и освобождающийся E2F может исполь зоваться для транскрипции гена Е2. Способность Е1А вызывать эту диссо циацию оказалась зависимой от ви русных последовательностей, необхо димых для проявления онкогенного потенциала, включая способность связываться с Rb. Кроме того, было показано, что белковые комплексы, включающие Rb, способны связывать ся с Д Н К , и специфичность этого связывания определяется последова тельностями, узнающими E2F. Эти данные привели к выводу, что транс крипционный фактор E2F физически связан с Rb-белком и белок Е1А раз рушает этот комплекс, освобождая E2F и в свою очередь связываясь с Rb.
Кроме Rb, с Е1А способны взаи модействовать два Rb-родственных белка — p 107 и p 130 (так называемые pocket-белки), которые также нахо дятся в ассоциации с фактором E2F.
Т-антиген SV40 и белок Е7 HPV действуют по тому же принципу, раз рушая комплекс Rb/E2F.
285
Связывание Rb или родственных белков с E2F ингибирует активационные возможности фактора E2F, не влияя при этом на ДНК-связующие свойства. Для аденовируса активация E2F играет важную роль в продуктив ной инфекции, поскольку E2F акти вирует промотор гена Е2, необходи мого для синтеза вирионов. В геноме SV40 и HPV отсутствуют Е2Р-связую- щие сайты и, следовательно, E2F мо жет активировать какие-то иные кле точные гены, участвующие в процес сах трансформации. По-видимому, мишенями могут служить гены, спо собные активировать переход клеток из G1 в S-фазу клеточного цикла. Возможными кандидатами для акти вации могут быть также различные транскрипционные факторы. Кроме того, возможно взаимодействие Rb с циклинами D-типа, что также может контролировать клетки в течении G1 стадии клеточного цикла.
5.2.9.2. Инактивация функций
р53
Ген р53 относится к числу геновсупрессоров и часто подвергается му тациям в опухолевых клетках.
Каждый из ДНК-содержащих ви русов кодирует белок, который спосо бен взаимодействовать с белком р53 и как результат — инактивировать функции р53. В отличие от Rb в каж дом из вирусных белков последова тельности, взаимодействующие с р53, различаются между собой. Разные ви русные белки узнают разные последо вательности в гене р53, причем это свойство может отличать вирусы внут ри одной группы. Так, Т-антиген ви руса SV40 способен взаимодейство вать с р53, в то время как Т-антиген вируса полиомы этой способностью не обладает.
Несмотря на то что механизм взаи модействия Е1В аденовирусов, Т-ан тигена SV40 и гена Е6 вируса папил ломы с р53 не является консерватив ным механизмом из-за различия во взаимодействующих последовательно
стях, конечный результат этого взаи модействия один и тот же — потеря функций р53. Если взаимодействие Т- антигена с р53 приводит к стабилиза ции р53 в его неактивной форме, то взаимодействие белка Е6 HPV с р53 приводит к деградации за счет актива ции убиквитиновой системы.
Какие же нормальные функции р53 нарушаются вирусными генами? По-видимому, это прежде всего функ ционирование р53 в качестве транс крипционного фактора. Белок р53 способен взаимодействовать с опреде ленными последовательностями в Д Н К , которые могут выполнять функ ции промоторов. Одним из таких ге нов является WAF1, 21 кДа белок ко торого идентифицирован как ингиби тор Gl-циклинкиназной активности. Эта киназа является критической для прогрессии G1-стадии клеточного цикла и пролиферации клеток.
Инактивация функции р53 вирус ными онкогенами может нарушать нормальные функции еще одного кле точного гена — mdm2. Увеличение продукции этого гена приводит к ак тивации функций р53.
Необходимо отметить еще одну важную функцию онкобелков — ин дукция апоптоза. Интересно, что сочетанное действий Е1А и Е1В аденовиру сов приводит к онкогенной трансфор мации чувствительных клеток в культу ре, в то время как экспрессия только Е1А приводит к противоположному эффекту — апоптозу. Сходный эффект проявляется и в системе с вирусами папиллом — гены Е6 + Е7 вызывают трансформацию определенных клеточ ных линий, в то время как ген Е7 в одиночестве — апоптоз.
Следовательно, инактивация генов-
супрессоров является одним из основ ных механизмов проявления онкогенного потенциала ДНК-содержащих виру сов. Однако существуют и другие пу ти, приводящие к реализации этого потенциала и связанные главным об разом с активацией других клеточных генов, контролирующих процессы пролиферации клеток.
286
