
3 курс / Общая хирургия и оперативная хирургия / Сосудистая_хирургия_по_Хаймовичу_Том_2_Ашер_А_,_Покровский_А_В_2012
.pdf
134 Раздел VIII. Цереброваскулярная недостаточность
Таблица 66.1. Методы мониторинга и защиты при ишемии на пережатие
Мониторинг
Прямой Больной в сознании ЭЭГ
Вызванные потенциалы Непрямой
Ретроградное АД Транскраниальная допплерография
Церебральная артериовенозная разница по рО2 в яремной вене
Защита головного мозга
Метаболическая Общая анестезия Гипотермия
Гемодинамическая Искусственная гипертензия
Ингаляция СО2 или карбонатангидразы Механическая
Внутрипросветный шунт
ней после общей сонной артерии), которая будет описана ниже. Дополнительным преимуществом такой методики является то, что становится возможным оценить свободный кровоток из общей сонной артерии до пережатия внутренней, только потом компенсируя время ишемии. У 10 пациентов, не толерирующих пережатие внутренней сонной артерии вплоть до потери сознания, изолированное пережатие общей сонной толерировалось. При введении шунтов в общую сонную артерию, они заполнялись детритом, что требовало расширения артериотомии проксимально на общую сонную артерию и удлиняло операцию на 20–35 мин. Во время этого удлиненного промежутка времени больные оставались неврологически стабильными явно из-за сохранения ретроградного кровотока из наружной во внутреннюю сонную артерию. После пережатия всех сосудов для введения шунта по общепринятым рекомендациям время ишемии при пережатии достигало 20–35 мин, хотя при первичном наложении зажима на внутреннюю сонную артерию ишемия у пациента развивалась в сроки от 8 до 30 с.
Мониторинг неврологического статуса у бодрствующего больного при каротидной эндартеректомии был внедрен автором более 40 лет назад как средство наблюдения и техника защиты. Не существует другого способа мониторинга, сравнимого с неврологическим состоянием больного, находящегося в сознании. Электроэнцефалография, хотя и напрямую отражает состояние мозга, может искажаться за счет изменений на поверхности мозга и иметь ряд ограничений, включая недостаточное проявление ишемических изменений и сложность интерпретации в случае предсуществующего неврологического дефицита. Оперируя достаточно вариабельными критериями для установки внутрипросветного шунта во время общей анестезии, она может приводить к частоте использования шунтов 20–25%. Частота шунтирования в аналогичной группе бодрствующих больных составляет лишь 7%. До сих пор ЭЭГ довольно успешно применяется для мониторирования при каротидной эндартерэктомии, чему посвящена одна из последних работ Pinkerton с соавторами [128], полагающихся на ЭЭГ в ограничении шунтирования у своих пациентов.
Использование вызванных потенциалов как средства мониторирования активности мозга во время каротидной эндартерэктомии стало внедряться относительно недавно. Несколько хирургов описали ряд недостатков этой методики, заключающихся в зависимости реакций от положения головы, колебаний температуры и, возможно, от некоторых других условий, значение которых пока полностью не понятно. Гораздо больший опыт накоплен по более полезной, с хорошо известными ограничениями, методике [127, 130)] транскраниальной допплерографии [129, 131, 132]. Измерение ретроградного давления, применяющееся некоторыми исследователями около трех десятилетий, плохо коррелирует с регионарной ишемией у больных, находящихся в сознании, так как давление в 70 мм рт. ст. наблюдалось при выраженных изменениях вследствие пережатия сонных артерий, а при давлении 20 мм рт. ст. встречались пациенты, толерантные к пережатию. Кроме того, измерения проводятся в начале каротидного пережатия и не отражают изменения гемодинамики и вентиляции. Последние могут возникнуть во время операции вследствие церебральной ишемии, не выявляемой при общем обезболивании. Также слабо коррелируют между собой ретроградное давление и изменения на ЭЭГ [133–135].
Защитные меры, направленные на снижение метаболизма мозга в виде общей анестезии [136, 137] или гипотермии [138], с трудом поддаются оценке у больных, не толерирующих пережатие во время каротидной эндартерэктомии, а потому применяются редко. Воздействие на мозговую циркуляцию с помощью гиперкапнии путем ингаляции двуокиси углерода или назначения ингибиторов карбонатангидразы (диамокс) за счет вазодилатации не оказалось эффективным. Причина в том, что неишемизированные участки мозга в условиях гиперемии конкурируют с ишемизированным на фоне вазодилатации, еще более усиливая ишемию последних [139, 140].
Медикаментозная искусственная гипертензия во время пережатия сонных артерий является единственной фармакологически зависимой методикой, переводящей нетолерантных больных в состояние толерантности, что требует подъема АД свыше 200 мм рт. ст. Гипертензивные агенты повышают частоту интраоперационного острого инфаркта миокарда восьмикратно, из-за чего и не применяются [106].
Наиболее реальным способом коррекции церебральной ишемии во время пережатия является использование внутрипросветных шунтов. Их применение влияет на выполнение операции, требуя более протяженной артериотомии для четкой визуализации непораженного просвета артерий. Шунт может послужить кондуитом для эмболов из общей сонной артерии. Введение шунтов традиционным образом — первично во внутреннюю, а затем в общую сонную артерию — может не только вызвать эмболизацию, но и продлить время ишемии у тех 7% больных, которые толерируют менее 1 мин до развития признаков тяжелой ишемии головного мозга. Вышеописанная альтернативная техника имеет предпочтение при выборочном применении.
Эмболизация головного мозга
Церебральная эмболизация из зоны оперативного вмешательства часто предположительно и, возможно, ошибочно рассматривается в качестве наиболее общей причины развития неврологического дефицита. Сюда относятся и ситуации при отсутствии сознания после каротидной эндартерэктомии под общей анестезией, даже когда хирург проводит мониторинг и защиту мозга от ишемии пережатия и множество «контрольных серий» [46, 142] ха-
https://t.me/medicina_free
Глава 66. Каротидная эндартерэктомия: показания и техника каротидных реконструкций |
135 |
|
|
рактеризуются безопасностью каротидного пережатия, за исключением случаев реконструкций при стенозах с контрлатеральной окклюзией. Эмболизация может развиться на любом этапе операции. Во время выделения каротидной бифуркации мелкие или крупные агрегаты могут смещаться из нередко изъязвленных бляшек, если только не предпринимаются меры предосторожности в виде окклюзии путей оттока наложением сосудистого зажима на внутреннюю сонную артерию дистальнее бляшки до завершения выделения бульбуса сонной артерии. Зажим на общей сонной артерии также может способствовать смещению детрита, что предупреждается пережатием ниже фрагментируемой порции бляшки на уровне или ниже m. оmohyoideus, либо еще проксимальнее, если это следует из данных дооперационной ангиографии.
Еще одним источником эмболии могут послужить свободные обрывки ткани, обычно пучки гладких мышц медии, для чего эндартерэктомию следует продолжать, пока остающаяся поверхность не станет гладкой и блестящей, а циркулярная «ребристость» полностью не исчезнет. Указанная процедура также предотвращает приводящее к эмболии отложение тромбоцитов. От того же страхует дооперационное назначение аспирина и обильное орошение зоны операции для удаления сгустков крови. Последние могут образовываться на эндартерэктомированной поверхности во время закрытия артериотомии, несмотря на системную гепаринизацию. Третьим критическим моментом для возникновения эмболизации является удаление зажимов, когда эмболы могут сместиться из любого из вышеперечисленных мест. Пробный пуск кровотока из всех сосудов перед окончательным закрытием артериотомии и восстановление кровотока во внутреннюю сонную артерию в последнюю очередь помогают защитить мозг от эмболии. В раннем послеоперационном периоде тромбы образуются в каждом из ранее пережимавшихся сегментов сонных артерий. Это сложно предотвратить, если не накладывать зажимы в относительно интактных участках сонных артерий, не проводить обильное пробное кровопускание перед окончательным закрытием артериотомического отверстия, не использовать интраоперационную эмболизацию без нейтрализации протамином по завершении реконструкции, не назначать дооперационно аспирин и не допускать технических дефектов, препятствующих кровотоку в сонных артериях. Выявление потенциальных источников эмболии во время операции требует визуального осмотра всей зоны эндартеркэтомии, проведения интраоперационной завершающей ангиографии или УЗИ.
Микроэмболизацию не всегда возможно выявить при пробуждении больного после эндартерэктомии с неврологическим дефицитом, но ее можно предполагать. При интраоперационной транскраниальной допплерографии удается определять церебральные эмболы до количества частиц в минуту, но их клиническое значение не всегда очевидно [144–146]. При ЭЭГ в условиях общего обезболивания не всегда определяется ишемия мозга за счет мелких эмболов. У бодрствующего пациента возможно дифференцировать эмболическую ишемию от ишемии пережатия. При удалении зажима и восстановлении кровотока после появления неврологического дефицита последний быстро исчезает при ишемии пережатия, тогда как при эмболической ишемии дефицит присутствует длительнее или остается постоянным.
«Немая эмболизация» может выявляться при офтальмоскопии, и следует сказать, что данный феномен встречается не так редко после каротидной эндартерэктомии.
Причиной церебральной эмболизации может послужить рутинное или селективное применение временных внутренних шунтов у больных с ишемическими симптомами во время пережа-
тия сонных артерий. Стандартная техника подразумевает первичное введение шунта во внутреннюю сонную артерию для ретроградного удаления воздуха с последующим введением в общую сонную. В такой последовательности невозможно вымыть детрит, иногда присутствующий в общей сонной артерии, что приводит к мозговой эмболии. Ранее описанная техника меняет порядок введения шунта, что преследует две цели: снижение вероятности эмболизации и значительное уменьшение времени ишемии, необходимого для установки шунта.
Тромбоз оперированной артерии
Тромбоз в реконструированной зоне может протекать бессимптомно, может сопровождаться только транзиторным неврологическим дефицитом, а может вызвать тяжелый инсульт или смерть. Ни характер возникновения симптомов, которые могут присутствовать уже при пробуждении после наркоза, ни сроки их возникновения не указывают на развитие тромбоза оперированной артерии. Механизм тромбоза обычно обусловливается техническими погрешностями, такими как неполное удаление бляшки, наличие интимального лоскута во внутренней сонной артерии в виде «уступа» в дистальной зоне окончания эндартерэктомии, некоррегированные изгибы внутренней сонной артерии, становящиеся значимыми после эндартерэктомии, стеноз при первичном шве, прогиб задней стенки при использовании слишком короткой заплаты в сравнении с длиной артериотомии. Сюда же можно отнести образование сгустков в изолированном эндартерэктомированном сегменте во время закрытия артериотомии из-за неадекватной гепаринизации, недостаточного пробного кровопускания или недостаточного промывания участка эндартерэктомии до полного закрытия артериотомического отверстия. Так называемый «белый тромб» состоит преимущественно из агрегатов тромбоцитов, образующихся парадоксальной индукцией гепарином [143], хотя и предотвращается дооперационным назначением аспирина. Формированию такого тромба способствует оставление множественных частично приподнятых циркулярных пучков и полосок гладких мышц медии в зоне эндартерэктомии.
Показанием к повторной операции, во время которой возможна коррекция причин тромбоза, обычно служит раннее возникновение неврологического дефицита. Задержка свыше 1–2 ч может привести к развитию стойкого неврологического повреждения. Нераспознанная хроническая асимптомная окклюзия чревата возникновением инсульта в отдаленном периоде.
Предупреждение тромбоза оперированной артерии требует особого внимание к деталям техники, обеспечивающим образование гладкой поверхности после эндартерэктомии и коррекции кинкингов [147]. При использовании непродолжительного разреза артерии, не позволяющего осмотреть полностью эндартерэктомированный сегмент и прилегающие участки интимы в общей и внутренней сонной артериях (или если внутренний шунт ограничивает такую ревизию), следует выполнять завершающую ангиографию или УЗИ с целью немедленной коррекции возможных технических погрешностей.
Гиперперфузия: отек мозга или кровоизлияние
При реваскуляризации во время каротидной эндартерэктомии относительно ишемизированной области мозга дистальнее выраженного стеноза сонных артерий возникает преходящая гипере-
https://t.me/medicina_free

136 Раздел VIII. Цереброваскулярная недостаточность
мия, скорее всего из-за потери внутренней сосудистой регуляции. Она может продолжаться 24–72 ч и проявляться множеством симптомов: от умеренной или выраженной головной боли, периодических латерализующих эпилептиформных припадков до отека мозга или комы, а в наиболее тяжелых случаях — смерти от внутримозгового кровоизлияния [118, 148, 149]. Последние могут возникать в любое время от первых до 10 послеоперационных суток (в среднем 3,3 дня) и всегда у больных, оперированных по поводу полной окклюзии либо критического стеноза внутренней сонной артерии. Гипертензия, систолическое давление выше 200 мм рт. ст. выявляются только в половине случаев. Явные признаки церебрального инфаркта, долгое время считавшиеся предпосылкой для столь тяжелого проявления гиперперфузии, встречаются в единичных случаях. Летальность колеблется от 36 до 60%. В одной из работ указывается, что краниотомия с эвакуацией внутримозговой гематомы может повысить выживаемость, но необязательно улучшить неврологическое восстановление [118]. При менее выраженных формах гиперперфузии для контроля за ситуацией используются антиконвульсанты и антигипертензивные препараты. Частота церебральных кровоизлияний у разных авторов колеблется значительно по неизвестным причинам. Общераспространенными рекомендациями по предупреждению послеоперационных гипертензивных кризов являются сохранение каротидных барорецепторов, разумное применение вазоактивных препаратов с целью не допустить подъемов АД свыше 160–175 мм рт. ст. и не оперировать больных с крупными (более 1 см) церебральными инфарктами в сроки до 4–5 недель от появления симптоматики.
В недавней работе Dalman с соавторами [146] предлагают использовать транскраниальное допплеровское мониторирование для выявления больных с риском развития послеоперационной гиперперфузии по значимому возрастанию скорости в средней мозговой артерии. При выявлении таких пациентов в указанном исследовании проводился прямой мониторинг АД и его контроль. Хотя прогрессирование невыраженного гиперперфузионного синдрома может быть предупреждено, неизвестно, способны ли такие мероприятия исключить развитие внутримозгового кровоизлияния.
Инфаркт миокарда
Сочетанная частота поражения коронарных и сонных артерий при атеросклерозе предполагает возможность развития острого инфаркта миокарда при выполнении каротидной эндартерэктомии [150, 151]. В зависимости от клинических проявлений тяжести коронарного поражения клиницистами приняты разные тактические подходы: от исключения вазопрессоров для искусственного подъема АД выше уровня, к которому компенсирован отдельный больной, до неприменения вазолитиков для снижения АД при компенсаторном повышении во время пережатия сонных артерий на 10–20 мм рт. ст. с целью поддержания церебральной перфузии. Некоторые хирурги предпочитают местную анестезию из-за меньшего ее воздействия на кардиогемодинамику, сообщая о более редких кардиальных осложнениях в сравнении с общим обезболиванием [111].
Повреждение черепномозговых нервов
Повреждение черепномозговых нервов [152] может протекать незаметно, а может проявляться достаточно ярко, например как при значительной девиации языка (XII пара), выраженной хрипоте
из-за паралича голосовой связки (X пара), затруднения глотания вследствие пареза среднего глоточного констриктора (IX пара) или слюнотечения (VII пара). Указанные повреждения возникают очень редко из-за пересечения перечисленных нервов, если только не присутствуют аномалии их хода. Чаще всего эти нервы травмируются при тракции, сдавлении или нагревании во время электрокоагуляции. Частота таких повреждений сильно зависит от способа их определения и вида нерва, изменяясь от 1,8% для верхнего гортанного до 15% для возвратного гортанного, в среднем составляя 7,9–15%. В большинстве случаев дисфункция носит преходящий характер, но существенно осложняет качество жизни при нарушениях глотания, голосообразования и слюнотечении.
Повреждение краевой (нижнечелюстной) ветви лицевого нерва возможно при использовании ретракторов для подъема нижней челюсти при мобилизации внутренней сонной артерии в случае высокого поражения и продлении разреза кзади от угла нижней челюсти до мочки уха. Подъязычный нерв, ограничивающий экспозицию дистальной порции внутренней сонной артерии, может быть смещен при перевязке a. и v. sternoclaidomastoideus, удерживающих первый в латеральной позиции [153]. Часто нисходящая ветвь подъязычного нерва препятствует его отведению кверху и может быть безопасно пересечена. Указанные два приема позволяют не только сместить нерв без удерживающего устройства, но и, если требуется повторная операция, избежать его попадания в послеоперационный рубец. В ряде случаев мелкие притоки лицевой вены пересекают каротидную бифуркацию спереди, соприкасаясь своей задней поверхностью с нижележащим подъязычным нервом. Указанные вены перед пересечением (для увеличения экспозиции) должны быть полностью выделены из окружающей клетчатки, чтобы не повредить нерв.
Парез возвратного нерва обычно возникает вследствие травмы основного ствола блуждающего [154], кроме случаев высокого отхождения возвратного нерва, когда он может быть пересечен. Основной ствол блуждающего нерва располагается кзади от сонной артерии и яремной вены и часто не виден во время операции, но следует помнить о его локализации для предупреждения повреждения при высоком выделении внутренней сонной артерии, наложении зажима на общую сонную, которая должна быть полностью скелетизирована перед пережатием, при разведении раны расширителем и во время коагуляции. Нередко при местной или проводниковой анестезии возможно развитие осиплости, сохраняющейся во время действия анестезии, с последующим восстановлением функции.
Верхний гортанный нерв проходит в косом направлении сверху вниз отходя от ствола блуждающего на уровне яремного отверстия позади внутренней и наружной сонной артерий, достигая m. сricothyroideus и верхнего констриктора глотки. Указанный нерв повреждается при наложении зажима на внутреннюю сонную артерию, обходе наружной сонной и верхней щитовидной артерий. Проявляется тем, что голос быстро слабеет к концу фразы или даже слова, становится трудно кричать.
Языкоглоточный нерв может травмироваться при высоком доступе к внутренней сонной артерии, требующем пересечения двубрюшной мышцы. Близость нерва и мышцы требует полного отделения мышцы от окружающих тканей перед пересечением, исключает пользование коагулятором и вызывает настороженность в отношении прилежания нерва, который часто может быть визуализирован при высоком доступе [155].
Повреждение большого ушного нерва из-за ретракции верхнего угла раны сопровождается болезненной парестезией мочки
https://t.me/medicina_free
Глава 66. Каротидная эндартерэктомия: показания и техника каротидных реконструкций |
137 |
|
|
уха и предупреждается умеренным, неизбыточным растяжением краев раны в верхнем углу.
Поздние рестенозы и окклюзии
Рестенозы в отдаленном периоде в зоне эндартерэктомии встречаются с частотой 3–25% и произвольно подразделяются на миоинтимальную гиперплазию, обычно выявляемую в интервале от 6 месяцев до 2–3 лет после операции, и рецидив атеросклероза, встречающийся позднее приведенных сроков [156, 157]. Третья категория, описанная Barnes с соавторами [158], классифицируется как резидуальная бляшка и представляет собой не полностью удаленную бляшку во время первичной операции, выявляемую в ближайшем послеоперационном периоде. Сравнение бляшек, удаленных во время первого вмешательства, с рецидивными, забранными спустя месяцы и годы, показывает, что спектр патологических изменений, наблюдаемый при первичных операциях, от чисто фиброзных бляшек до случаев внутрибляшечного кровоизлияния, инкапсулированного атероматозного детрита, изъязвления и тромбоза, полностью воспроизводится и в рецидивных бляшках.
Если выполняется достаточная экспозиция пораженных сосудов от проксимальной зоны каротидной бляшки в общей сонной артерии до дистальной во внутренней, что позволяет произвести соответствующую артериотомию и необходимую по глубине эндартерэктомию, то резидуальные бляшки не должны выявляться в принципе. Если оценка полноты удаления бляшки проблематична из-за применения шунта или по другим причинам, требуется ангиографический либо ультразвуковой контроль. Некоторые авторы пропагандируют такой контроль как рутинный для снижения частоты ближайших и отдаленных осложнений.
При развитии раннего рестеноза (от 6 месяцев до 2 лет), несмотря на полное первичное удаление бляшки, что выявляется по рецидиву симптомов или данным рутинного дуплексного сканирования, следует предполагать фиброзную миоинтимальную гиперплазию. Расположение этих ранних поражений варьирует по распределению и конфигурации. Они могут быть острой формы
вконечных точках первичного шва артериотомии, где возможно возникновение минимального стеноза в верхнем углу вследствие ускорения кровотока или, по аналогии с феноменом, отмечаемым
вэксперименте с венозными протезами, когда срез вены меньшего сечения для наложения анастомоза способствует развитию миоинтимальной гиперплазии [160]. Если для закрытия артериотомии применяется заплата, то подобные изменения могут появиться на границах сегмента после пластики при незначительном сведении заплаты на конус, когда она обрезается в достаточно широкой части. В месте пересечения интимы в общей сонной артерии может образоваться «ступенька», влияющая на возникновение извращенного кровотока. Это предупреждается прошиванием проксимальной интимы единичными швами насквозь через край интимы в направлении продольного хода артерии. С другой стороны, возможно и диффузное утолщение всего эндартерэктомированного сегмента как при не полностью удаленной медии с первичной бляшкой, так и вследствие пока неизвестных метаболических и гемодинамических факторов. Вероятно, что многообразие проявлений таких поражений связано с полиэтиологичностью, на что может указывать факт более частого возникновения рестенозов у курильщиков и женщин [159, 161].
Ранняя миоинтимальная бляшка может быть воспроизведена в экспериментальной лаборатории на множестве животных моделей от изменения артериальной конфигурации до создания специфических условий кровотока (ускорение потока крови, его
выраженное замедление, прекращение) [162, 163], миоинтимального повреждения баллонным катетером [164], повреждения эндотелия за счет высушивания интимы воздухом [165]. Экспериментальные поражения можно предупредить устранением геометрической конфигурации, приводящей к специфическим нарушениям кровотока. Множество фармакологических агентов, внешне между собою не связанных, от гепарина [166, 167] до эйкосопентоевой кислоты [168], дезагрегантов [169], кортикостероидов [170], иммуносупрессоров (таких как циклоспорин) [171], хотя и не предупреждают формирование экспериментальных поражений, считаются, по меньшей мере, частично угнетающими их развитие, что не очевидно при операциях у людей.
В человеческой модели превентивный эффект закрытия артериотомии заплатой заключается в изменении конфигурации каротидной бифуркации. Таким образом происходит смена условий для потока крови, существовавших при росте первичной атеросклеротической бляшки [172, 173]. Для снижения высокой частоты рестенозов у женщин было предложено в качестве повторной операции аутовенозное протезирование вместо повторной эндартерэктомии или пластики заплатой, если последняя не применялась во время первичного вмешательства. Желательны прекращение курения и прием дезагрегантов, хотя их профилактическое значение окончательно не доказано. Назначение витамина Е, длительная гепаринизация или введение неантикоагулянтной фракции гепарина и поныне не обоснованы. Даже с учетом того, что ранние поражения, особенно гомогенной фиброзной структуры, могут подвергаться обратному развитию по данным периодического дуплексного сканирования, в случае симптомного течения или при выраженных стенозах, вне зависимости от возраста требуется реинтервенция.
Если во время первичной операции вшивание заплаты значительно увеличивает просвет сосуда, то возможно формирование желатинового тромбоцитарного-фибринового тромба из-за замедления кровотока, аналогичного спонтанным отложениям в аневризмах. Такой тромб может послужить источником возвратных мозговых эмболов или же продолжить рост до образования стеноза. В таких ситуациях почти всегда обязательна повторная операция, причем достаточным может оказаться ушивание заплаты до приемлемого размера сосуда.
Каротидная эндартерэктомия у бодрствующего больного
Для проведения каротидной эндартерэктомии у пациента, находящегося в сознании, используется следующая техника [174, 176, 178, 179]. Премедикация проводится в минимальном объеме, недостаточном для седации больного и вызывания у него неспособности быстро реагировать на словесные команды. Пациент располагается на операционном столе в положении на спине, с головой, повернутой в сторону, противоположную операции,
инебольшим валиком под плечами. Сжимаемая звуковая игрушка фиксируется в ладони руки, противоположной стороне операции. Проводниковая шейная анестезия проводится с использованием техники «три иглы» с введением 0,5% маркаина в объеме 10 мл. Выполняется хирургическая обработка кожи шеи и паха,
иобкладывается операционное поле. Инфильтрируется пах, ипсилатеральный оперируемой сонной артерии, для забора большой подкожной вены при использовании венозной заплаты (рис. 66.1–66.4). Вены голени для этой цели непригодны из-за риска разрыва.
https://t.me/medicina_free

138 Раздел VIII. Цереброваскулярная недостаточность
Нижняя челюсть
Двубрюшная мышца
Грудино-ключично- сосцевидная мышца
Общая сонная артерия
Внутренняя яремная вена
Лопаточно-подъязычная мышца
Ключица
Большая грудная мышца
1-е ребро
Рукоятка грудины
2-е ребро
Каротидная
бляшка
Рис. 66.1. Анатомические ориентиры, используемые во время операции каротидной эндартерэктомии. Пунктирной линией отмечены расположение и протяженность разреза для максимальной экспозиции.
A |
|
Б |
|
|
|
В |
|
Г |
|
Д |
|
|
|
|
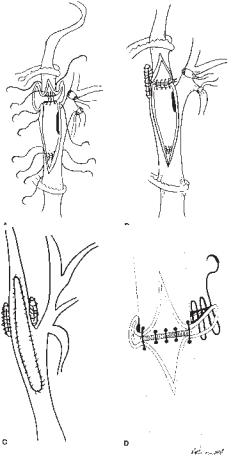
|
Рис. 66.2. Эндартерэктомия. (А) Внутренняя сонная артерия пережата до завершения выделения бульбуса для профилактики эмболии мозга. (Б) Артериальные зажимы наложены по отношению в бляшке каротидной бифуркации так, чтобы не допустить ее раздавливания, таким образом исключая другой источник интраоперационной эмболизации. (В) После полного удаления бляшки фиксирующие швы ликвидируют проксимальный и дистальный уступы на каждом крае зоны эндартерэктомии. (Г) При вшивании венозной заплаты используется 12 Fr катетер как стент при закрытии протяженной артериотомии. Такой же стент применяется при первичном шве. (Д) Венозная пластика закончена.
https://t.me/medicina_free
Глава 66. Каротидная эндартерэктомия: показания и техника каротидных реконструкций |
139 |
|
|
|
А |
|
Б |
|
|
||
|
A |
|
B |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ВC |
|
DГ |
|
|
|
Рис. 66.3. Пликация. (А) При избыточной длине или изгибе внутренней сонной артерии производится пликация. Если присутствует проксимальное утолщение интимы в общей сонной артерии, то оно фиксируется. (Б) Пликационные швы завязываются снаружи артерии, как показано. (В) Особенности ушивания «собачьих ушек», образовавшихся при пликации. (Г) Пликация завершена с образованием наружных «собачьих ушек» и вшиванием венозной заплаты.
Разрез кожи на шее выполняется по переднему краю груди- но-ключично-сосцевидной мышцы от нижнего края щитовидного хряща до угла нижней челюсти с загибом верхней части разреза кзади, чтобы не контактировать с большим ушным нервом. Подкожная мышца шеи и подлежащий слой глубокой фасции шеи пересекаются в проекции кожного разреза, обнажается передняя лицевая вена, перевязывается и пересекается после отделения от возможно прилежащего подъязычного нерва. Выделяются общая и внутренняя сонные артерии, идентифицируется подъязычный нерв. Перевязываются и пересекаются грудино-ключично-сосце- видные артерия и вена, пересекается нисходящая порция подъязычного нерва для отведения последнего от внутренней сонной артерии, после чего последняя выделяется от уровня окончания бляшки и берется на держалку. Анестезиолог вводит внутривенно 3000 единиц гепарина.
В нижнем углу раны определяется переднее брюшко m. omohyoideus как указатель уровня общей сонной артерии располагающегося ниже бляшки каротидного бульбуса.
Производится пробное пережатие внутренней сонной артерии в участке сразу ниже подъязычного нерва, обычно на уровне
значительно выше дистальной порции бляшки. Пациента просят посчитать и посжимать «пищалку» в течение не менее 3 мин.
В это время выполняется забор большой подкожной вены в паху. От уровня пупартовой связки (линия между передней верхней подвздошной остью и углом лонного сочленения) сразу как исчезает пульсация бедренной артерии производится косой медиальный разрез на протяжении 10 см. Разделяется подкожная клетчатка и выделяется большая подкожная вена, которая резецируется от сафенофеморального соустья на участке 7,5 см. Далее удаленный сегмент орошается раствором гепарина без гидравлической препаровки и укладывается в емкость с гепаринизированным раствором.
Если больной толерирует пробное пережатие, то завершается выделение общей и наружной сонных и верхней щитовидной артерий с оставлением зажима на внутренней сонной. Затем пережимаются наружная сонная и верхняя щитовидная артерии и, в последнюю очередь, общая сонная значительно ниже бляшки, ориентируясь на нижний край переднего брюшка m. omohyoideus. По передней стенке сосудов выполняется протяженный разрез от уровня ниже бляшки в общей сонной до нормальной интимы во внутренней. Если выявляется выраженная извитость или удлинение сосуда или же на это указывает дооперационная ангиография, то артериотомия продляется дистальнее указанных изменений.
Производится отслоение через медию лопаткой Freer, бляшка освобождается в открытом поле зрения в общей и внутренней сонных артериях и путем эверсии из наружной сонной и верхней щитовидной. Ее удаление единым блоком осуществляется путем пересечения острым путем на уровне обычно несколько утолщенной интимы в общей сонной и сведением «на нет» во внутренней сонной, что обычно приводит к обрыву на уровне нормальной, плотно прикрепленной интимы. Циркулярные пучки медии удаляются с поверхности эндартерэктомированного сегмента, пока не образуется гладкая поверхность. Орошение помогает найти «забытые» обрывки, требующие удаления, и выявить нефиксированную интиму в дистальном отделе, которая, если не удаляется до уровня плотного прикрепления, должна быть фиксирована отдельными швами. Пересеченная в общей сонной артерии интима часто бывает утолщенной и жемчужнобелого цвета. Требуется ее фиксация отдельными швами для ликвидации уступа в случае его образования. При удлинении внутренней сонной артерии производится ее пликация продольными швами. В просвет внутренней сонной артерии вводится 10 Fr катетер как стент при вшивании подкожной вены, предварительно рассеченной продольно [175–177]. Когда остается четверть дюйма (чуть больше 6 мм) до завершения шва, катетер удаляется и выполняется промывание из наружной и внутренней сонных артерий ретроградным кровотоком с повторным наложением зажимов и обильным отмыванием зоны эндартерэктомии гепаринизированным солевым раствором до чистого через недошитое отверстие. По завершении шва вводится тупая игла для инъекции гепаринизированного раствора в эндартерэктомированный сегмент и рутинного пробного пуска кровотока. Снимается зажим с внутренней сонной артерии и вновь накладывается у бульбуса, восстанавливается кровоток по общей и наружной сонным артериям и через 1 мин удаляется зажим с внутренней сонной. Раны послойно зашиваются.
Если при пробном пережатии внутренней сонной артерии больной оказывается нетолерантным, зажим снимается. Проводится контроль АД для исключения гипотензии. При наличии последней АД поднимается не выше базального уровня со страхов-
https://t.me/medicina_free
140 Раздел VIII. Цереброваскулярная недостаточность
А |
|
Б |
|
В |
|
|
|
|
|
Г |
|
Д |
|
Е |
|
Ж |
|
|
|
|
|
|
|
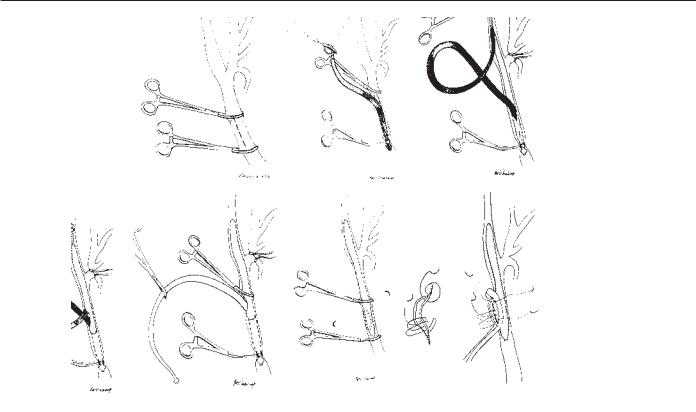
Рис. 66.4. Шунт. (А) Общая сонная артерия изолируется между сосудистыми зажимами на уровне m. omohyoideus и выоплняется артериотомия для введения проксимального отдела шунта. До наложения зажимов на общую сонную артерию временно пережимается внутренняя для предупреждения церебральной эмболизации. (Б) Проксимальный конец шунта установлен в общей сонной артерии и промыт, наружная и внутренняя сонные артерии на данном этапе остаются непережатыми. (В) Дистальная порция шунта введена во внутреннюю сонную артерию и восстановлен кровоток в мозг. (Г) При вшивании венозной заплаты обе бранши шунта проходят через одно отверстие. (Д) Внутренняя и наружная сонные артерии оставляются непережатыми после удаления шунта и пробного пуска кровотока. Вшивание заплаты может быть завершено без спешки, если пациент толерирует пережатие общей сонной артерии. (Е) Незатянутые стежки уменьшают ишемию пережатия у тех больных, которые не толерируют, и пережатие общей сонной артерии. (Ж) Техника бокового отжатия. Прошивание заплаты незатягивающимися стежками для удаления шунта уменьшает время ишемии пережатия.
кой нитропруссидом и проба повторяется. Если пациент продол- |
По завершении эндартерэктомии и вшивании заплаты приме- |
жает не толерировать, то зажим вновь удаляется и после перио- |
няются три методики удаления шунта, не превышающие период |
да восстановления производится пробное пережатие общей сон- |
от 1 до 2 мин ишемии пережатия. |
ной артерии. Зажим на последнюю накладывается только после |
Более предпочтительной является техника, когда венозная за- |
временного пережатия внутренней сонной для предупреждения |
плата полностью пришивается, за исключением участка, где вы- |
мозговой эмболии. При появлении толерантности зажим снима- |
ходят в виде «петли» обе бранши шунта. Остающееся отверстие |
ется, вводится дополнительно 2000 единиц гепарина, разрез кожи |
прошивается, но стежки не затягиваются. Пережимаются три со- |
продлевается вниз и общая сонная артерия выделяется до уровня |
суда и шунт, последний извлекается. Проводятся пробное кро- |
на 3 см ниже m. omohyoideus. Указанный 3-см сегмент общей сон- |
вопускание и промывание раствором, как описано выше, после че- |
ной артерии изолируется между двумя зажимами после времен- |
го свободные стежки затягиваются и кровоток восстанавливается |
ного пережатия внутренней (рис. 66.4). Выполняется артериото- |
стандартным образом. |
мия между двумя зажимами на общей сонной артерии, нижний |
Вторая методика обратна технике введения шунта, когда вши- |
конец пережатого шунта Javid вводится в общую сонную артерию |
вание венозной заплаты оканчивается значительно ниже каро- |
и фиксируется зажимом Javid. Шунт промывается кровью из об- |
тидной бифуркации, шунт пережимается и удаляется, общая сон- |
щей сонной артерии и в случае свободного кровотока без видимо- |
ная артерия пережимается ниже бифуркации, а внутренняя и |
го поступления желтых хлопьев пережимается дистально. Пере- |
наружная остаются непережатыми. Далее между двумя зажима- |
жимаются наружная и внутренняя сонные и верхняя щитовидная |
ми на общей сонной артерии дошивается заплата, после чего вос- |
артерии, снимается верхний зажим общей сонной артерии и арте- |
станавливается кровоток по указанному сосуду к дистальным |
риотомия продлевается дистально до неизмененного просвета вну- |
артериям. |
тренней сонной. Промытый, заполненный кровью и свободный от |
Третья методика заключается во вшивании венозной заплаты |
воздуха дистальный конец шунта вводится во внутреннюю сон- |
вокруг шунта, как описывалось выше. После его удаления зажи- |
ную артерию и кровоток восстанавливается. |
мом Сатинского отжимается пристеночно незашитый сегмент ар- |
https://t.me/medicina_free
Глава 66. Каротидная эндартерэктомия: показания и техника каротидных реконструкций |
141 |
|
|
териотомии, после дошивания которого восстанавливается кровоток в дистальные сосуды.
Опыт хирурга
Важнейшим фактором, влияющим на результаты каротидной эндартерэктомии, является опыт хирурга. Первое рандомизированное клиническое исследование по каротидной эндартерэктомии [27] не смогло ответить на ряд принципиальных вопросов по отбору больных на операцию из-за высокой частоты операционных осложнений, которые колебались от 2% до 20% среди различных участников, в среднем составив 11%. В более поздних статистиках большинство опытных хирургов сообщали о частоте таких осложнений 1–3% [33, 34, 47, 73, 85, 98] в группах больных как с высоким, так и низким риском. Тем не менее в ряде клиник, занимающихся этой проблемой, отмечалась намного большая частота осложнений, что по-прежнему продолжало вызывать сомнения в допустимости каротидных реконструкций. Кроме того, сохранялся скептицизм по поводу способов регистрации результатов у успешных коллективов хирургов. Рандомизированные клинические исследования недавнего прошлого проводились группами хирургов, удовлетворявших обоим требованиям к их опыту [3, 31, 32]: количеству выполненных операций и экспертному анализу, основанному на расчете уровней осложнений, которые, будучи даже выше, чем у многих опытных хирургов, тем не менее не вызывали необходимости постоянного отслеживания способа их подсчета. Вмешательства у асимптомных, неврологически интактных больных могут выполняться с частотой 1–3% сочетанного уровня летальность/частота осложнений, тогда как у симптомных, неврологически интактных пациентов с двусторонними операциями — с частотой 1–5%. На самом деле, при правильном мониторинге и селективном шунтировании отобранные больные с контрлатеральной окклюзией (то есть группа высокого риска) могут оперироваться с частотой осложнений 1–3% [47, 72, 73]. Операции у пациентов более высокого риска, с прогрессивным ухудшением, неврологически нестабильных или с острым инсультом должны, вероятно, производиться только теми, кто достиг соответствующих стандартов оперирования больных с меньшим риском, кто готов действовать согласно установленным протоколам, направленным на достижение точной классификации пациентов с исследованием патологических изменений мозга и артерий, на приверженность стандартизированной хирургической технике, а также теми, кто способен выявлять причину всех пери- и послеоперационных осложнений и механизмы отслеживания осложнений как минимум в 80% случаев.
Литература
1.Eastcott HHG, Pickering GW, Rob CG. Reconstruction of internal carotid artery in a patient with intermittent attacks of hemiplegia. Lancet 1954; 13: 994–996.
2.Blaisdell FW, Clauss RH, et al. Joint study of extracranial arterial occlusions: a review of surgical considerations. JAMA 1969; 209: 1889.
3.North American Symptomatic Carotid Endarterectomy Trial Collaborators. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis. N Engl J Med 1991; 325: 445–453.
4.European Carotid Surgery Trialists’ Collaborative Group. MCR European Carotid Surgery Trial: interim results for patients with
severe (70% to 99%) or with mild (0 % to 29 %) carotid stenosis. Lancet 1991; 337: 1235–1243.
5.Mayberg MR, Wilson SE, et al. Carotid endarterectomy and prevention of cerebral ischemia in symptomatic carotid stenosis. JAMA 1985; 266: 3289–3294.
6.American-Canadian Co-Operative Study Group. Persantine aspirin trial in cerebral ischemia: Part II. Endpoint results. Stroke 1985; 16: 406–415.
7.The SALT Collaborative Group. Swedish Aspirin LowDose Trial (SALT) of 75 mg aspirin as secondary prophylaxis after cerebrovascular ischaemic events. Lancet 1991; 338: 1345–1349.
8.The Dutch TIA Trial Study Group. A comparison of two doses of aspirin (30 mg vs 283 mg) a day in patients after a transient ischemic attack or minor ischemic stroke. N Engl J Med 1991; 325: 1261–1266.
9.Brandier JF, Licht PB, Roder O, et al. Endovascular treatment of severe symptomatic stenosis of the internal carotid artery: early and late outcome. Eur J Vasc Endovasc Surg 2001; 22: 205–210.
10.Al-Murak N, Colombo A, Gaines PA, et al. Multicenter evaluation of carotid artery stenting with filter protection. J Amer Coll Cardiol 2002; 39: 841–846.
11.Imparato AM. The carotid bifurcation plaque. A model for the study of atherosclerosis. J Vasc Surg 1986; 3: 249–255.
12.Imparato AM, Riles TS, Gorstein F. The carotid bifurcation plaque: pathologic findings associated with cerebral ischemia. Stroke 1979; 10: 238.
13.Yuan C, Zhang SX, Polissar NL, et al. Identification of fibrous cap rupture with magnetic resonance imaging is highly associated with recent transient ischemic attacks or stroke. Circulation 2002; 105: 181–185.
14.Fisher CM, Ojemann RG. A clinico-pathologic study of carotid endarterectomy plaques. Rev Neurol (Paris) 1986; 142: 573–589.
15.O’Donnell TF Jr, Erdoes L, et al. Correlation of B-mode ultrasound imaging and arteriography with pathologic findings at carotid endarterectomy. Arch Surg 1985; 120: 443–449.
16.Sterpetti AV, Schulz RD, et al. Ultra-sonographic features of carotid plaque and the risk of subsequent neurologic deficits. Surgery 1988; 104: 652–660.
17.Gomez CR. Carotid plaque morphology and risk for stroke. Curr Concepts Cardiovasc Dis Stroke 1989; 24: 25–29.
18.Imparato AM, Riles TS, et al. The importance of hemorrhage in the relationship between gross morphologic characteristics and cerebral symptoms in 376 carotid artery plaques. Ann Surg 1983; 197: 195–203.
19.Lusby RJ, Ferrell LD, et al. Carotid plaque hemorrhage. Its role in the production of cerebral ischemia. Arch Surg 1982; 117: 1479–1488.
20.Ammar AD, Ernst RL, et al. The influence of repeated carotid plaque hemorrhages on the production of cerebrovascular symptoms. J Vasc Surg 1986; 3: 857–859.
21.Pessin MS, Hinton RC, et al. Mechanisms of acute strokes. Ann Neurol 1979; 6: 245–252.
22.Avril G, Batt M, et al. Carotid endarterectomy plaques: correlation of clinical and anatomic findings. Ann Vase Surg 1991; 5: 50–54.
23.Torvik A, Svindland A, Lindboe CF. Pathogenesis of carotid thrombosis. Stroke 1989; 20: 1477–1483.
24.Ogata J, Masuda J, et al. Rupture of thrombotic occlusion of stenotic internal carotid artery. Stroke 1990; 21: 1740–1745.
25.Norris JW, Bornstein NM. Progression and regression of carotid stenosis. Stroke 1986; 17: 755–757.
https://t.me/medicina_free

142 Раздел VIII. Цереброваскулярная недостаточность
26.Alexandrov AV, Bladin CF, et al. Measuring carotid stenosis. Time for reappraisal. Stroke 1993; 24: 1292–1296.
27.Fields WS, Maslenikov V, et al. Joint study of extra cranial arterial occlusion: V. Progress report of prognosis following surgery or nonsurgical treatment for transient cerebral ischemic attacks and cervical carotid artery lesions. JAMA 1970; 211: 1993–2003.
28.Breslau PJ, ed. Hemodynamics of arterial stenosis. In: Ultrasonic duplex scanning in the evaluation of carotid artery disease. Voerendal, Holland: Herleen, 1981.
29.May AG, Van den Berg L, et al. Critical arterial stenosis. Surgery 1963; 54: 250–259.
30.Roederer GO, Langlois YE, et al. The natural history of carotid arterial disease in symptomatic patients with cervical bruits. Stroke 1984; 15: 605–613.
31.Hobson RW II, Weiss DG, et al. The Veterans Affair Cooperative Study Group. Efficacy of carotid endarterectomy for symptomatic carotid stenosis. N Engl J Med 1993; 328: 221–227.
32.Executive Committee for the Asymptomatic Carotid Atherosclerosis Study. Endarterectomy for asymptomatic carotid artery stenosis. JAMA 1995; 273: 1421–1428.
33.Thompson JE, Patman RD, Talkington CM. Asymptomatic carotid bruit: long-term outcome of patients having endarterectomy compared with non operative controls. Ann Surg 1978; 188: 308–316.
34.Hertzer NR, Flanagan RA Jr, et al. Surgical versus nonoperative treatment of symptomatic carotid stenosis, 211 patients documented by intravenous angiography. Ann Surg 1986; 204: 154–162.
35.Hertzer NR, Flanagan RA Jr, et al. Surgical versus nonoperative treatment of asymptomatic carotid stenosis, 290 patients documented by intravenous angiography. Ann Surg 1986; 204: 163–171.
36.Moore WS, Boren C, et al. Natural history of nonstenotic asymptomatic ulcerative lesions of the carotid artery. Arch Surg 1978; 113: 1352.
37.Svindland A, Torvik A. Atherosclerotic carotid disease in asymptomatic individuals. A histologic study of 53 cases. Acta Neurol Scand 1988; 78: 506–517.
38.Imparato AM. Carotid endarterectomy to prevent stroke III based on pathologic findings at the carotid bifurcation. In: Veith FJ, ed. Current critical problems in vascular surgery. St Louis: Quality Medical Publishing, 1989; 548–552.
39.Riles TS, Imparato AM, et al. Comparison of results of bilateral and unilateral carotid endarterectomy five years after surgery. Surgery 1982; 91: 258–262.
40.Bernstein EF, Humber PB, et al. Life expectancy and late stroke following carotid endarterectomy. Ann Surg 1983; 198: 80–84.
41.Schroeder T, Sillesen H, Engell HC. Staged bilateral carotid endarterectomy. J Vase Surg 3; 355.
42.Dimikakos PB, Kotsis TF, Tsiligiris B, et al. Comparative results of staged and simultaneous bilateral carotid endarterectomy: a clinical study and treatment. Cardiovasc Surg 2000; 8: 10–17.
43.Sobel M, Imparato AM, et al. Contralateral neurologic symptoms after carotid surgery: a nine year follow-up. J Vasc Surg 3; 623.
44.Levin SM, Soldheimer FK. Stenosis of the contralateral carotid artery-to operate or not? Vasc Surg 1973; 7: 3.
45.Imparato AM. The «major» and «minor» carotid artery in arterial reconstruction. Stroke 1974; 9: 15–21.
46.Baker WH, Littooy FN, et al. Carotid endarterectomy without a shunt: the control series. J Vase Surg 1984; 1: 50–56.
47.Imparato AM, Ramirez AA, et al. Cerebral protection in carotid surgery. Arch Surg 1982; 117: 1073–1078.
48.Riles TS, Imparato AM, Kopelman I. Carotid artery stenosis with contralateral occlusion with long-term results in fifty-four patients. Surgery 1980; 87: 363–368.
49.Patterson RH. Risk of carotid surgery with occlusion of the contralateral carotid artery. Arch Neurol 1974; 30: 188–189.
50.Riles TS, Imparato AM, et al. The totally occluded internal carotid artery: preliminary observations using rapid sequential computerized tomographic scanning. Arch Surg 1982; 117: 1185–1188.
51.Riles TS, Imparato AM, et al. Common carotid occlusion: preoperative assessment of the distal vessels. Ann Surg 1984; 199: 363–366.
52.Yamauchi H, Fukuyama H, et al. Hemodynamics in internal carotid artery occlusion examined by positron emission tomography. Stroke 1990; 2: 1400–1406.
53.Martin RS, Edwards WH, et al. Common carotid occlusion: surgical treatment and imaging of distal vessels. J Vase Surg 1992;
15:244.
54.Matos MA, van Bemmelen PS, et al. The influence of carotid siphon stenosis on shortand long-term outcome after carotid endarterectomy: fact or fiction? J Vasc Surg 1992; 16: 475–476.
55.Ley-Pozo J, Ringelstein EB. Non-invasive detection of occlusive disease of the carotid siphon and middle cerebral artery. Ann Neurol 1990; 28: 640–647.
56.Laro RSA, Berry NA. Atherosclerotic ulceration of the brachiocephalic artery. Aust NZJ Surg 1974; 44: 370–374.
57.Nichols SC, Koutlas TC, Strandness DE]r. Clinical significance of retrograde flow in the vertebral artery. Ann Vasc Surg 1991;
5:331–336.
58.Fronek A. Comments on the diagnosis of subclavian (or innonimate) artery steal syndromes. J Vasc Surg 1992; 15: 938–940.
59.Grosvell WJHM, Lawson JA, et al. Clinical significance of innominate artery lesions evaluated by ultrasonography and digital angiography. Stroke 1988; 19: 958–961.
60.Brewster DC, Moncure AC, et al. Innominate artery lesions: problems encountered and lessons learned. J Vase Surg 1985; 2: 99–112.
61.Imparato AM, Riles TS. Surgery of vertebral and subclavian artery occlusions. In: Bergan JJ, Yao JST, eds. Cerebrovascular insufficiency. New York: Grune and Stratton, 1983.
62.Blaisdell FW, Clauss RH, et al. Joint Study of Extracranial Arterial Occlusion: a review of surgical considerations. JAMA 1969; 209: 1889.
63.Ouriel K, Ricotta JJ, et al. Carotid endarterectomy for non-hemi- spheric cerebral symptoms: patient selection with ocular pneumoplethysmography. J Vasc Surg 1986; 4: 116–118.
64.Imparato AM. Vertebral arterial reconstruction: a ninteen year experience. J Vasc Surg 1985; 2: 626.
65.O’Hara PJ, Hertzer NR, Beven EG. External carotid revascularization: review of a ten year experience. J Vasc Surg 1985; 2: 709–714.
66.Friedman SG, Lamparello PJ, et al. Revascularization of the external carotid artery. Arch Surg 1988; 123: 497.
67.Zarins CK, DelBeccaro EJ, et al. Increased cerebral blood flow after external carotid revascularization. Surgery 1981; 89: 730–734.
68. Countee RW, Viyayanathan T. Intracranial embolization via external carotid artery: report of a case with angiographic documentation. Stroke 1980; 11: 465–468.
https://t.me/medicina_free
Глава 66. Каротидная эндартерэктомия: показания и техника каротидных реконструкций |
143 |
|
|
69.Berguer R, Sieggren MY, et al. The silent brain infarct in carotid surgery. J Vasc Surg 1986; 3: 442.
70.Gregg MJ, Papadakis C, et al. The significance of CT scan infarcts and atrophy in patients with amaurosis fugax. J Vasc Surg 1988; 7: 215.
71.McKenzie RL, Awad IA. Reversal of a dense persistent, holohemispheric neurological deficit after an endarterectomy of the carotid artery: case report. Neurosurgery 1991; 29: 261–264.
72.Goldstone J, Moore WS. A new look at emergency carotid operations for the treatment of cerebrovascular insufficiency. Current concepts of cerebrovascular disease. Stroke 1978; 9: 599.
73.Whittemore AD, Mannick JA. Surgical treatment of carotid disease in patients with neurologic deficits. J Vasc Surg 1987; 5: 190.
74.Millikan CH. Discussion in cerebral diseases. In: McDowell FH, Brennan RW, eds. Transactions of the 8th Princeton Conference on Cerebral Vascular Disease. New York: Greene and Stratton, 1973; 209.
75.Rosenberg H. Handbook of carotid artery surgery. Boca Raton, Fla: CRC Press, 1989; 93.
76.Wilson SE, Mayberg MR, et al. Crescendo transient cerebral attacks: a surgical imperative. J Vasc Surg 1993; 17: 249.
77.Hertzer MR. Carotid endarterectomy and common sense [editorial]. Surg Gynecol Obster 1978; 147: 235.
78.Kempczinski RF, Brott TG, Labretta RJ. The influence of surgical specialty and caseload on the results of carotid endarterectomy. J Vasc Surg 1986; 3: 911.
79.Ernst CB. Update on manpower issues in vascular surgery. Who is performing vascular operations and who should be performing them. In: Veith F, ed. Current critical problems in vascular surgery. St Louis: Quality Medical Publishing, 1989; 3.
80.Imparato AM. Is there a need for prospective randomized clinical trials of carotid endarterectomy. In: Veith FJ, ed. Current critical problems in vascular surgery. St Louis: Quality Medical Publishing, 1989; 553.
81.Barnett HJ, Taylor DW, Eliasziw M, et al. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. N Engl J Med 1998; 339: 1415–1425.
82.Ingall TJ, Dodick DW, Zimmerman RS. Carotid endarterectomy. Which patients can benefit? Postgrad Med 2000; 107: 97–109.
83.Thompson JE. Complications of carotid endarterectomy and their prevention. World J Surg 1979; 3: 155–165.
84.Hertzer NR, Avellone JC, et al. The risk of vascular surgery in a metropolitan community. J Vasc Surg 1984; 1: 13–21.
85.Sundt TM Jr, Sharbrough FW, et al. The risk benefit ratio of intraoperative shunting during carotid endarterectomy. Relevancy to operative and postoperative results and complications. Ann Surg 1986; 203: 196–204.
86.Barnett HJM, Warlow CP. Carotid endarterectomy and the measurement of stenosis. Stroke 1993; 24: 1281–1284.
87.Langsfeld M, Lusby RJ. The spectrum of carotid artery disease in asymptomatic patients. J Cardiovasc Surg 1988; 29: 687–691.
88.Toole JF, Janeway R, et al. Transient ischemic attacks due to atherosclerosis. Arch Neurol 1975; 32: 5.
89.Goldner JC, Whisnant JP, Taylor WJ. Long-term prognosis of transient ischemic attacks. Stroke 1971; 2: 160.
90.Ziegler DK, Hassanein RS. Prognosis in patients with transient ischemic attacks. Stroke 1973; 4: 666.
91.Gorelick PB. Carotid endarterectomy. Where do we draw the line? Stroke 1999; 30: 1745–1750.
92.The Casanova Study Group. Carotid surgery versus medical therapy for asymptomatic atherosclerosis. Stroke 1991; 22: 1229–1235.
93.Kusey DS, Bowyer B, Iron K, et al. Determinants of outcome in carotid endarterectomy. J Vasc Surg 1998; 28: 1051–1058.
94.Norman PE, Semmens JB, Laurvick CL, et al. Long term relative survival of elderly patients after carotid endarterectomy. Stroke 2003; 34: 95–98.
95.Bardin J, Bernstein EF, et al. Is carotid endarterectomy beneficial in preventing recurrent stroke? Arch Surg 1982; 117: 1401.
96.McCuliough JL, Mentzer RM, et al. Carotid endarterectomy after completed stroke: reduction in long-term neurologic deterioration. J Vasc Surg 1985; 2: 7.
97.Rubin JR, Goldstone J, McIntyre KE Jr, et al. The value of carotid endarterectomy in reducing the morbidity and mortality of recurrent stroke. J Vasc Surg 1986; 4: 443–449.
98.Giordano JM, Trout HH, et al. Timing of carotid endarterectomy after stroke. J Vasc Surg 1985; 2: 250.
99.Ouriel K, May AG, et al. Carotid endarterectomy for nonhemi-
spheric symptoms: predictors of success. J Vasc Surg 1984; 1: 339.
100.Habozit B. Vertebral artery reconstruction: results in 106 patients. Ann Vasc Surg 1991; 5: 61–66.
101.O’Brien MD. Vascular dementia is underdiagnosed. Arch Neurol 1988; 45: 797–798.
102.Bamford JM, Warlow CP. Evolution and testing of the lacunar hypothesis. Stroke 1988; 19: 1074–1082.
103.Bamford JM. Carotid endarterectomy for lacunar ischemia. In: Cao P, Ricci S, eds. Update in carotid disease. Italy: Esam Futura, 1991; 23–28.
104.Fisher SS, Malenka DJ, et al. Risk of carotid endarterectomy in the elderly. Am J Publ Health 1989; 79: 1617–1620.
105.Pinkerton JA, Gholkar VR. Should patient age be a consideration in carotid endarterectomy? J Vase Surg 1990; 11: 650–658.
106.Riles TS, Kopelman I, Imparato AM. Myocardial infarction following carotid endarterectomy: a review of 683 operations. Surgery 1979; 85: 249–252.
107.Ennis CL, Lawrie GM, et al. Improved results in patients with symptomatic coronary disease: an analysis of 1,546 consecutive carotid operations. Stroke 1979; 10: 122.
108.Brener BJ, Brief DL, et al. The risk of stroke in patients with asymptomatic carotid disease undergoing cardiac surgery: a fol- low-up study. J Vase Surg 1987; 5: 269.
109.Ivey TD. Combined carotid and coronary disease-conservative strategy. J Vase Surg 1986; 3: 687–689.
110.Connolly JE. Carotid endarterectomy in the awake patient. Am J Surg 1985; 150: 159–165.
111.Gableman CG, Gann DS, et al. One hundred consecutive carotid reconstructions-local versus general. Am J Surg 1983; 145: 477–482.
112.Corson JD, Chang BB, et al. Influence of anesthetic choice on carotid endarterectomy outcome. Arch Surg 1987; 122: 807–812.
113a.Ricotta JJ, Char DJ, Cuadra SA, et al. Modeling stroke risk after coronary artery bypass and combined coronary artery bypass and carotid endarterectomy. Stroke 2003; 34: 1212–1217.
113б.Rockman CB, Su W, Lamparello P, et al. A reassessment of carotid endarterectomy in the face of contralateral carotid occlusion. J Vasc Surg 2002; 6: 668–673.
114.Gutierrez IZ, Barone DL, et al. The risk of perioperative stroke in patients with asymptomatic carotid bruits undergoing peripheral vascular surgery. Am Surg 1987; 5: 487.
115.Wong EHW. Peri operative stroke: Part I. General surgery, carotid artery disease, and carotid endarterectomy. Can J Anaesth 1991; 38: 347.
https://t.me/medicina_free
