
- •Список сокращений и условных обозначений
- •Биофармация как учебная дисциплина фармацевтических вузов
- •Введение в биофармацию
- •Начало биофармацевтических исследований
- •Биологическая доступность
- •Биоэквивалентность
- •Фармацевтические факторы
- •Химическая модификация фармацевтической субстанции
- •Физико-химические характеристики фармацевтических субстанций
- •Вспомогательные вещества
- •Путь введения
- •Фармацевтическая технология
- •Биофармацевтические тесты
- •Отбор проб и нормирование результатов теста «Растворение»
- •Основы фармацевтической разработки
- •Этапы фармацевтической разработки
- •Вариабельность вспомогательных веществ
- •Вспомогательные вещества при разработке твёрдых лекарственных форм
- •Современные направления биофармацевтических исследований
- •Заключение
- •Лабораторные работы
- •Тесты
- •Введение в биофармацию
- •Основные понятия фармакокинетики. Биодоступность
- •Фармацевтические факторы
- •Биофармацевтические тесты
- •Ответы на тесты
- •Примерные темы семинаров
- •Глоссарий
- •Условные обозначения фармакокинетических параметров
- •Список литературы

[человеческий
полусинтетический] (Биогулин
70/30, Хумодар K25). Инсулин
аспарт двухфазный (НовоМикс
30 Пенфилл, НовоМикс 30
ФлексПен).
Инсулин двухфазный
[человеческий генно-
инженерный] (Гансулин 30Р,
Генсулин М 30, Инсуман Комб
25 ГТ, Микстард 30 НМ,
Хумулин М3)
Инсулин ультракороткого действия, максимум которого наблюдают через 2 ч после введения,
получен перестановкой аминокислот лизина и пролина в положении 28-29.
Физико-химические характеристики фармацевтических субстанций
Растворимость. В настоящее время терапевтическую эффективность препаратов связывают с фармакокинетической кривой. Однако, прежде чем попасть в кровь, лекарственное вещество должно высвободиться из лекарственной формы, затем раствориться в биожидкости и абсорбироваться в кровеносное русло. Именно поэтому растворимость и абсорбцию считают в настоящее время важнейшими характеристиками лекарственных субстанций. Именно они заложены в основу биофармацевтической классификационной системы (БКС), предложенной FDA в 1995 г., согласно которой все субстанции делят на четыре класса. БКС приведена в табл. 2.
Таблица 2. Биофармацевтическая классификационная система фармацевтических субстанций
Класс
 Биофармацевтическая растворимость субстанции
Биофармацевтическая растворимость субстанции
 Проницаемость
Проницаемость
I |
|
Высокая |
|
Высокая |
|
|
|
|
|
|
|
|
|
|
II |
|
Низкая |
|
Высокая |
|
|
|
|
|
|
|
|
|
|
III |
|
Высокая |
|
Низкая |
|
|
|
|
|
IV |
|
Низкая |
|
Низкая |
Для понимания значения и применения БКС необходимо разобраться в её терминах и приведённых в ней оценках (низкая, высокая).
Следует различать понятия «растворимость вещества» и «биофармацевтическая растворимость», их сравнение приведено в табл. 3.
Проницаемость определяется степенью абсорбции фармацевтической субстанции. К
высокопроницаемым относят вещества, степень абсорбции (биодоступности) которых у человека,
определяемая методом материального баланса или в сравнении с введённой внутрисосудистой дозой,
равна 85% или более (в США – 90%). Метод материального баланса основан на сравнении количества
23

фармацевтической субстанции, поступившей в организм, с её количеством, выведенным из организма в виде неизменённого вещества или его метаболитов всеми путями выведения.
Таблица 3. Характеристика терминов «растворимость вещества» и «биофармацевтическая растворимость»
Растворимость как физико-химическая |
Биофармацевтическая растворимость |
|
характеристика вещества |
||
|
Это качественная и количественная способность образовывать раствор при смешивании с другим
веществом (растворителем). По растворимости
Определяется как растворимость дозы
при T = const различают:
лекарственного вещества в 250 мл водной среды
хорошо растворимые вещества (образуют
при рН 1,0-6,8. Высокой биофармацевтической
насыщенные растворы с концентрацией более
растворимостью обладают вещества, которые в
0,1 моль/л);
наибольшей дозировке растворяются в 250 мл или
малорастворимые вещества (образуют
менее водной среды при рН 1,0-6,8. Низкой
насыщенные растворы с концентрацией 0,1-
биофармацевтической растворимостью
0,001 моль/л);
обладают вещества, растворимость которых ниже
практически нерастворимые вещества
(образуют насыщенные растворы с концентрацией менее 0,001 моль/л)
БКС, предложенную FDA в конце ХХ в. в целях рекомендаций для промышленности по разработке теста «Растворение», позднее стали применять для прогнозирования биодоступности субстанции, обоснования процедуры биовейвера, а её технологическое значение заключается в обосновании дизайна и технологии лекарственных форм.
Измельчённость, или размеры частиц лекарственного вещества, имеет большое значение в технологии лекарственной формы, влияя на однородность дозирования, стабильность, растворимость,
скорость и величину абсорбции и в результате – на терапевтическую эффективность и наличие побочных эффектов. В настоящее время известно, что чем меньше частицы, тем больше их растворимость и удельная поверхность. Так, использование микронизированных порошков субстанций позволяет уменьшить дозу лекарственного вещества при сохранении терапевтической эффективности. Однако в то же время может способствовать проявлению побочных эффектов за счёт эффективного всасывания и увеличения пиковых концентраций в биожидкостях.
Время наступления эффекта может существенно сократиться при использовании микронизированных порошков, а количество всосавшегося вещества, наоборот, возрасти, в результате возрастает и биодоступность. Например, если для получения таблеток использован гризеофульвин с
24
частицами размером 5 мкм и менее, то такой препарат в 2-3 раза эффективней обычного, имеющего частицы размером около 100 мкм.
Проявление побочных эффектов при использовании порошков разных размеров может быть и не связано с пиковыми концентрациями. Например, ульцерогенное действие ацетилсалициловой кислоты в крупных частицах выше, чем в микронизированных.
В ряде случаев измельчение веществ приводит к снижению стабильности. Вследствие усиления процессов гидролиза, окисления, действия пищеварительных соков и интенсификации химических реакций, которые протекают при взаимодействии лекарственных субстанций с компонентами пищи,
микронизирование фармацевтических субстанций может привести к снижению их активности.
Влияние микронизации наглядно демонстрируют лекарственные формы глибенкламида – одного из самых популярных, изученных и надёжных сахароснижающих лекарственных средств.
Традиционные лекарственные формы глибенкламида вызывают медленное и постепенно нарастающее наступление сахароснижающего эффекта, связанное с низкой биодоступностью, которая в обычных таблетках по 5 мг составляет 29-69%. Биодоступность микронизированной формы приближается к
100%. Широко известный препарат манинил Берлин Хеми/АГ Менарини Групп содержит глибенкламид в микронизированной форме, полное высвобождение действующего вещества происходит в течение 5 мин после растворения таблетки, а терапевтическая концентрация в крови достигается в течение 15-30 мин. Благодаря высокой биодоступности суточную дозу манинила можно уменьшить на 30-40% по сравнению с приёмом обычных таблеток глибенкламида.
Дисперсность порошков, используемых в процессе производства лекарственных препаратов,
имеет и технологическое значение. Интересно, что переход от субстанции с определёнными размерами к субстанции с другими параметрами технологический процесс может потребовать существенной доработки. Это в условиях промышленного производства неудобно и невыгодно.
Размеры частиц порошковых субстанций оказывают влияние на свойства полупродуктов и готовой лекарственной формы, выбор технологии и оборудования.
Все это свидетельствует о необходимости строгого контроля над размерами частиц порошкообразных субстанций, используемых для создания лекарственных форм, и введения регламентации этого показателя в НД.
В ОАО «Акрихин» на примере большого ряда препаратов получен практический материал,
подтверждающий влияние формы и размеров кристаллов субстанций на параметры технологического процесса получения таблеточных масс и режимов их прессования. Например, для производства таблеток-ядер аминалона необходима только мелкокристаллическая субстанция, а кристаллы аминалона размером 500-1000 мкм дают непрочные, рыхлые таблетки. Таблеточную лекарственную форму карбамазепина хорошего качества методом грануляции в псевдоожиженном слое можно получить из микронизированной субстанции (до 20 мкм), а методом традиционной влажной
25

грануляции – только из порошка, имеющего размер частиц от 50 до 300 мкм. Таблетки пиразинамида получают из субстанции, имеющей размер основной массы частиц от 100 до 300 мкм, если же используют мелкокристаллическую субстанцию (до 50 мкм), то лекарственная форма из неё не соответствует требованиям НД по тесту «Растворение», так как она имеет высокую прочность. Для получения таблеток ацикловира с высоким показателем по тесту «Растворение» нормируют размер частиц субстанции – не более 50 мкм (Емшанова С.В. и др.).
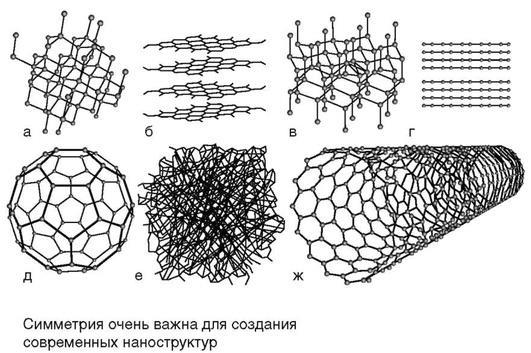
Полиморфизм. В настоящее время установлено, что большинство лекарственных веществ обладают полиморфизмом – способностью образовывать кристаллические структуры, идентичные в химическом аспекте, но отличающиеся по физическим свойствам: растворимости, удельной теплоёмкости, температуре плавления и др. Самый известный пример – полиморфные модификации углерода – алмаз, графит и др. В настоящее время известно семь таких модификаций углерода,
сравнение их структуры и физических свойств приведены на рис. 5.
Явление полиморфизма свойственно и лекарственным веществам. Более 70% лекарственных субстанций находятся в виде полиморфных модификаций, известны различные полиморфные модификации салицилатов, барбитуратов, антибиотиков, гормонов и других фармацевтических субстанций.
Полиморфные модификации веществ могут различаться пространственным расположением молекул, атомов и ионов в кристаллической решётке, строением структурных комплексов внутри молекул, степенью ассоциации молекул. Полиморфные модификации могут также быть обусловлены различными координационными числами, разной плотностью упаковки и формы кристаллов
(гексагональная, кубическая, ромбическая и др.), величиной угла между единицами кристаллической решётки, вращением молекул или радикалов кристаллической решётки.
Полиморфные модификации способны переходить из одной в другую под действием различных факторов внешней среды: при нагревании, кристаллизации, сушке, измельчении они активизируются в присутствии влаги и т.д. Некоторые вещества, не полиморфные, в естественных условиях способны менять структуру под давлением. В процессе полиморфного перехода наблюдается изменение внутренней энергии. Так, поглощение энергии приводит к повышению энергии связей в структуре, что не может не влиять на изменение прочности связей.
Полиморфные модификации различаются по стабильности, в связи с этим различают метастабильные и стабильные модификации. Учёными показано, что зачастую лучшую растворимость, а значит, и более высокий эффект дают метастабильные модификации. Однако в силу своих свойств они под действием внешних условий или при хранении переходят в менее активные, но стабильные полиморфные модификации. Различия в растворимости и скорости растворения особенно важны, поскольку они напрямую связаны с абсорбцией. Например, растворимость метастабильной модификации витамина В12 в воде составляет 1200 мг/л, а стабильной – 60 мг/л. Биодоступность и
26
максимальная концентрация в крови при приёме метастабильной формы выше, а её переход в стабильную модификацию возможен при повышенной температуре, поглощении влаги из воздуха,
кристаллизации, что может стать одной из причин терапевтической неэквивалентности получаемых препаратов.
Рис. 5. Кристаллические структуры аллотропных модификаций углерода: a – алмаз; б – графит; в – лонсдейлит (гексагональный алмаз); г – карбин; д – фуллерен C60; е – аморфный углерод; ж – одностенная углеродная нанотрубка.
Полиморфизм фармацевтической субстанции может стать причиной потери качества лекарственной формы.
В результате перехода полиморфных модификаций возможен рост кристаллов в жидких и вязкопластичных лекарственных формах (суспензиях, мазях, кремах), что изменит точность дозирования и биологическую доступность препарата. Потеря ресуспендируемости вследствие образования твёрдых конгломератов частиц дисперсной фазы может привести к потере качества лекарственной формы. Выпадение кристаллов при переходе более растворимой формы в менее растворимую в процессе хранения может стать причиной неравномерного распределения лекарственного вещества в лекарственной форме.
Так, технология производства суппозиториев включает стадию плавления, которая может инициировать полиморфный переход. Да и сами суппозиторные основы могут иметь различные полиморфные модификации. Например, масло какао существует в четырёх полиморфных формах,
имеющих разную температуру плавления (18, 24, 28-30 и 34-35 °С), температуру застывания,
удельный вес. При охлаждении расплавленного масла какао образуются кристаллы метастабильной α-
27

формы с низкой температурой плавления, что делает такие суппозитории непригодными для применения.
Вследствие многостадийности технологического процесса получения таблеток эта лекарственная форма наиболее сложна в биофармацевтическом плане. Лекарственное вещество подвергается увлажнению, частично растворению, механической переработке и нагреванию,
дегидратации и частично кристаллизации на этапе сушки гранул. При прессовании на таблеточном прессе оно испытывает механическое давление и воздействие повышенных температур. Вследствие многокомпонентности состава вспомогательных веществ крайне актуальны вопросы взаимодействия и возможной несовместимости ингредиентов лекарственной формы в условиях получения и хранения.
На каждом из этих этапов возможны полиморфные переходы.
Метастабильные модификации веществ часто легкорастворимы и более активны. Однако в процессе хранения в результате перехода в стабильную форму, растворимость которой ниже, могут образовываться осадки, нарушающие дозирование, а следовательно, приводящие к браку продукции.
Доказано, что от содержания той или иной полиморфной модификации фармацевтической субстанции в лекарственной форме зависят эффективность действия и стабильность. Различные полиморфные модификации одной и той же фармацевтической субстанции могут проявлять разную фармакологическую активность, что должно быть учтено при разработке технологии получения лекарственного препарата. Именно поэтому технологический процесс синтеза субстанции (который может заканчиваться стадией кристаллизации) и дальнейшей переработки её в лекарственную форму должен быть обоснован с позиции знаний свойств полиморфных модификаций, их стабильности и биологической эффективности, условий взаимного перехода в технологическом процессе и хранения.
Главным критерием должна быть не экономическая сторона разработки (стоимость вспомогательных веществ, оборудования и др.), а терапевтическая эффективность производимого лекарственного препарата.
Разработка нового лекарственного препарата – длительный и дорогостоящий процесс. Строгие требования к лекарственным средствам заставляют проводить всесторонние исследования активной молекулы, в том числе подвергая её различным воздействиям на предмет возможности появления и идентификации полиморфа. С этой целью применяют высокоточные инструментальные методы:
инфракрасную (ИК) спектроскопию, поляризационную микроскопию, рентгенографию,
дифференциально-термический анализ, ядерную магнитно-резонансную спектроскопию.
Государственная фармакопея (ГФ) в монографии «Полиморфизм» требует обязательного проведения оценки полиморфизма фармацевтической субстанции в тех случаях, когда полиморфная модификация определяет терапевтическую эффективность и безопасность лекарственного препарата.
Псевдополиморфизм. Сольватация. Фармацевтические субстанции могут представлять собой молекулярные комплексы вещества и растворителя – сольваты, которые характеризуются
28
определённым стехиометрическим соотношением молекул ингредиентов. Сольваты отличаются растворимостью от безводных форм. Так, сольваты кофеина, теофиллина растворяются гораздо медленнее безводных форм. И наоборот, известны сольватные формы, имеющие более высокую растворимость. Так, растворимость безводной формы ампициллина в воде при 37 °С на 20%
превышает растворимость ампициллина тригидрата. Отмечены и различные скорости растворения –
50% ампициллина безводного растворяется за 7 мин, тригидрата – за 45. Результаты исследований in vivo подтверждают более высокую биодоступность ампициллина тригидрата.
Ещё один пример сольватоморфизма демонстрирует противоастматический препарат сальбутамола гемисукцинат. Биодоступность сальбутамола гемисукцината превосходит биодоступность сульфата в 6 раз, кроме этого, он проявляет пролонгированное действие. По данным рентгеноструктурного анализа, сальбутамола гемисукцинат имеет каркасную конформацию,
благодаря которой он обладает способностью образовывать соединения включения (сольватоморфы)
при кристаллизации из различных растворителей. Прочность сольватоморфов сальбутамола гемисукцината различна. Так, этилацетат образует наиболее прочный сольват, который разлагается при температуре 120 °С. При кристаллизации других сольватоморфов этилацетат вытесняет из них такие растворители, как этанол, метанол, изопропанол, диоксан. При кристаллизации из воды кристалломорфы не образуются. Различные формы субстанции отличаются по температуре плавления, растворимости в воде, ИК-спектрам, стабильности. Фармакологическая эффективность сольватоморфа сальбутамола гемисукцината с этанолом на 30% уступает эффективности несольватированной молекулы.
Обнаружено, что сольватоморфы фармакопейных субстанций и их несольватированные формы
(аналогично полиморфным модификациям) могут также обладать различной растворимостью,
скоростью растворения, биодоступностью. Вследствие различий физико-химических свойств кристаллических сольватоморфов явление псевдополиморфизма субстанций имеет определённое значение для обоснования технологии производства как самих субстанций, так и их переработки в лекарственные формы. Именно поэтому ГФ в монографии «Полиморфизм» регламентирует необходимость учёта физико-химических свойств кристаллических сольватов при разработке процессов грануляции, сушки, прессования, измельчения, таблетирования и др.
Кристалличность. Традиционно говорят о существовании кристаллических или аморфных форм веществ. Однако идеальных кристаллов не бывает, в кристаллическом образце может находиться некоторое количество аморфного вещества. Именно поэтому целесообразно говорить о той или иной степени кристалличности вещества. Степень кристалличности – отношение массы кристаллической части порошка испытуемой субстанции к её общей массе, выраженное в процентах или долях.
Кристаллическое состояние – устойчивое состояние твёрдого вещества, имеющего структуру кристаллической решётки с анизотропными свойствами, то есть физические и физико-химические
29

свойства кристаллов различаются в зависимости от направления. Кристаллические вещества имеют постоянную температуру плавления.
Аморфные вещества характеризуются беспорядочным расположением молекул, не имеют постоянной температуры плавления и обладают лишь ближним порядком в расположении молекул,
их физические свойства не зависят от направления, то есть они изотропны.
Эти важные свойства оказывают влияние на стабильность, биодоступность и технологические характеристики лекарственных средств.
Известно, что аморфные вещества показывают, как правило, более высокие параметры растворения (в 2-30 раз) и поэтому могут представлять интерес для создания препаратов с быстрой абсорбцией, а значит, быстрого действия. Например, инсулин аморфный всасывается быстро,
кристаллический – медленнее, ещё медленнее всасывается комплекс «цинк-инсулин кристаллический». Это открытие в XX в. стало основой получения препаратов инсулина разной длительности действия.
Проблема при использовании аморфных веществ заключается в их меньшей стабильности: они либо переходят в стабильные, менее эффективные формы, либо требуют стабилизации. В настоящее время эти вопросы решают с помощью современных технологических методов: получения твёрдых дисперсий, лиофильной сушки, различных вариантов кристаллизации.
Известны субстанции, которым свойственны сразу несколько различных форм, изменяющихся самопроизвольно. Так, DL-пантотенат кальция имеет пять полиморфных и пять сольватных форм. При сушке сольват переходит в аморфную модификацию, при хранении в закрытом контейнере при температуре выше 30 °С – в α-форму, при хранении на воздухе – в моногидрат.
В ГФ XIII включена монография «Кристалличность», которая регламентирует необходимость указывать степень кристалличности, размер частиц субстанции в фармакопейной статье или НД при производстве лекарственных препаратов. Для измерения степени кристалличности рекомендуются следующие методы.
►Дифференциальная сканирующая калориметрия (позволяет определить тепловой эффект растворения, который при постоянном атмосферном давлении соответствует изменению энтальпии и характеризует степень кристалличности вещества).
►Оптическая микроскопия в поляризованном свете. Несколько частиц испытуемого вещества помещают на чистое предметное стекло в каплю минерального масла и исследуют с помощью поляризационного микроскопа. Кристаллические частицы обладают двойным лучепреломлением и свойством изменять направление оптических плоскостей при вращении столика микроскопа, что приводит к периодическому сверканию.
►Рентгенодифракционный анализ порошков. Дифрактограммы позволяют оценить форму и размеры кристаллитов (0,005-0,0005 мм), а также соотношение кристаллической и аморфной фаз.
30
► Ближняя ИК-спектрофотометрия, диапазон которой состоит из двух областей – коротковолновой (750-1100 нм) и длинноволновой (1100-2500 нм).
►Сканирование с помощью электронной микроскопии.
►Ультразвуковая дифракция.
Оптическая изомерия. Оптические изомеры, показывающие идентичное содержание вещества, могут самыми различными способами повести себя in vivo. Самым известным примером влияния оптической изомерии стала широко известная талидомидовая трагедия. Левовращающий изомер субстанции талидомида – активный транквилизатор, правовращающий, обладает тератогенным действием. Применение препарата беременными стало причиной появления на свет около 12 000 детей с врождёнными уродствами.
В числе причин различных фармакологических эффектов оптических изомеров – стереоспецифичность рецепторов, ферментов и транспортных систем организма. В результате контакт молекулы лекарственного вещества с мишенью происходит не полный, не по всем точкам, появляются точки отталкивания. Разная скорость метаболизма изомеров приводит к различным концентрациям лекарственного вещества в плазме. Более того, принятые дополнительно лекарственные вещества способны повлиять на метаболизм одного из изомеров.
Так, L-изомер варфарина – в 5 раз более сильный антикоагулянт по сравнению с D-изомером.
Противовоспалительные препараты избирательно тормозят метаболизм лишь L-варфарина и,
следовательно, селективно повышают его концентрацию в плазме. Другим примером неравноценности оптических изомеров считают адреналин. При нанесении на поверхность изолированного сердца крысы изомеров адреналина в равных соотношениях соотношение (-)-изомера к его (+)-изомеру внутри сердца составляет уже 11:1.
Рибавирин (1, 1-β-D-рибофуранозил-1,2,4-триазол-3-карбоксамид, виразол) –
модифицированный нуклеозид, действующий в отношении широкого спектра вирусов, содержащих рибонуклеиновую кислоту (РНК) и ДНК (рис. 6). Обладает выраженным лечебным действием при гепатите С, лихорадке Ласса, а также при гриппе А- и В-типов.
Виразол оказался эффективен также и при респираторно-синцитиальной вирусной инфекции,
бронхиолитах и пневмонии у детей первого года жизни, а также при лечении гепатита С,
геморрагических лихорадок с почечным синдромом.
Однако рибавирин обладает серьёзным побочным действием в отношении кроветворной системы пациентов – вызывает гемолитическую анемию, что вынуждает исследователей осуществлять поиск более безопасных терапевтических средств, обладающих меньшей системной токсичностью. В
этом смысле перспективными представляются аналоги рибавирина (см. рис. 6, б, в) – левовирин и вирамидин. Левовирин – L-энантиомер рибавирина, который обладает подобной рибавирину
31
