
6 курс / Эндокринология / Эндокринология_подростков,_Строев_Ю_И_,_Чурилов_Л_П_
.pdf
восновном тестостерона у мужчин. ЛГ активирует
исинтез многих простагландинов. Фолликулостимулирующий гормон (ФСГ) ускоряет рост фолликулов яичника и стимулирует сперматогенез.
Гормон роста, соматотропин или соматотроп-
ный гормон (СТГ), регулирует ростовые и анаболические процессы. СТГ стимулирует утилизацию аминокислот из крови и синтез белка, действуя через
инсулиноподобные факторы роста — ИФР-I (соматомедин С) и ИФР-П (соматомедин А), продуцирую-
щиесяв основномвпечениифункционирующиекакауто-
ипаракринные гормоны.
Вгипофизе вырабатываются и меланоцитостиму-
лирующие гормоны (интермедины или различные подвиды меланоцитостимулирующего гормона — МСГ). МСГ пигментирует кожу, действуя на меланоциты, участвует в стрессовых реакциях, влияет на возбудимость мозга, вызывает липолиз(ШрейберВ., 1987).
Гипофиз продуцирует также (из общего с АКТГ и МСГ предшественника проопиомеланокортина — ПОМК) ряд опиатных пептидов и липотропинов. Опиоидные пептиды аденогипофиза многочисленны. Это а-, в- и у-эндорфины, пептиды динорфинового семейства — динорфины А и В, а также а- и Р-неоэндорфи- ны. Мет-энкефалиновая последовательность имеется
вПОМК, но энкефалины в аденогипофизе не процессируются. Аденогипофиз продуцирует некоторые факторы роста, в частности, эритропоэтин (Зай-
чик А.Ш., Чурилов Л.П., 2000, 2002).
Патология каждого из отделов ГГНСК имеет свои особенности. Ниже они кратко рассматриваются применительнок гипоталамусуи к гипофизу. Затем даётся детальная клинико-патофизиологическая характеристика тех заболеваний гипоталамуса и гипофиза, которые наиболееважны в практике подростковоговрача.
Гипоталамус вместе с нейрогипофизом развивается из выпячивания нейроэктодермы дна промежуточного мозга. Он насыщен нейросекреторными клетками.
Гипоталамические мелкоклеточные нейроны,
имеющиеся в аркуатном ядре, перивентрикулярной зоне, вентромедиальном и частично паравентрикулярном и супраоптическом ядрах, синтезируют (частично — не рибосомальным путём) и выделяют стимуляторы сек-
реции гипофизарных тройных гормонов (либерины
или, при неидентифицированной структуре, —рилизинг-
факторы), а также ингибиторы секреторной деятельности аденогипофиза — статины (при неиден-
тифицированной структуре — ингибитинг-факторы).
Автор идеи «гипоталамической либерин-стати- новой регуляции» М. Саффран (1955) первоначально полагал, что для каждого аденогипофизарного гормона имеется пара контррегулирующих факторов, но реальная регуляция оказалась экономнее. Так как до-
минирующее влияние гипоталамуса на секрецию пролактина в гипофизе является тормозным, а на продукцию остальных аденогипофизарных регуляторов—сти- мулирующим, то пересечение ножки гипофиза вызывает пангипопитуитаризм, но растормаживает и повышает пролактиновую секрецию.
Краткая характеристика гипоталамических мелкоклеточных биорегуляторов аденогипофиза содержится в таблице 1.
Таблица1
Биорегуляторымелкоклеточныхнейросекреторных клеток гипоталамуса
Гормон |
Структура |
Примечание |
Тиролиберин |
Пироглутамилгис- |
Одновременно - слабый |
|
тидилпролин-амид |
пролактолиберин |
Кортиколиберин |
Пептид из 41 |
Ключевой либерин |
|
аминокислоты |
стресса |
Люлиберин |
Декапептид |
Одновременно - |
|
|
фоллиберин |
Соматолиберин |
Пептид из 44 |
Главный стимулятор |
(соматокринин) |
аминокислот |
продукции СТГ |
Соматостатин |
Пептид из 14 ами- |
Одновременно- |
|
нокислот, желудоч- |
тиростатин, слабый |
|
но-кишечный тракт |
кортикостатин, снижает |
|
производит прогор- |
продукцию ряда |
|
мон из 28 амино- |
гормонов желудочно- |
|
кислот |
кишечного тракта |
Пролактостатин |
Дофамин |
Переднее перивентрику- |
(основной) |
|
лярное и аркуатное ядра |
Пролактостатин- |
Пептид |
Карбокси-конец |
пептид |
из 56 аминокислот |
предшественника |
|
|
люлиберина |
Меланостатин |
Пролиллейцил- |
Карбокси-конец |
|
глицинамид |
окситоцина |
МСГ-рилизинг |
Не идентифициро- |
Стимулятор продукции |
фактор |
вана |
МСГ |
Пролактин- |
Не идентифициро- |
Предположительно, ВИП |
рилизинг |
вана |
|
фактор |
|
|
Многие гормоны этой группы синтезированы и дос-
тупны как лекарства (тиролиберин, гонадолиберин и
др.). Особенно перспективно применение длительно действующего аналога соматостатина — октреотида, который, в частности, эффективно подавляет гор- монообразование в самых различных апудомах.
Помимо этого, нейросекреторные клетки гипоталамуса вырабатывают множество нейропептидов паракринного местного действия и содержат к ним рецепторы. Эти пептиды очень важны в регуляции поведения и гомеостаза.
Так, нейропептид У в аркуатном ядре стимулирует аппетит и пищевое поведение, его продукция чум ствительна к лептину адипоцитов и к гормонам же- лудочно-кишечного тракта. Ангиотензин II -пептид жажды в латеральных гипоталамических яд-pax. Более подробную характеристику этих гипоталамических регуляторов приводят ряд авторов (Поле-
40

нов А.Л., 1993; Зайчик А.Ш., Чурилов Л.П., 1999, 2000).
Гипоталамические либерины служат и секретор-
ными, и митогенными стимуляторами для клеток аденогипофиза. Их действие осуществляется через рецепторы, ассоциированные с G-белками, путём повышения в клетках-мишенях концентраций ц-АМФ и калъция, ускорения кругооборота инозит-фосфати- дов и мобилизации соответствующих протеинкиназ. Они также проникают внутрь таргетных клеток и их ядер и влияют на экспрессию генов и синтез м-РНК, вызывая в известных пределах, заданных предыдущей дифференцировкой, секреторную переориентацию клеток аденогипофиза. Статины тоже опосредуют своё действие, приводящее к понижению уровня внутриклеточной ц-АМФ и кальция через G-белки. Хроническая гиперсекреция либеринов может вызывать не только гиперфункцию, но и гиперплазию соответствующих аденогипофизарных клеток-мишеней.
Гипоталамические гормоны попадают в аденогипофиз по портальной системе кровообращения, которая включает капиллярную сеть в гипоталамусе, принимающую эти регуляторы от мелкоклеточных нейронов. В области этой капиллярной сети повышенная проницаемость гемато-энцефалического барьера даёт возможность кровяным метаболическим и гормональным сигналам достигать нейросекреторных гипоталамических клеток и модулировать их секреторные ответы. Далее идут короткие и длинные собирательные вены воронки (срединного возвышения) числом до 20. Наконец, имеется вторая капиллярная сеть, диффузно распределённая в пределах всего аденогипофиза, где и находятся таргетные клетки (рис. 14). Венозные коллекторы от аденогипофиза ведут через нейрогипофиз в гипофизарные вены и кавернозный синус, а далее — в системную циркуляцию.
Портальная система гипофиза обеспечивает в его ножке абсолютно наивысший уровень удельного кровотока— 10 мл/г ткани в минуту! В силу абсолютной достаточности коллатералей в этом органе даже тромбоз одной из гипофизарных артерий не вызывает его инфаркта. Клиническая картина некоторых нарушений функции гипофиза, ранее приписывавшаяся тромбозу гипофизарных артерий, на деле является следствием аутоиммунного гипофизита {синдром Шихена).
В настоящее время известно, что существуют анастомозы, по которым венозная кровь может поступать обратно в медиобазальный гипоталамус и в срединноевозвышение— из нейрогипофиза. Этопозволяет
нонапептидам крупноклеточных ядер гипоталамуса принять участие в регуляции секреции аденогипофизарных гормонов и в сервоконтроле продукции гипоталамических факторов. Отметим, что без портальной системы либерины и статины разбавлялись бы в системной циркуляции и аффинно извлекались оттуда рецепторами негипофизарных клеток, что не позволяло бы поддерживать их эффективные концентрации в аденогипофизе.
Крупноклеточные секреторные нейроны гипота-
ламуса сосредоточены в магноцеллюлярных частях супраоптического и паравентрикулярного ядер, а также в преоптической области. Они вырабатывают рибосомальным путём количественно самые значимые гипо-
таламические гормоны — нонапептиды, первыми обнаруженные и охарактеризованные в подбугорье
(Шаррер Э., 1938; Дю Виньо В., 1955).
Супраоптическое ядро у человека выделяет в основном аргинил-вазопрессин, главные функции которого — осморегуляция, стимуляция стресса и повышение кровяного давления, а паравентрикулярное — преимущественно окситоцин, известный как утеротоник и галакторетик.
По современным представлениям, у человека поня-
тия «вазопрессин» и «антидиуретический гормон»
абсолютно равнозначны, хотя ранее и были разночтения по этому вопросу. В связи с этим вазопрессин в дальнейшем изложении фигурирует и как антидиуретичес-
кий гормон (АДГ).
Нонапептиды крупноклеточных элементов гипоталамуса транслируются в виде препрогормонов, в структуре которых находятся специальные пептиды-
переносчики — нейрофизины. Нейрофизин //образует с вазопрессином комплекс — белок Х.Б. ван Дейка
(рис. 16). Нейрофизин I связывает и переносит окситоцин. Следует подчеркнуть, что вопреки ранним представлениям, каждый отдельно взятый нейрон синтезирует либо окситоцин, либо вазопрессин, и в нейрогипофизе нет их общего предшественника.
Препрогормоны гликозилируются в прогормоны и
пакуются в гранулы. Аксовазальным током они транспортируются в терминали аксонов, в заднюю долю гипофиза, а частично — в медиальное возвышение и в III мозговой желудочек. Поэтому пересечение ножки гипофиза и его разрушение не лишают организм вазопрессина и окситоцина, которые про-
должают попадать в аденогипофизарный и системный кровоток и цереброспинальную жидкость. Лишь по-
вреждение переднего гипоталамуса может привести к абсолютно недостаточной продукции этих гормонов.
41
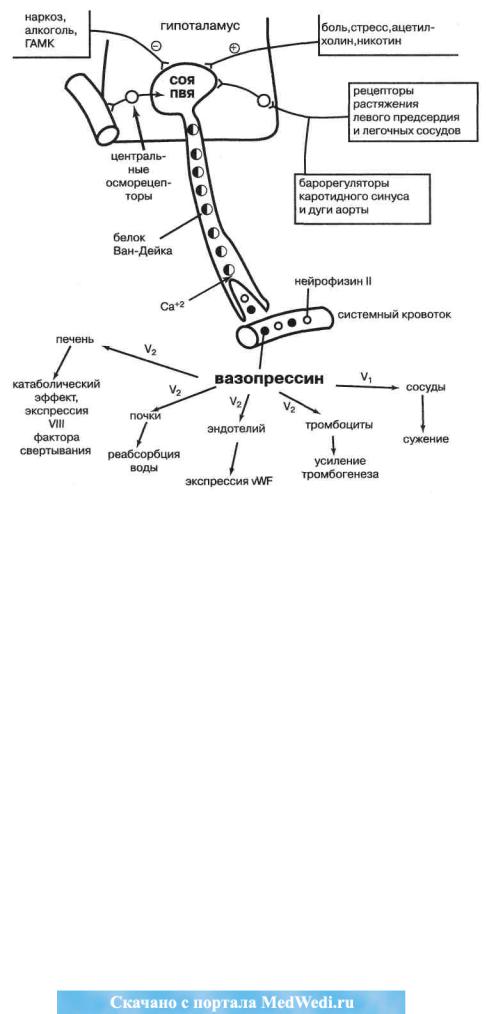
Рис. 16. Регуляция секреции вазопрессина и его эффекты. СОЯ — супраоптическое ядро, ПВЯ — паравентрикулярное ядро, V1иV9 —вазопрессиновыерецепторы,ГАМК—гамма-аминомаслянаякислота,vWF—факторфонВиллебранда
Общим стимулятором секреции обоих нонапептидов является боль, а общим ингибитором—этиловый спирт. Всем хорошо известна полиурия, возникающая после приема алкогольных напитков, которые подавля-
ют продукцию антидиуретического гормона. Нона-
пептиды закономерно секретируются в системный кровоток при стрессе.
Регуляция вазопрессиногенеза, изученная Ж. Вернеем, отражена на рис. 16 и характеризуется следующими особенностями.
Продукция вазопрессина максимальна ночью и минимальна в полдень. АДГ— гормон, секреция которого наиболее сильно стимулируется (по убывающей мощности) гипотензией, гиповолемией и, наконец, гиперосмоляльным состоянием внеклеточной жидкости. Даже 2 % прирост осмоляльности плазмы от ее нормального среднего уровня в 281,7 мОсм/кг Н20 ведет к стимуляции центральных гипоталамических осморецепторов, синте-
зу и выбросу вазопрессина.
42
Гиповолемия рефлекторно (через рецепторы растя-жения левого предсердия и легочных сосудов) стиму лирует выброс и синтез АДГ еще активнее. Этот ме-ханизм включается при дыхании под положительным давлением, длительном стоянии на одном месте и бы-строй вазодилятации. Напротив, гиперволемия, неве-сомость, ныряние под воду и охлаждение тормозят этот механизм и понижают продукцию АДГ. Немаловажным последствием этого служит усиленный диурез, который желателен не во всех подобных ситуациях.
Ряд стимулов, в частности, гипотензия, тошнота, рво-та и курение очень сильно стимулируют вазопрессино-генез, почти не отражаясь на продукции окситоцина. Си-стема продукции вазопрессина имеет феноменальный резерв мощности и в экстремальных ситуациях,напри-мер, при шокеи способна нарастить его концентрацию в крови более чемвЮООраз. Повышение уровня вазоп-рессина от 2 пМ/л до 500 пМ/л при стрессах — обыч-ное дело. При гиповолемическом шоке она превыша-
ет 600 пМ/л. Медиатор жажды ангиотензин II стимулирует, а кортикостероиды — тормозят продукцию вазопрессина. Порог жажды несколько выше порога вазопрессинового ответа (292 мОсм/ кг Н20). Установлено также стимулирующее влияние ацетилхолина на вазопрессиногенез через Н-холинорецепторы и нейропептид Y. Гипноз и гиперкапния подавляют вазопрессиногенез и способствуют диурезу.
Метаболическое действие вазопрессина обусловлено его влиянием на V2-И V1-рецепторы, причём для стимуляции первых требуются существенно меньшие концентрации гормона. V-рецепторы представляют семейство ассоциированных с G-белками. Пострецепторный механизм передачи вазопрессинового сигнала типичен для этой разновидности рецепторов и включает стимуляцию аденилатциклазы и протеинкиназ (преимущественно у V2-рецептора), фосфатидил-инозито- лового обмена (преимущественно у V1-рецептора), кальций-кальмодулинового взаимодействия и простагландинового синтеза в клетке-мишени (рис. 16).
Спектр эффектов нонапептидов представлен в виде сравнительной табл. 2.
Ниже речь пойдет вначале о влиянии вазопрессина. Основной V2-опосредованный эффект вазопрессина
— усиление реабсорбции воды (но не электролитов!) в дистальных канальцах и собирательных трубках почек. Вазопрессин-зависимый механизм способен реабсорбировать до13% всей первичной мочи.
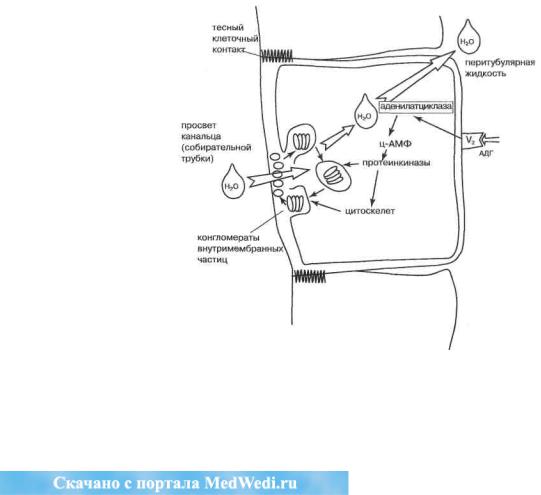
В настоящее время известно (Валтин X., 1992), что АДГ через координированное действие вышеназванных посредников способствует активации цитоскелета эпителиоцитов почек и фосфорилированию мембранных белков. Последние собираются в особые кластеры внутримембранных частиц на люменальной стороне клетки (рис. 17) и формируют канал-перенос- чик для молекул воды (эффект «аквапереносящего белка» или аквапорина-2).
Как единственный гормон, способный стимулировать почечную реабсорбцию воды без задержки натрия, АДГ в экстремальных ситуациях обеспечивает максимальную экономию водных и волемических ресурсов организма. Эволюционно это оправдывается тем, что множество опасных ситуаций заканчивается кровотечением. Вазопрессиновый ответ особенно важен при травмах, кровопотере и дегидратации. По некоторым данным, вазопрессин способствует и созданию натриевого градиента петлёй Генле, что важно для поддержания концентрирующей способности нефронов. Он активизирует фильтрацию, ноне оказывает натрийуретического действия.
|
|
Таблица2 |
Эффектынонапептидныхгормоновгипоталамуса |
||
|
|
|
Структуры |
Эффект |
Эффект |
и функции |
вазопрессина |
окситоцина |
Реабсорбция Н2О |
Сильно тормозит |
0,5% от эффекта |
почками |
|
вазопрессина |
Артериальное |
Повышает при высо- |
Слегка понижает |
давление |
ких концентрациях |
|
Коронарные |
Сужает |
Слегкарасширяет |
артерии |
|
|
Стресс |
Сильная КРФ- |
Слегка усиливает |
|
подобная активность |
эффект КРФ |
Перистальтика |
Стимулирует |
Не влияет |
кишечника |
|
|
Сокращения матки |
Стимулирует |
Мощный стимулятор |
Выделение молока |
Слегка стимулирует |
Основной стимулятор |
Эякуляция спермы |
Слегка стимулирует |
Сильно стимулирует |
Кожные и |
Сужает |
Расширяет |
мышечные |
|
|
сосуды |
|
|
Метаболическое |
Сильный активатор глю- |
Значительно стиму- |
действие |
конеогенеза, гликолиза, |
лирует липогенез в |
|
гликогенолизаи окисле- |
адипоцитах. |
|
ния жирныхкислот в |
Антикетогенное |
|
печени. Слегкаувеличи- |
действие |
|
вает липогенез в адипо- |
|
|
цитах. Антикетогенное |
|
|
действие |
|
Тромбоциты |
Активатор адгезии, |
Не влияет |
|
агрегации, тромбо- |
|
|
генеза- в больших |
|
|
концентрациях |
|
Клеточный |
Не влияет |
Активирует |
иммунитет |
|
|
Центральная |
Усиливает память, обу- |
Понижает реакцию |
нервная |
чаемость, тревогу, пони- |
на боль |
система |
жает реакцию на боль |
|
Рис. 17. Механизм действия АДГ на почки
43

АДГ, как об этом ясноговорит еговтороеназвание— вазопрессин, является важным регулятором кровообращения, особенно при стрессе, коллапсе и шоке. АДГ (через V1 -рецепторы) служит мощным вазоконстриктором для сосудов кожи и мышц. Предполагается его участие в перераспределении кровотока при стрессе и в обеспечении рабочей гиперемии функционирующих мышц, а также в централизации кровообращения при компенсированном шоке.
Очевидна роль вазопрессина в патогенезе артериальной гипертензии, в том числе стрессорной. Интересно, что большие дозы этого гормона способны сужать и коронарные сосуды, что даже послужило основой для создания модели коронарной недостаточности на со-
баках (Теплов СИ., 1962).
Не исключено, что именно вазопрессиновый компонент стресса имеет наиболее тесную связь с действием стресса как фактора риска сердечно-сосудистой патологии. Вазопрессиновые рецепторы в каротидных синусах делают барорецепторы более чувствительными к колебаниям системного артериального давления, что отражает необходимость более мощного использования барорефлексов для регуляции кровяного давления в экстремальных ситуациях.
Сверхвысокие концентрации АДГ, создающиеся в предагональных состояниях, способны сильно изменить и реологические свойства крови. Кровяные пластинки и эндотелий располагают вазопрессиновым рецептором и отвечают на экстремальную гипервазопрессинемию усилением тромбогенной активности. Вазопрессин усиливает экспрессию фактора фон Виллебранда эндотелием и освобождение печенью VIII фактора свёртывания (через V2-рецепторы), способствуя тем самым гемокоагуляции. Синдром диссеминированного внутрисосудистого свёртываниятромбообразования регулярно сопровождается сверхвысокими уровнями АДГ.
Вазопрессин — гепатотропный метаболический гормон, активатор ряда важных обменных процессов. Он стимулирует у голодных животных печёночный глюконеогенез, у сытых — гликолиз, в обоих случаях тормозит образование и ускоряет распад гликогена. Под влиянием вазопрессина усиливается зависящая от гормонов надпочечников гипергликемия. Вазопрессин усиливает захват и окисление печенью жирных кислот и их этерификацию. Он предупреждает кетогенный эффект глюкагона, продукция которого при стрессе тоже увеличена. АДГ обладает инсулиноподобным действием на жировую ткань, стимулируя в ней липогенез, захват глюкозы и «убирая» в адипоциты избыток неэтерифицированных жирных кислот
плазмы. Поэтому под его влиянием развивается дли тельное снижение уровня неэтерифицированных жирных кислот плазмы (возможно, в какой-то степени АДГ) и при стрессе предохраняет организм от диабетогенногодействия других стрессорных гормонов,
Вазопрессин действует и на центральную нервную систему. А.Ш. Зайчик и Л.П. Чурилов (1999, 2002)
подробно освещают его роль как синергиста КРФ и активатора стресса. АДГ связан с индукцией чувства тревоги и понижает реакцию на боль. Этот нейрогор мон стимулирует память и у крыс влияет на время сохранения реакций избегания по отношению к повторным стрессорам. Г. де Виед (1984) установил, что даже небольшие количества вазопрессина радикально улучшают обучаемость у крыс.
Окситоцин как системный регулятор не остаётся в тени своего более знаменитого собрата. Как уж говорилось, боль служит общим стимулятором, а этиловый спирт — общим ингибитором продукции но- напептидов. В связи с этим алкоголь обладает мочегонным, но никак не родостимулирующим действием. Специфически и более мощно секрецию окситоцина активируют нейроэндокринные рефлексы, возбуждаемые растяжением матки и влагалища и механическими воздействиями на соски молочных желёз. У мужчин она стимулируется при рефлексе эякуляции. Эти сигналы, а такжеэстрогены стимулируют секрецию окситоцина, почти не затрагивая вазопрессинообразование. Гиперосмолярность меж клеточной жидкости усиливает выброс окситоцина незначительно. Стресс характеризуется окситоцин либерирующим действием. У окситоцина не отмеченоциркадногоритмасекреции.Уженщинкмоменту овуляции его уровень возрастает в 3-4 раза, а после нее — падает. В родах он может на короткое время вырасти в 30-50 раз, а при сосании груди укормящей матери — в 8-10 раз.
Окситоцинусиливает сокращения матки при иду-
щ
их родах с момента растяжения родовых путей, ускоряеттечениеродови отхождениепоследа, нозапускать роды не может. Пермиссивное синергичное действие на маточный эффект окситоцина оказывают эстрогены. При дефиците окситоцина роды воз можны, но удлинены. Для рефлекторной экскреция молока изгрудной железы окситоциннеобходим, при его отсутствии она прекращается. Этими эффектами определяется клиническое применение окситоцина как лекарства.
Окситоцин в почках обладает слабым вазопрес синоподобным эффектом, а кроме того он стимулиру еткровотокифильтрациювкортикальныхнефронах
44

Метаболически он проявляет инсулиноподобное действие на жировую ткань, стимулируя в ней липогенез, захват глюкозы и свободных жирных кислот плазмы. Поэтому под его влиянием развивается длительное снижение уровня неэтерифицированных жирных кислот плазмы и, возможно, вместе с АДГ в какой-то степени окситоцин предохраняет от кетоза при стрессе. Окситоцин снижает ответ центральной нервной системы на боль, что может иметь физиологическое значение в родах. Имеются свидетельства, что данный гормон стимулирует клеточный иммунитет (Михайлова Е.А. с соавт., 1986).
Нарушения функций гипоталамуса разнообразны и порой трудноотделимыотгипофизарныхнарушений. Всвязиснейроэндокриннойприродойгипоталамуса его поражения приводят к симптоматике, которую и неврологи, и эндокринологи рассматривают в контекстесвоей специальности. Важнопомнить отом, чтонейросекреция сосредоточена именнов тех же клетках, которыеучаствуют в рефлекторных цепях.
Поэтому применяемые в разных конкретных медицинских специальностях термины не только не исключают друг друга, но часто синонимичны. Так, диэнцефальные синдромы в невропатологии и гипоталамические эндокринопатии в эндокриноло-
гии— это две стороны одного и того же патологичес-
кого процесса. Обратимые, начальные проявления гипоталамической дисфункции могут традиционно условно обозначаться в практике как «вегетативная дистония» или даже «астено-невротичес- кий синдром». Данные термины достаточно часто применяются в подростковой медицине, и важно учитывать их истинный смысл, обязательную связь с гипоталамопатиями.
Гипоталамусу свойственно полярное расположение центров, регулирующихпротивоположныефункции. Например, центры насыщения расположены вентромедиально, а голода — дорсолатерально; парасимпатические ядра, а также центры сна и теплопродукции находятся в переднем, а симпатические центры пробуждения и теплоотдачи — в заднем гипоталамусе и т.д. Это приводит к возникновению гомеостатических и поведенческих расстройств противоположного знака при разной топографии очаговых поражений подбугорья. Кроме того, билатеральныецентры имеют обширные перекрёстные нервные связи. Следовательно, для формирования клинических расстройств необходима двусторонняя альтерация гипоталамуса. Массивные медиальные поражения часто распространяются на близлежащие симметричные центры, а латеральные достигаютнеобходимыхдляэтогоразмеровредко.По-
этому, например, гипоталамическое ожирение при двусторонней деструкции медиальных центров встречается гораздо чаще, чем гипоталамическая кахексия. При локализации процесса в районе медиального возвышения даже одиночный очаг небольших размеров дает картину серьёзных нейроэндокринных расстройств из-за нарушения функции портальной передачи гормонов.
При хроническом развитии гипоталамического процесса нижележащие нейроэндокринные центры могут компенсировать многие его проявления. Острое выпадение функций подбугорных образований приводит к выраженным расстройствам. Поэтому при хронических процессах (например, опухолях) даже большой по объёму местный очаг часто не сопровождается отчётливыми симптомами. В то же время совсем небольшие острые локальные повреждения (травмы, ишемические и геморрагические инсульты) чаще ярко симптоматичны.
Острые и хронические поражения подбугорья нередко полярны и по знаку наступающих гомеостатических расстройств. Гипергликемия и гипертермия более характерны для острых, а гипогликемия и гипотермия — для хронических процессов. Острое тяжелое диффузное повреждение подбугорья, случайное нейрохирургическое или экспериментальное разрушение гипоталамуса приводят к коме и к атональной недостаточности витальных вегетативных функций. Хроническое поражение проявляется нарушениями когнитивной сферы и метаболическими расстрой-
ствами (Наута У., Фейртаг А., 1984; Фромен Л.А., 1987; Дэниеле Дж., Мартин Дж., 1994).
Общая этиология гипоталамопатий характеризуется действием различных факторов в разном возрасте.
У новорожденных они вызываются родовой травмой, кровоизлияниями в мозг, гидроцефалией, ядерной желтухой. У детей и подростков проявляются семейные наследственные синдромы — Лоуренса-Муна-
Барде-Бидля, Прадера-Вилли (Ю.И. Строев с со-авт., 2003). Могут приводить к диэнцефальному поражению менингиты и энцефалиты. Известен, напри-
мер, вирусный энцефалит Экономо с поражением гипоталамуса и летаргией.
Гипоталамус — один из самых радиочувствительных отделов центральной нервной системы. Известны гипоталамопатий у детей, подростков и взрослых при ятрогенном и профессиональном облучении.
У лиц любого возраста, в первую очередь, у подростков и молодых людей, важной причиной гипоталамопатий являются негормонообразующие и гормонооб-
45

разующие опухоли подбугорной и соседствующей локализации (по убывающей частоте: краниофаринги-
омы, астроцитомы, дисгерминомы — включая так называемые «эктопические пинеаломы», ганглиоци-
томы). Гипоталамус повреждается крупными гипо-
физарными опухолями и менингиомами, изредка он может вовлекаться в клеточную инфильтрацию при ге-
мобластозах и саркоидозе.
В зрелом возрасте большое значение приобретают токсические поражения гипоталамуса, в частности, по частоте в лидеры выходит синдром Вернике-Корса- кова, когда из-за хронической алкогольной интоксикации возникают полигиповитаминоз, демиелинизация, нейропатия и своеобразное диэнцефальное расстройство с потерей краткосрочной памяти. У лиц пожилого возраста на первый план выходят сосудистые поражения гипоталамуса, связанные с церебральным атеросклерозом и последствиями артериальной гипертензии
(Плам Ф., ван Уйтерт В., 1978).
Следует отметить, что часто в подбугорье при наличии явного гипоталамического нейроэндокринного расстройства не удаётся визуализировать или обнаружить при аутопсии внешних признаков какого-либо локального процесса. Прежде такие ситуации трактовали как «психогенные расстройства» — психогенная дисменорея, нейрогенная анорексия и т.д. Однако и они не лишены нейрохимической основы и вызваны нарушением регуляции образования гипоталамических гормонов.
Общий патогенез гипоталамопатий в любом возрасте характеризуется следующими особенностями, которые комбинируются при разной этиологии и топике поражений.
• Синдромом нарушения пищевого гомеоста-за.
Гипоталамус содержит лептиновые рецепторы и воспринимает либо выделяет множество регуляторов, стимулирующих аппетит (нейропеп-
тид Y, орексины, эндорфины и энкефалины,
ГАМК, дофамин) и вызывающих реакцию насы-
щения (холецистокинин, ВИП, нейротензин, тиролиберин, катехоламины, серотонин, со-
матостатин). Опухоли вентромедиального гипоталамуса вызывают ожирение, полифагию и агрессивное поведение. Нарушения подукции гипоталамотропного пептида липоцитов —лепти- на, а также его рецепции в гипоталамусе ведут к расстройству функционирования гипоталамического липостата и изменению установочной точки массы тела индивида. Описаны редкие случаи гипоталамической анорексии и кахексии, связанной споражением центров аппетита. Нижеобсуж-
46
даются гипоталамические аспекты механизмов типичноподросткового заболевания
— нейроген ной анорексии-булимии (стойкое отсутствие им пульсного режима секреции гонадолиберина, по вышение продукции
кахексина, вазопрессина и кортиколиберина и
снижение ответа аденогипо-физа на
тиролиберин и люлиберин, пойкилотер мия).
•Синдром расстройства терморегуляции
Изменение установочной точки температурного гомеостаза в гипоталамусе при посредстве эндогенных пирогенов и простагландиновых модуляторов происходит при любой лихорадке (3aй
чик А.Ш., Чурилов Л.П., 1999). Извращение работы гипоталамического терморегулятора с aк
тивацией термогенеза имеет место при декомпен сированном перегревании и декомпенсированной гиперосмолярной дегидратации. Известны и другие гипоталамические расстройства гомойотермности — пароксизмальные гипотермияаритмия, чувствительная к противосудорожным пре-
паратам, и гипертермия в ответ на воздействие некоторых нейролептиков. Пойкилотермия наблю дается при повреждении заднего гипоталамуса острая гипертермия — при диэнцефальной трав ме и инсультах.
•Извращение сна и бодрствования при гипо-
таламопатиях может выражаться в ажитации
ибессоннице — при повреждении переднего под-бугорья или сомнолентных состояниях —
у больных с поражением заднего гипоталамуса Обширные острые повреждения гипоталамуса ведут к коме.
•Расстройства эмоционально-поведенческих
икогнитивных функций включают нарушение
памяти (при поражении медиального гипотала муса и сосцевидных телец) и даже — слабоумие Типична утрата кратковременной памяти с сохранением долговременной, например, при выше-упомянутом синдроме Вернике-
Корсакова У гипоталамических больных
описаны анома лии эмоциональномотивационной сферы: безу-держная гневливость и агрессия, садомазо-хистское поведение, дурашливость в связи с по вреждениями центров ярости (в латеральном гипоталамусе) и наказаний (в перивентрикулярных ядрах).
• Расстройства водно-солевого гомеостаза ха-рактерны для поражения ангиотензинергических регуляторов латерального гипоталамуса и для на-рушений вазопрессиногенеза. Последниерассмат-

риваются отдельно ниже. Помимо несахарного диабета, гипоталамические нарушения питьевого поведения включают так называемые цереб-
ральную гипонатриемию и церебральную ги-
пернатриемию. Клинически эти нарушения расцениваются как психогенная первичная полидипсия, адипсия и гиподипсия. При первичной «психогенной» полидипсии в отсутствиенарушений вазопрессиногенеза больныеиспытывают периодическую обсессивную тягукпоглощению жидкости, часто—охлаждённой.Развивается гипоосмолярнаягипергидратацияпри гипоосмолярности мочи. В тяжёлых случаях может быть набухание клеток и симптомы «водного отравления» и «лож-
ного ожирения». Этосостояниесходно с синдромом избыточной продукции вазопрессина, однакопри гиперсекреции вазопрессина больные не могут экскретировать разведёную мочу. Вероятно, имеются особенности чувствительности центров жажды к ангиотензину и какие-тоформы связи ангиотензино-
вых и опиатэргических воздействий в гипоталамусе. В отличие от несахарного диабета, осмолярность плазмы не превышает 290 мОсм/кг Н20, а вазо-прессин не помогает, а приводит к ухудшению самочувствия. Первичная гиподипсия характеризуется снижением реактивности центра жажды или егоповреждением. Несмотря на гипернатриемию, больныежажды неощущают, а функцияпочек унихнормальная.
•Вегетативные расстройства часто имеют также гипоталамическую природу, ибо в головном мозге нейроны, воздействующие специфически на функции вегетативной нервной системы, сконцен трированы в подбугорье. Часть из них посылает непрерывающиеся проводники к спинальным ве гетативным центрам, другие переключают свои моторные выходы на стволовых структурах моз га. Примерами поражения вегетативной нервной системы при гипоталамопатиях служат диэнце-
фальный эпилептический синдром с пароксиз-
мальными приступами гиперактивности автоном ных нервов, а также, в известной степени,
диабетическая автономная нейропатия, меха низм которой связан с ангиопатией сосудов гипо- таламо-гипофизарной системы. В подростковой медицине в качестве обратимого возрастно го расстройства гипоталамических функций может трактоваться вегетососудистая ди стопия (Левина Л.И., Щеглова Л.В., 1999).
•Еще в XIX столетии русский иммунолог И.Г. Савченко показал, чтопри разрушении ги-
поталамуса у птиц их иммунная система ослабевает настолько, что они заболевают несвойственной пернатым сибирской язвой. В настоящее время работами школы Е.А. Корневой установлено участие гипоталамуса в регуляции иммунного ответа. При введении антигенов регистрируются определенные паттерны изменений в гипоталамических ядрах. Цитокины (в частности, ИЛ-1, ИЛ- 6, ИЛ-8, ИФН) влияют на нейроэндокринные функции гипоталамуса и вырабатываются в этом отделе мозга (Корнева Е.А., 2003). Ряд поражений гипоталамуса, в частности, при синдроме хро-
нической усталости и иммунной дисфункции
(Новик А.А., Цыган В.Н., Дулатова Н.Х. и др., 2001), сопровождаются закономерными нарушениями иммунологической реактивности и вторичным иммунодефицитным состоянием. •
Собственно нейроэндокринные гипоталамические расстройства — до известной степени условно очерченное понятие, подразумевающее состояния с определённой, выясненной аномалией в продукции тех или иных гормонов подбуго-рья
— либеринов, статинов и/или нонапепти-дов.
Среди них выделяются:
S гипоталамический дизгонадизм;
S гипоталамический гипотироз;
S гипоталамические нарушения сомато-
маммотрофной функции; S |
гипоталамо- |
адреналовые дисфункции; S |
аномалии |
вазопрессиновой регуляции; S |
смешанные нарушения. |
В классической отечественной литературе с её холистическим подходом иногда применительнок таким расстройствам употребляется расширительный эпитет «церебральные», а с точки зрения свойственного классическимзападнымисточникамредукционного, дифференциальногоподходапредпочтителен термин«гипоталамические». Следовательно, встретив наименования
«церебральное ожирение», «церебральная дисмено-рея», «церебральная карликовость», читатель не должен думатьисключительноокоребольшихполушарийили воспринимать такие расстройства как лишённые органической топической основы. Их природа связана с патологией гипоталамуса.
Гипоталамический дизгонадизм известен в не-
скольких формах.
Преждевременное половое созревание (pubertatio praecox) мальчиков бывает результатом термином района III желудочка, инфильтрирующих гипоталамус. Эти опухоли, прежде именовавшиеся «эктопическими пинеаломами»,секретируютхорионическийгонадотропин
47

и а-фетопротеин. Первый обусловливает ускоренную и выраженную маскулинизацию, второй — имеет значение для их диагностики. У девочек преждевременное половое созревание — pubertatio praecox — может быть результатом гипоталамических гамартом, вырабатыва-
ющих люлиберин.
Препубертатной формой гипоталамического гипого-
надизма является синдром Кальмана (ольфакторно-
генитальная дисплазия). Аносмия сочетается с задержкой полового созревания, аменореей и бесплодием. У мужчин развивается первичная евнухоидность. Могут быть цветовая слепота, глухота, хейло-гнатопалатосхиз (расщелина губы и неба). Синдром трактуется как дизэмбриогенетическое нарушение, касающееся срединных структур мозга и черепа. Он носит семейный характер и чаще поражает мальчиков. Нарушается продукция
гонадолиберина, иногда — в сочетании с тиролибе-
рином. В этом случае лечебный эффект оказывает го-
надолиберин.
Постпубертатный гипоталамический гипого-
надизм (также: психогенная, церебральная аменорея или бесплодие) чаще бывает у женщин. Синдром выражается во вторичной гипоменорее или аменорее. Отсутствует пульсовой микроритм секреции гонадолиберина, и имеется ановуляция, несмотря на нормальные функциональные потенции гонадотрофов аденогипофиза и клеток яичников. Секреция ЛГ в ответ на гонадолиберин угнетена сильнее, чем ФСГ. Нередко у больных имеется гиперпролактинемия гипоталамического происхождения, связанная с нарушением сервомеханизмов контроля гипоталамической дофаминовой секреции эстрогенами. Нарушению секреции гонадолиберина и утрате её пульсового паттерна способствуют резкие изменения веса и физическая нагрузка. Именно поэтому синдром отмечается у балерин, спортсменок, больных психогенной анорексией-були- мией, а также в виде мужского бесплодия—у юношейспортсменов и у энтузиастов быстрого похудения обоего пола.
Гипоталамический гипотироз — редкое нару-
шение, при котором базальный уровень ТТГ нормален или слегка понижен, но ответ аденогипофиза на гипоталамическую стимуляцию отсрочен и усилен. Это может сочетаться с дефицитом продукции других либеринов.
Гипоталамические нарушения регуляции функций коры надпочечников наблюдаются при тяжелых хронических стрессах, у пациентов с реактивной депрессией и с аффективными расстройствами. Секреция КРФ у них перестаёт подавляться глюкокортикоидами. Утрачивается суточный ритм продукции КРФ и
48
АКТГ.Немаловажно,чтоаналогичныенарушениясвойственны и классической болезни Иценко-Кушинга, которая в определённом проценте случаев вызван именно кортиколиберин-продуцирующими автоном ными от серворегуляции опухолями гипоталамуса.
Гипоталамические причины могут провоцировать нарушения регуляции соматомаммотрофной функ-ции.
Идиопатическая гиперпролактинемия-амено-
рея (см. стр. 87) у женщин детородного возраста при исключённой пролактиноме гипофиза имеет гипота-ламическое происхождение и связана, как полагают, с ослаблением дофаминергической супрессиипролактиногенеза.
Психосоциальный нанизм описан впервые у вос-
питанников сиротских домов нацистской Германии В дальнейшем было установлено, что при хроничес-кой эмоциональной депривации и стрессе продукция соматостатина в гипоталамусе может быть усиле на, а реакция гипофиза на соматолиберин уменьше на, что приводит к торможению роста даже при полноценной диете. При благоприятном психоэмоци-ональном окружении рост восстанавливается. Очень близка по своим проявлениям к данному расстройству
идиопатическая недостаточность секреции СТГ
При этом расстройстве в гипофизе не отмечается ло-кальных патологических процессов, большинство па-циентов дают нормальный гипофизарный ответ на соматолиберин, однако собственная гипоталамичес-кая продукция соматолиберина,
тиролиберина,а иногда и гонадолиберина —
понижена. Некоторые гамартомы и ганглиоцитомы подбугорья могут выра-батывать соматолиберин. С ними связывают свое-образную патологическую форму высокорослости-церебральный гигантизм —
редкий синдром уско-рения роста и полового созревания с расширением мозговых желудочков и аномальной продукцией гипоталамических факторов, но без признаков СТГ-продуцирующих аденом гипофиза. Синдром нередко сопровождается гиперкортицизмом, липодистрофией и гепатоспленомегалией.
Комбинированные гипоталамические наруще-
ния обычно сочетают дефицит нескольких гормональ-ных функций в связи с разрушением клеток-продуцен-тов соответствующих либеринов. Их причиной чаще всего служат расположенные над турецким седлом негормонообразующие опухоли — краниофаринги-омы, составляющие до 5% всех внутричерепных но-вообразований. При этом могут сочетаться задержка полового развития, роста, гипотироз, гиперпро-лактинемия
и несахарный диабет. Неэндокринные проявления включают гидроцефальный синдром и на-
рушения зрения, связанные с травматизацией перекрестья зрительных нервов.
Более детальную характеристику ряда заболеваний, поражающих гипоталамус, читатель найдет ниже при клиническом описании гигантизма, нанизма, не-
сахарного диабета, пубертатно-юношеского диспитуитаризма, нарушений полового развития и пищевого поведения у подростков.
Нижний мозговой придаток — гипофиз или пи-
туитарная железа — связан с гипоталамусом ножкой и находится в фиброзной капсуле в турецком седле— углублении основной кости черепа. Вес его не превышает 900 мг, тем не менее этот микроорган ведает сложнейшими регуляторными функциями в отношении обмена веществ, функций периферических желёз, роста и размножения.
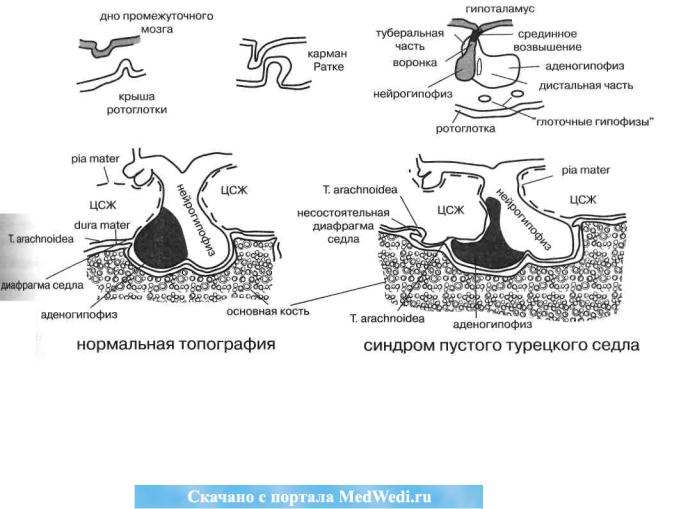
Он состоит из эмбриологически разнородных частей— аденогипофиза, происходящего из кармана Ратке (выпячивания крыши ротоглоточной эктодермы), и нейрогипофиза, опускающегося в эмбриогенезе вниз и навстречу в виде впячивания дна диэнцефальной нейроэктодермы третьего мозгового желудочка. Образуется сложный орган, объединённый общей сосудистой системой и капсулой и отделённый сверху от основания мозга выростом твёрдой мозговой оболочки — диафрагмой турецкого седла
(рис.18).
Уже надёжность защиты гипофиза отражает его исключительную роль в организме. «Ни один орган че-
ловеческого тела не защищен так хорошо, не расположен столь центрально и не спрятан столь тщательно» (Кушинг Х., 1930). Но диафрагма относительно других частей турецкого седла представляет более слабое место. При прободении этой диафрагмы из-за внутричерепной гипертензии гипофиз может сдавливаться и даже атрофироваться.
С этой особенностью связан развивающийся при первичной несостоятельности диафрагмы и тенденции к внутричерепной гипертензии синдром пустого (рас-
ширенного) турецкого седла (Буш К., 1951). Его рас-
пространенность (обнаружен в 5 % случаев аутопсий лиц, умерших при явлениях гипофизарной патологии) заставляет посвятить несколько строк данной аномалии локализации гипофиза. Типичные носители синдрома пустого турецкого седла — тучные, много рожавшие женщины, но он описан и у подростков, у которых нередко выявляется при применении МРТ. Подобные пациенты часто страдают артериальной гипертензией. Они нередко жалуются на головные боли, а 10 % даже отмечают ликворею из носа.
На фоне упомянутых выше анамнестических факторов, способствующих ликворной гипертензии, дивертикул арахноидной оболочки проникает в седло через несостоятельную диафрагму Аденогипофиз уплоща-
Рис. 18. Эмбриогенез (вверху) и топография(внизу) гипофиза в норме и при синдроме пустого турецкого седла (ЦСЖ — цереброспинальная жидкость)
49
